Frédérique Albarel-Loy |
Chers collègues,
C’est avec un grand plaisir que j’introduis cette nouvelle newsletter sur le thème de l’hormone de croissance (GH). La GH étant un vaste sujet, il a fallu faire des choix pour sélectionner des articles sur des thèmes variés, novateurs et originaux, afin de vous concocter une newsletter intéressante et attractive.
Nous avons donc choisi des articles sur les déficits en GH, mais aussi sur l’hypersécrétion en hormone de croissance, grâce à l’expertise des rédacteurs spécialisés dans ces thématiques, en ciblant des sujets d’actualité et d’autres moins connus des endocrinologues, pouvant intéresser l’endocrinologie adulte et pédiatrique ainsi que les spécialistes de la reproduction.
Dans un premier temps, nous avons ciblé les déficits en hormone de croissance, sur le versant métabolique, le rôle de le GH, peu connu, sur le tissu adipeux, sur le versant fertilité, son rôle potentiel dans la réponse ovarienne et le recrutement folliculaire et l’éventuel intérêt d’un traitement par GH en PMA et sur le versant pédiatrique, comment optimiser son efficacité sur la croissance de l’enfant grâce une stratégie personnalisée de traitement.
Nous avons également tenu à faire le point sur un article récent concernant l’avènement des formes de GH à libération prolongée en cours de développement qui pourraient d’ici peu intégrer le panel de traitements à notre disposition…
En ce qui concerne les hypersécrétions de GH, nous avons privilégié d’une part la vision du patient, avec une étude qualitative centrée sur le vécu du délai diagnostique par le patient atteint d’acromégalie et, d’autre part, la pratique, avec une étude sur le mode de suivi, notamment par imagerie, des patients acromégales traités médicalement par analogues de la somatostatine.
En espérant que les sujets sélectionnés vous passionneront et que vous passerez un bon moment dans le “monde de la GH”, nous vous souhaitons une excellente lecture !
F. Albarel-Loy déclare avoir des liens d’intérêts avec Pfizer, Ipsen, Novartis.
Florian Mourre, Sophie Béliard
Service de nutrition, maladies métaboliques et endocrinologie du Pr Valéro, hôpital de la Conception, AP-HM, Marseille.
D’après Kopchick JJ et al. The effects of growth hormone on adipose tissue: old observations, new mechanisms.Nat Rev Endocrinol 2019 [Epub ahead of print]
La capacité de l’hormone de croissance (GH) à induire la lipolyse est connue depuis plusieurs décennies, mais les mécanismes moléculaires sous-jacents ont été découverts il y a peu. La GH régule la balance entre l’estérification des acides gras libres et la lipolyse des triglycérides, et a donc un rôle central dans le métabolisme lipidique et l’homéostasie glucidique [1]. Les études réalisées depuis 50 ans sur des volontaires sains, des patients déficitaires en GH ou des sujets souffrant d’acromégalie montrent un puissant effet lipolytique de la GH, qui prédomine lors de l’état de jeûne et constitue un moyen d’obtenir de l’énergie à partir du tissu adipeux lors du jeûne. Un excès de GH entraîne une augmentation des acides gras libres et donc une insulinorésistance [2]. À l’inverse, un déficit en GH peut provoquer un accroissement du tissu adipeux. Les effets de la GH dépendent également du type de tissu adipeux, le tissu adipeux viscéral serait le plus affecté par les variations de GH chez l’homme : chez les sujets ayant un déficit en GH, le traitement réduit la masse grasse totale, avec une plus grande diminution observée sur les dépôts viscéraux [3].
Sur le plan moléculaire, on constate de nombreuses avancées récentes. Deux nouvelles cibles moléculaires ont notamment été découvertes : FSP27 (Fat Specific Protein 27), protéine impliquée dans la formation de la gouttelette lipidique et de la lipolyse, et PPARγ, facteur de transcription en cause dans le métabolisme lipidique et glucidique. Les voies moléculaires impliquées passent par MEK-ERK [4, 5].
Enfin, de nombreux mécanismes physiopathologiques du tissu adipeux ont été mis en évidence et nous éclairent sur certains rôles jusque-là inconnus de la GH comme :
- la sénescence cellulaire dans le tissu adipeux, avec toutes ses modifications métaboliques associées (augmentation des cytokines pro-inflammatoires, des facteurs de croissance et des protéases). L’action de la GH serait positivement corrélée à l’accumulation de cellules sénescentes dans le tissu adipeux chez la souris et participerait donc à l’augmentation de la lipolyse [6] ;
- la fibrose du tissu adipeux, avec une action de la GH qui serait corrélée à l’accumulation de matrice extracellulaire : les souris exprimant un excès de GH ont un excès de fibrose comparativement aux souris déficitaires en GH, ce qui limiterait l’expansion du tissu adipeux et du stockage lipidique, et favoriserait les dépôts ectopiques de graisses [7] ;
- les hétérogénéités du tissu adipeux sous-cutané blanc, avec la découverte récente de 4 sous-populations adipocytaires sur lesquelles la GH aurait une action différentielle [8].
En conclusion, les effets lipolytiques de la GH, antagonistes de ceux de l’insuline, sont connus depuis longtemps, mais les acteurs moléculaires au sein du tissu adipeux ont été identifiés récemment. Les études animales et cellulaires révèlent des cibles et des actions multiples de la GH au sein du tissu adipeux. Au final, la GH jouerait probablement un rôle très fin et pointu sur l’homéostasie du tissu adipeux !
Références bibliographiques
1. Møller N, Jørgensen JO. Effects of growth hormone on glucose, lipid, and protein metabolism in human subjects. Endocr Rev 2009;30:152-77.
2. Rabinowitz D, Zierler K. L. A metabolic regulating device based on the actions of human growth hormone and of insulin, singly and together, on the human forearm. Nature 1963;199:913-5.
3. Johannsson G. et al. Growth hormone treatment of abdominally obese men reduces abdominal fat mass, improves glucose and lipoprotein metabolism, and reduces diastolic blood pressure. J Clin Endocrinol Metab 1997;82:727-34.
4. Sharma R. et al. Growth hormone controls lipolysis by regulation of FSP27 expression. J Endocrinol 2018;239:289-301.
5. Sharma VM et al. Growth hormone acts along the PPARγ-FSP27 axis to stimulate lipolysis in human adipocytes. Am J Physiol Endocrinol Metab 2019;316:E34-42.
6. Stout MB et al. Growth hormone action predicts age-related white adipose tissue dysfunction and senescent cell burden in mice. Aging (Albany NY) 2014;6:575-86.
7. List EO et al. Adipocyte-specific GH receptor-null (AdGHRKO) mice have enhanced insulin sensitivity with reduced liver triglycerides. Endocrinology 2019;160:68-80.
8. Min SY et al. Diverse repertoire of human adipocyte subtypes develops from transcriptionally distinct mesenchymal progenitor cells. Proc Natl Acad Sci USA 2019;116:17970-9.
F. Mourre déclare avoir des liens d’intérêts avec Novo Nordisk.
S. Béliard n’a pas précisé ses éventuels liens d’intérêts.
chez les femmes ayant une faible réserve ovarienne
Anaïs Nuttall, Blandine Courbière
Centre clinicobiologique d’assistance médicale à la procréation, pôle femmes-parents-enfants, AP-HM, hôpital de la Conception, Marseille.
Dans les protocoles de stimulation ovarienne pour fécondation in vitro (FIV), l’intérêt de l’adjonction d’hormone de croissance (GH) pour améliorer la réponse ovarienne est actuellement débattu, une étude randomisée récente n’ayant pas démontré son intérêt pour améliorer les taux de naissances vivantes [1]. En effet, la GH aurait un effet positif sur le recrutement folliculaire, via une action stimulante de l’insulin-like growth factor-1 (IGF-1). M.H. Cai et al. présentent une étude rétrospective cas-témoins analysant l’intérêt d’un traitement adjuvant par 6 semaines de 2 UI de GH sur les taux de naissances par FIV chez des femmes présentant une diminution de la réserve ovarienne (DRO), définie par les critères de POSEIDON (hormone antimüllerienne (AMH) < 1,2 ng/mL et compte des follicules antraux [CFA] < 5) [2].
Au total, 338 cycles de femmes ne recevant pas de traitement par GH (GH-) ont été appariés (âge, IMC) et comparés à 338 cycles de femmes traitées par GH (GH+). Les caractéristiques des groupes étaient comparables. Dans le groupe GH+, plus de cycles ont été annulés en vue d’un transfert d’embryon congelé ultérieur. Les taux de naissances n’ont été étudiés que chez les femmes ayant bénéficié d’un transfert frais (87 cycles GH+ versus153 cycles GH-). Le taux de naissance cumulé (transfert d’embryon frais + embryon congelé) n’a pas été rapporté.
Il n’a pas été retrouvé de différence significative entre les 2 groupes concernant le nombre d’ovocytes matures (2,39 ± 2,27 versus2,32 ± 2,21) et le nombre d’embryons obtenus (1,90 ± 1,95 versus1,83 ± 1,86). Les taux de grossesses cliniques étaient similaires (35,7 % dans le groupe GH+ versus36,6 %). En revanche, il a été observé une augmentation du taux de naissances vivantes dans le groupe GH+ (29,9 versus 17,65 % ; p = 0,028) du fait d’une diminution des fausses couches (13,33 versus 41,30 % ; p = 0,009). Dans une analyse en sous-groupes, seules les femmes de plus 35 ans avaient un bénéfice à la suite du traitement par GH, avec une baisse significative du taux de fausses couches (60 versus 18,2 %) et un accroissement des taux de naissances vivantes (36,7 versus 23 %).
Les auteurs concluent à l’intérêt d’un traitement adjuvant avec GH en FIV chez les femmes de plus de 35 ans ayant une DRO pour augmenter les taux de naissances et diminuer les taux de fausses couches. Cependant, dans cette étude bas niveau de preuve (NP4), de nombreux biais méthodologiques incitent à interpréter ces résultats avec précaution.
Références bibliographiques
1. Norman RJ et al. Human growth hormone for poor responders: a randomized placebo-controlled trial provides no evidence for improved live birth rate. Reprod Biomed Online 2019;38:908-15.
2. Cai MH et al. The Effect of Growth Hormone on the Clinical Outcomes of Poor Ovarian Reserve Patients Undergoing invitro Fertilization/Intracytoplasmic Sperm Injection Treatment: A Retrospective Study Based on POSEIDON Criteria. Front Endocrinol (Lausanne) 2019;10:775.
B. Courbière n’a pas précisé ses éventuels liens d’intérêts.
la pratique
Sarah Castets
Service de pédiatrie multidisciplinaire, hôpital de la Timone, Marseille.
D’après Wit JM et al. Achieving Optimal Short- and Long-term Responses to Paediatric Growth Hormone Therapy, J Clin Res Pediatr Endocrinol 2019;11(4):329-40.
Plus de 30 ans après les débuts de l’utilisation de l’hormone de croissance (GH) recombinante chez l’enfant, les études pangénomiques et en NGS (next-generation sequencing) apportent de nos jours un éclairage sur les différentes causes de petite taille. La plaque de croissance joue un rôle central dans les troubles de la croissance chez l’humain, les gènes responsables de la petite taille étant plus fréquemment impliqués dans sa régulation que dans la régulation de l’axe GH-insulin-like growth factor-1 (IGF-1), avec une distinction de plus en plus floue entre petite taille idiopathique et dysplasie osseuse. Des stratégies de traitement personnalisé par GH découlent de ces connaissances, la réponse au traitement étant très dépendante des mécanismes impliqués. L’objectif du traitement chez l’enfant est d’atteindre une taille cible correspondant à la taille cible génétique, tout en assurant la sécurité du traitement.
Les modèles prédictifs existants ont montré que la réponse au traitement est meilleure en cas de déficit, le facteur le plus important étant alors la profondeur du déficit, alors que la réponse en cas de syndrome de Turner ou de retard de croissance intra-utérin (RCIU) dépend surtout de la dose de GH de départ. Quelle que soit l’étiologie, le traitement sera plus efficace s’il est débuté à un âge plus jeune [1]. Le pronostic de taille adulte dans toutes les étiologies est fortement corrélé au gain de taille à 1 an de traitement, qui doit donc être documenté systématiquement. En cas de mauvaise réponse (gain < 0,3-0,5 DS à 1 an), les différentes étapes (figure) consistent à évaluer l’observance et la bonne compréhension du traitement, éliminer une pathologie associée pouvant affecter la croissance (maladies inflammatoires chroniques de l'intestin [MICI], hypothyroïdie, etc.), réévaluer le diagnostic initial et vérifier que la posologie de départ est adaptée à l’étiologie (jusqu’à 50 µg/kg/j en cas de syndrome de Turner ou de RCIU en début de traitement, diminution progressive possible jusqu’à 35 µg/kg/j en cas de RCIU, les doses importantes étant surtout efficaces pour la réponse initiale, mais sans bénéfice sur la taille finale si poursuite sur le long terme) [1].
La récente étude de tolérance du traitement par GH de la cohorte GeNeSIS [2],suivie pendant 4,2 ans en moyenne, avec des doses d’hormone de croissance classiques selon l’indication, retrouve bien un risque augmenté de diabète de type 2 chez les enfants traités par GH, mais seulement en cas de facteur de risque préexistant (syndrome de Turner ou antécédent d’irradiation corps entier en particulier). Les effets indésirables les plus fréquents déclarés étaient les suivants : céphalées, hypothyroïdie, scoliose, troubles de l’attention et arthralgies, avec là encore des différences en fonction de la pathologie sous-jacente. Les données sont par ailleurs rassurantes pour ces posologies concernant le risque de cancer primaire ou le risque vasculaire cérébral qui n’est pas augmenté dans cette cohorte. Des taux supraphysiologiques d’IGF-1 sont cependant parfois nécessaires pour obtenir une croissance satisfaisante chez les sujets non déficitaires ; mais dans ce cas, les risques, en particulier néoplasiques, sont mal connus, limitant la possibilité d’augmentation de la posologie de GH. Il faut donc savoir dans ces situations arrêter le traitement au bout de 1 an, en l’absence de réponse satisfaisante.
Enfin, quel que soit le diagnostic initial, la question de l’observance sera centrale [1]. Son évaluation doit se faire à chaque consultation, dès le début du traitement. La connaissance des facteurs influençant l’observance aux différentes périodes du traitement, l’apprentissage de techniques d’entretien motivationnel par l’endocrinologue et la mise en place de programmes d’éducation thérapeutique étant ici essentiels (figure).
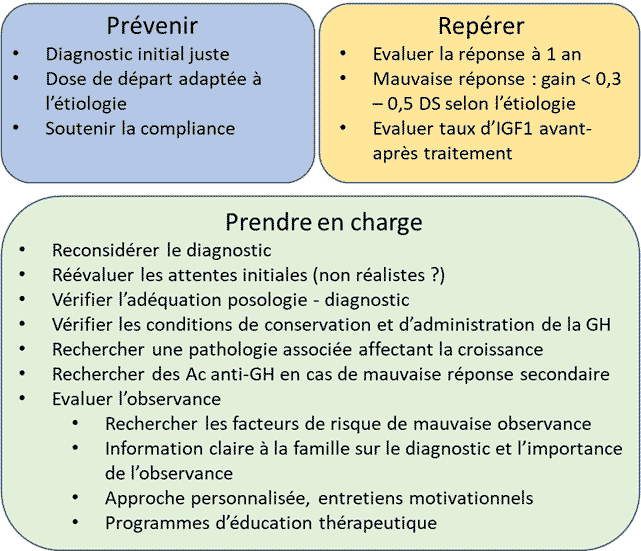
Figure. Stratégie de prise en charge des enfants présentant une mauvaise réponse au traitement par hormone de croissance [1, 2].
Références bibliographiques
1. Collett-Solberg PF et al. Growth hormone therapy in children; research and practice - A review. Growth Horm IGF Res 2019;44:20-32.
2. Child CJ et al. Safety Outcomes During Pediatric GH Therapy: Final Results From the Prospective GeNeSIS Observational Program. J Clin Endocrinol Metab 2019;104(2):379-89.
Aude Brac de la Perrière
Fédération d’endocrinologie, groupement hospitalier Est, Hospices civils de Lyon.
D’après Miller BS et al. Long-Acting Growth Hormone Preparations - Current Status and Future Considerations. J Clin Endocrinol Metab 2019 [Epub ahead of print]
Cet article de synthèse fait le point sur les formes retard d’hormone de croissance LAGH (long acting growth hormone), en soulignant les limites de leur développement en termes de sécurité d’emploi sur le long terme, d’efficacité et de modalité d’adaptation. Une revue de la littérature a été menée de janvier 2000 à juin 2019. L’hormone de croissance recombinante d’origine humaine (rhGH), développée en 1980, a montré son efficacité (croissance chez l’enfant ; effet métabolique et qualité de la vie chez l’adulte), mais souffre de la mauvaise observance évaluée à moins de 30 %, liée à son injection quotidienne. Deux méthodologies sont utilisées pour créer une LAGH : soit un dépôt sous-cutané avec libération prolongée dans la circulation d’une forme native ou modifiée de GH, soit une absorption rapide dans la circulation avec une libération prolongée. Il existe actuellement 5 formes de LAGH selon le mécanisme utilisé pour allonger la durée d’action (tableau) : la technologie des microsphères où la rhGH native est libérée sous l’action d’une hyaluronidase tissulaire, la rhGH pégylée qui augmente la durée de vie mais aussi la masse moléculaire, les prodrogues liant la rhGH native de façon réversible (liaison covalente) à un transporteur, la rhGH modifiée ayant une affinité augmentée pour les protéines du sérum (liaison non covalente) qui est une technique déjà largement utilisée pour d’autres formes retard (insuline retard, GLP-1 [glucagon-like peptide-1] retard), ou encore les protéines de fusion (protéine ou peptide) qui réduisent aussi la clairance et augmentent la masse moléculaire. À l’heure actuelle, seules 2 LAGH, issues de rhGH non modifiées, ont été approuvées par la FDA (Food and Drug Administration) ou l’EMA (European Medicines Agency) : somatropin et LB03002. Deux autres sont commercialisées en Corée du Sud (rhGH somatropin) et en Chine (PEGrh somatotropin) ; les autres préparations à base de rhGH modifiée en sont encore à leurs balbutiements.
Le développement de ces formes retard se heurte cependant à de nombreuses questions encore non résolues :
- les effets indésirables attendus, communs à ceux de la forme non retard ;
- mais aussi ceux liés aux process de la forme retard, l’intolérance au site d’injection (lipoatrophie), le développement d’anticorps anti-GH modifiée ;
- l’effet inconnu de fortes concentrations transitoires de GH et d’IGF-1 (insulin-like growth factor-1) ou d’absence de pic nocturne (risque d’hypoglycémie chez l’enfant) ;
- l’absence de connaissance du profil pharmacocinétique précis de chaque molécule, dont la demi-vie et les concentrations peuvent varier d’un produit à l’autre ;
- la biodisponibilité de ces formes retard, qui dépend à la fois de la taille et de la structure moléculaire de la LAGH (accessibilité au tissu cible mal connue) ou encore de la liaison à un vecteur (dépend de l’affinité) ;
- le timing idéal du contrôle du taux d’IGF-1 pour adapter le traitement en fonction de chaque type de forme retard.
Face à cette diversité et à la spécificité d’action de chaque molécule de LAGH en développement, les études actuelles à court terme ne répondent pas de façon satisfaisante aux interrogations existantes sur la sécurité d’emploi de ces molécules qui justifieront d’une pharmacovigilance et d’études post-marketing afin de valider leur intérêt et leur sécurité d’emploi. Concernant le développement des LAGH, seules des études de non-infériorité ont été publiées pour l’instant, lors de protocoles de courte durée ; de nombreuses données manquent encore pour qu’elles puissent remplacer les formulations journalières actuelles : modalités d’adaptation des doses, monitoring de l’IGF-1, rapports bénéfice/risque et coût/efficacité.
Tableau. Principales formes à libération prolongée (LAGH) en cours de développement.
|
Produit |
Modification de la molécule de GH |
Fréquence d’adminis- |
Statut actuel |
Recherche |
Depot formulation |
Depot Chemical |
||||
LG Life |
rGH Somatropin LB03002 |
Microparticules contenant GH incorporée dans sodium hyaluronate et dispersée dans une base huileuse de TG à chaîne moyenne (22 kDa) |
7 jours |
Commercialisé Corée pour CGHD |
Étude de phase III chez l’enfant suggère une non-infériorité |
PEGylated formulations |
PEGylation prolongs in vivo mean residence time of GH, through slowing absorption and protection from proteolysis |
||||
GeneScience |
PEC-rhGH |
40-kDa PEG attaché à la GH (62 kDa) |
7 jours |
Commercialisé Chine pour CGHD |
Études de phase III montrent un bon profil de l’IGF-1 |
Pro-Drug formulation |
Mechanism of conversion to active drug |
||||
Ascendis |
ACP-001 |
rhGH non modifiée liée transitoirement à une molécule de PEG via une liaison dépendante du pH et de la température (22 kDa) |
7 jours |
Études de phase II chez CGHD et AGHD montrent un profil IGF-1 comparable de la GH journalière |
Étude de phase III chez CGHD en cours |
Non-covalent albumin binding GH compounds |
Albumin binding |
||||
Novo Nordisk |
Somapacitan (NNC0195-0092) |
Mutation ponctuelle de la GH, avec une liaison non covalente à l’albumine (23 kDa) |
7 jours |
Études de phase II chez CGHD montrent une IGF-1 comparable |
Études de phase III chez CGHD |
GH Fusion Proteins |
Protein fused with GH |
||||
Genexine and Handok |
GH-H9 |
rhGH fusionnée à immunoglobuline une non-cytolytique Fc fractions d’IgD et IgG4 (100 kDa) |
7-14 jours |
Études de phase II chez AGHD terminée |
Études de phase III chez CGHD avec 2 doses par mois en cours |
Hanmi |
HM10560A |
Fc IgG4 non glycosylée homodimérique |
7-14 jours |
Phase II chez AGHD montre une bonne tolérance |
Études de phase III chez AGHD |
OPKO Health and Pfizer |
MOD-4023 |
rhGH fusionnée à 3 copies d’un peptide carboxyl-terminal (CTP) sous-unité B de hGH (47,5 kDa) |
7 jours |
Études de phase II chez CGHD |
Étude de phase III chez CGHD |
AGHD : déficit acquis à l’âge adulte ; CGHD : déficit acquis dans l’enfance.
A. Brac de la Perrière déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Emmanuelle Kuhn
Assistance Publique-Hôpitaux de Paris, Hôpitaux universitaires Paris-Saclay, Hôpital de Bicêtre, Service d'endocrinologie et des maladies de la reproduction, Centre de référence des maladies rares de l'hypophyse, F-94275, Le Kremlin-Bicêtre.
D’après Sibeoni J et al. Patients' perspectives on acromegaly diagnostic delay: a qualitative study. Eur J Endocrinol 2019;180(6):339-52.
Le délai moyen entre l’apparition des symptômes liés à l’acromégalie et le diagnostic est souvent de plusieurs années, conduisant au développement de comorbidités et à un retentissement psychosocial pour le patient. Pour la première fois, une étude s’est intéressée au vécu des patients concernant ce retard diagnostique. Il s’agit d’une étude qualitative monocentrique reposant sur des entretiens individuels, incluant 20 patients atteints d’acromégalie (11 femmes, 9 hommes) ayant des parcours différents (durée de la maladie, traitements, comorbidités). Comme nous pouvons l’imaginer, le moment clé du vécu de leur maladie est le diagnostic. En effet, avant que celui-ci ne soit posé, les patients arrivent à bien identifier les symptômes liés à l’acromégalie, même si leur apparition est décrite comme insidieuse. Ils ont des difficultés à “mettre des mots sur leurs symptômes”, ce qui peut les gêner pour en parler à leur médecin généraliste. Un sentiment d’étrangeté et l’impression de “ne pas se reconnaître” sont également bien décrits. Certains patients tentent de trouver des “explications logiques” (comme l’âge, l’hérédité ou leur environnement familial et professionnel). De manière intéressante, ils expriment le ressenti qu’ils ont eu des médecins de “1ère ligne” qu’ils ont pu rencontrer avant le diagnostic (“ceux qui ne savent pas”, “ceux qui cherchent mais ne trouvent pas”, “ceux qui ne voient pas”, “ceux qui n’y croient pas” et “ceux qui n’écoutent pas”). Le moment du diagnostic est vécu comme une fin tragique où les patients sont soulagés, mais également anxieux avec la peur de devenir “un monstre”, du rejet de sa propre image et de son propre corps. Certains décrivent même un retentissement sur leur vie de couple et de famille mais aussi sur le plan social (isolement). Les médecins posant le diagnostic sont décrits selon 3 types : “ceux qui établissent le diagnostic au 1er coup d’œil”, “ceux qui posent les bonnes questions” et “ceux qui ont un éclair de génie”. La rencontre avec le spécialiste est vécue comme un moment de soulagement avec le sentiment de confiance et d’être pris en charge par un centre spécialisé. Après le diagnostic, les réactions des médecins généralistes, telles qu’elles sont décrites par les patients, sont variables (ils peuvent être vexés, se sentir coupables de pas avoir fait le diagnostic ou rester indifférents).
Les patients suggèrent des solutions pour diminuer le retard diagnostique, notamment en améliorant les connaissances des différents praticiens consultés pour les différents symptômes, en apportant le témoignage de patients experts auprès des étudiants en médecine afin de les sensibiliser, mais également en réalisant des campagnes d’information à destination du grand public.
Nous devons donc poursuivre nos efforts afin que nos collègues soient sensibilisés aux symptômes qui doivent faire évoquer une acromégalie. Cette étude, au-delà de nous faire partager le ressenti des patients acromégales sur leur errance diagnostique, souligne l’importance de la relation patient-médecin, et notamment la nécessité d’être à l’écoute des symptômes décrits, mais aussi de les laisser s’exprimer sur leur vécu afin de prévenir les conséquences à la fois sur le plan psychologique mais aussi social.
E. Kuhn déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Thomas Cuny
Service d’endocrinologie, diabète, maladies métaboliques, hôpital de la Conception, Marseille.
Ce travail unicentrique rétrospectif de Grandgeorge N et al. [1] incluait 83 patients souffrant d’acromégalie, traités par analogues somatostatinergiques (SMSa). Au total, 36 patients étaient en rémission biochimique (groupe “contrôlés”, IGF-1 [insulin-like growth factor-1] normale pour âge/sexe et GH < 2,5 ng/mL), alors que 47 répondant partiellement au SMSa (diminution ≥ 10 % de l'IGF-1 initiale, sans normalisation) étaient traités par une approche multimodale (agonistes dopaminergiques, chirurgie, pegvisomant, radiothérapie). Au diagnostic, le diamètre moyen maximal de l'adénome était de 11,9 ± 4,8 mm dans le groupe “contrôlés” et de 13,6 ± 4,5 mm dans le groupe “réponse partielle” (p = 0,03). Le suivi de ces 2 groupes était respectivement de 8,9 ± 4,9 et de 2 ± 1,6 années (p < 0,001), sans qu'aucune augmentation au niveau de la taille de l'adénome ne soit constatée dans l'ensemble de la population de l’étude par une appréciation neuroradiologique à l'aveugle. Dans le groupe “contrôlés”, une diminution significative de la taille de l'adénome était même observée, passant en moyenne de 11,9 ± 4,8 mm à 9,6 ± 3,3 mm lors la dernière évaluation disponible (p = 0,01). À noter, la réduction en taille de l'adénome avant et pendant le traitement par SMSa n'était pas significativement plus importante dans le groupe “contrôlés” (2,4 ± 3,5 mm) que dans le groupe “réponse partielle” (2,1 ± 2,6 mm) (p= 0,9).
À l'instar d'un travail précédent, dans lequel la normalisation de la prolactine des patients atteints de macroprolactinomes traités par agonistes dopaminergiques s'accompagnait d'une absence de progression tumorale [2], les résultats de cette étude rétrospective ne justifieraient donc plus la réalisation systématique d'une IRM hypophysaire pour la surveillance des patients acromégales, asymptomatiques et en rémission biochimique, traités par SMSa sur le long terme.
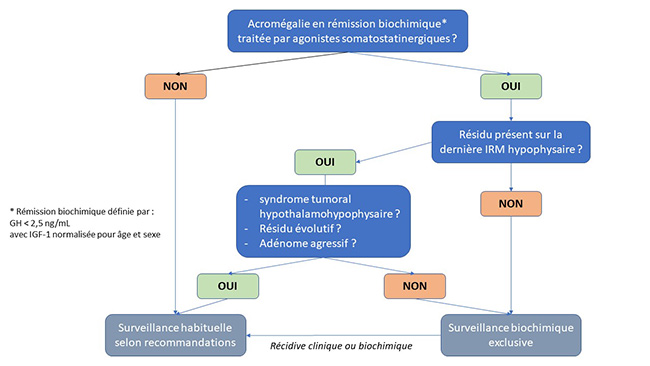
Figure. Proposition d'algorithme de surveillance des patients atteints d’acromégalie traités par analogues somatostatinergiques (d’après [1]).
Références bibliographiques
1. Grandgeorge N et al. Is MRI follow-up relevant in patients with GH-secreting pituitary adenomas primarily treated and responsive to long-acting somatostatin analogues (SMSa)? Eur J Endocrinol 2020;182(1):123-30.
2. Eroukhmanoff J et al. MRI follow-up is unnecessary in patients with macroprolactinomas and long-term normal prolactin levels on dopamine agonist treatment. Eur J Endocrinol 2017;176(3):323-8.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 Paris– Courriel : webmaster@sfendocrino.org
