La lettre de la Reproduction – Janvier 2013
  |
|
|
|
|
ÉDITO Deux nouveaux rôles pour les neurones KiSS (ou KNDY) L’implication des neurones KiSS dans l’axe gonadotrope a débuté en 2003, suite à la description d’une famille comprenant plusieurs cas d’hypogonadisme hypogonadotrophique. Une mutation perte de fonction du récepteur GPR54 a été décrite chez les sujets atteints. Le ligand de ce récepteur est la protéine Kiss, sécrétée par des neurones hypothalamiques. Le récepteur GPR54 est aussi appelé KiSS1R. Ces neurones sécrètent non seulement la protéine KiSS mais aussi la neurokinine et la DYnorphine, d’où leur appellation plus récente de neurones KNDY (Kisspeptin/NeurokininB/Dynorphin). Le rôle de ces neurones dans la régulation de l’axe gonadotrope est actuellement bien connu. Il a été montré que le récepteur GPR54 était localisé sur la membrane des neurones à GnRH. Les neurones KNDY intègrent les signaux de rétrocontrôle des stéroïdes, mais aussi de la nutrition et, dans certaines espèces, de la lumière. Deux nouveaux rôles de ces neurones viennent d’être décrits, le premier dans l’hyperprolactinémie, le deuxième dans les bouffées de chaleur postménopausiques.
|
|
  |
|
|
Kiss, le chaînon manquant entre l’hyperprolactinémie et l’infertilité L’hyperprolactinémie est une étiologie fréquente de troubles du cycle et la deuxième cause d’infertilité par anovulation chez la femme après le syndrome des ovaires polykystiques. Ces taux élevés de prolactine induisent une altération de la pulsatilité de la GnRH dont les mécanismes moléculaires n’étaient pas connus, car très peu de neurones à GnRH expriment le récepteur de la prolactine, ce qui a ouvert les portes à la recherche d’un système neuronal intermédiaire. Les neurones à kisspeptine et leur récepteur KiSS1R, puissants stimulateurs de la GnRH, étaient les candidats idéaux. Un modèle de souris hyperprolactinémiques mimant la pathologie chez la femme a été utilisé. Il a été obtenu à la suite de l’administration continue de prolactine par une pompe s.c. Dans ce modèle, les chercheurs ont montré un arrêt de la cyclicité, une anovulation et une baisse de l’expression de kisspeptine au niveau hypothalamique (1). Ce déficit gonadotrope a pu secondairement être restauré par l’administration de kisspeptine recombinante. De plus, des expériences complémentaires réalisées in vitro ont montré que la sécrétion de GnRH était altérée en présence de prolactine et que la kisspeptine était capable de restaurer une sécrétion normale de GnRH. Cette série d’expériences met en lumière le chaînon manquant de l’hypogonadisme dans cette pathologie fréquente (figure). Suite à cette démonstration, le peptide kiss pourrait servir de thérapeutique alternative pour restaurer la fertilité des femmes dont les adénomes sont résistants aux traitements actuels. 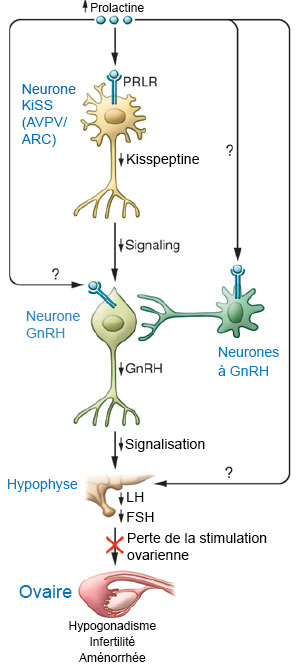  Figure. Régulation de l’hyperprolactinémie au niveau de l’axe gonadotrope. La prolactine se lie à son récepteur situé sur la membrane des neurones Kiss qui, à leur tour, induisent la régulation de la sécrétion de GnRH, puis de FSH et de LH et donc d’estradiol par l’ovaire. Référence bibliographique
Kiss, enfin une explication pour les bouffées de chaleur ? Lors de la ménopause, la majorité des femmes subissent des bouffées de chaleur. Par ailleurs, les hommes traités par antiandrogènes dans le cadre d’un cancer de la prostate peuvent aussi présenter des bouffées de chaleur. Il était classique de corréler leur présence à une baisse soit de l’estradiol, soit de la testostérone, et surtout à une élévation du taux de l’hormone follicostimulante ou de la pulsatilité de la l’hormone lutéinisante. Cependant leur mécanisme n’était pas élucidé. Dans une étude publiée en novembre 2012 dans Proceedings of the National Academy of Sciences, N. Reame et al. suggèrent l’implication des neurones KiSS ou KNDy (Kisspeptin/NeurokininB/Dynorphin), dans la genèse des bouffées de chaleur et des réponses vasoactives (1). Ces neurones expriment le récepteur des estrogènes ER?. Ils auraient des projections allant vers le noyau préoptique où sont localisés certains thermoeffecteurs. Le modèle utilisé est celui de rates, chez qui la déprivation en estrogènes modifie la thermorégulation. Le principe est de mesurer la température de la queue du rat, afin d’évaluer la vasodilatation et l’activation des effecteurs de perte thermique. Dans une première expérience, les neurones KNDy ont été détruits de manière sélective chez ces animaux par des injections stéréotaxiques d’une neurotoxine, la saporine. La destruction de ces neurones a induit une diminution de la vasodilatation cutanée de la queue des rats. Dans un deuxième temps, les animaux ont reçu un traitement par estradiol. En l’absence de neurones KNDy, il existe une perte de l’effet de l’administration d’estradiol sur la température, ainsi qu’une altération de la régulation de la température lors d’une exposition dans une atmosphère de 33 °C. Ces expériences suggèrent pour la première fois un mécanisme expliquant les modifications de la vasodilatation cutanée, et donc possiblement les bouffées de chaleur de l’espère humaine : les neurones KNDY. Référence bibliographique
|
|
  |
|
|
Attention à la metformine sur le fonctionnement testiculaire lors d’une exposition intra-utérine ! La metformine, le plus vieil insulino-sensibilisateur prescrit dans le traitement du diabète de type 2, est largement utilisée depuis une vingtaine d’années par les femmes présentant des troubles de la reproduction associés à une insulinorésistance comme le syndrome des ovaires polykystiques (SOPK). Si cette molécule n’a pas un effet supérieur à celui du citrate de clomiphène comme traitement d’infertilité, il est encore fréquent de voir une coadministration chez les femmes atteintes de SOPK en cas d’induction d’ovulation ou de fécondation in vitro (FIV) avec le citrate de clomiphène. Son utilisation repose sur une amélioration de la sensibilité à l’insuline et sur une augmentation du taux d’ovulation. Le bénéfice de sa prescription pendant la grossesse est en revanche insuffisamment montré. La metformine traverse la barrière placentaire et est présente aux mêmes concentrations dans le cordon ombilical que dans le sang périphérique maternel. Son innocuité sur le développement embryonnaire n’est pas montrée. L’étude chez l’homme de l’effet de la metformine sur le tissu testiculaire n’est pas réalisable et ne peut se faire que dans des modèles in vitro. L’exposition à la metformine semble donc avoir des effets délétères sur la production des stéroïdes mâles et sur le développement des testicules fœtaux en première partie de grossesse. Cette étude soulève un doute concernant la prescription de metformine au premier trimestre de la grossesse chez des femmes insulinorésistantes. Le rôle potentiel sur la gonade féminine est en cours d’évaluation. Référence bibliographique Quelle est la fréquence des anomalies ovariennes chez les femmes en aménorrhée hypothalamique ? L’aménorrhée hypothalamique fonctionnelle (AHF) est une cause fréquente d’anovulation. Des séries anciennes ont rapporté une prévalence d’ovaires polymicrokystiques échographiques (PolyCystic Ovarian Morphology [PCOM]) de 30 à 50 % dans la population de femmes présentant une AHF. Le PCOM a été défini en 2003 dans le consensus de Rotterdam par la présence, sur au moins 1 des 2 ovaires, d’un excès folliculaire défini par au moins 12 follicules antraux et/ou par un volume ou une surface ovariens augmentés. Plus récemment, il a été établi que des taux élevés (supérieurs à 35 pmol/l) d’hormone antimullérienne (Anti-Müllerian Hormone [AMH]) constituaient également un marqueur fiable de l’excès folliculaire caractéristique du syndrome des ovaires polycystiques (PolyCystic Ovarian Syndrom [PCOS]). Le sigle PCO-L (Polycystic Ovary Like abnormalities) est utilisé pour définir les 2 marqueurs d’excès folliculaire que sont le PCOM et l’AMH élevée. Le but de cette étude est de vérifier la présence ou non de PCO-L chez les femmes ayant une AHF et d’en établir une prévalence (1). Cette étude rétrospective a comparé 2 populations : 58 femmes ayant une AHF et 219 femmes témoins. Une analyse par clusters a été réalisée pour définir de manière mathématique, et donc plus objective, différents sous-groupes homogènes. Dans le groupe des témoins, l’analyse par clusters a permis d’identifier 2 sous-groupes relativement homogènes : 76 % sans PCO-L (cluster 1) et 24 % avec PCO-L (cluster 2). Dans le groupe des AHF, l’analyse par clusters a permis d’identifier 3 sous-groupes relativement homogènes : 52 % AHF sans PCO-L (cluster 1), 38 % AHF avec PCO-L (cluster 2) et 10 % AHF avec des marqueurs de PCO-L très prononcés (cluster 3) [figure]. La prévalence du PCOM (70 %) était significativement plus élevée dans le cluster 2 que dans le cluster 1 de la population d’AHF. Les médianes d’AMH et de testostérone étaient également significativement plus élevées dans le cluster 2 que dans le cluster 1 du groupe des AHF. La même constatation était observée pour les clusters 1 et 2 du groupe de femmes témoins. Les patientes du cluster 2 dans le groupe d’AHF présentaient des marqueurs PCO-L similaires à celles du cluster 2 des témoins. Cette donnée confirme donc l’existence possible de PCOM et/ou de taux élevés d’AMH chez des femmes ayant une AHF. En cas de guérison de l’AHF ou de mise en route d’un protocole d’induction d’ovulation de type pompe à GnRH, la présence de PCO-L peut soit évoluer vers un PCOS comme déjà décrit, soit rester stable et correspondre à un état d’ovaires spontanément multifolliculaires tel que cela est rapporté dans la population générale de femmes témoins normo-ovulantes. En conclusion, la constatation de PCOM et/ou d’une AMH élevée isolément lors de l’exploration d’une aménorrhée secondaire ne doit pas faire porter à tort trop hâtivement le diagnostic de PCOS. En effet, comme cela a déjà été mis en exergue lors du consensus de Rotterdam, le PCOS reste un diagnostic d’exclusion. Il conviendra d’avoir éliminé toutes les autres causes d’anovulation (dont l’AHF) et/ou l’hyperandrogénie par un bilan gynécoendocrinien complet. 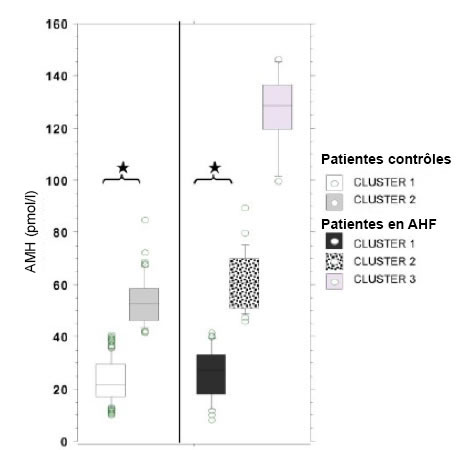  Figure. Taux d’AMH (pmol/l) selon les différents clusters de patientes : patientes contrôles ou patientes en aménorrhée hypothalamique fonctionnelle (AHF). Il existe un groupe (cluster 3) de patientes en aménorrhée hypothalamique avec un taux d’AMH très élevé. Référence bibliographique |
|
  |

