
Accédez au site  |
Accédez au  |
 |
Lettre N°7 - février 2013 |
[ÉDITORIAL] Échos du congrès national [L'ACTUALITÉ COMMENTÉE] [L'IMAGE COMMENTÉE] Chimioembolisation d’une métastase hépatique neuroendocrine |
[MISES AU POINT SUR ...] [CONFRONTATION ANATOMOCLINIQUE] |
Échos du congrès national
Françoise Borson-Chazo (Lyon)
Créé en 2003, le GTE va entrer dans sa dixième année. Groupe multidisciplinaire par essence, il a su trouver sa place et promouvoir des actions de formation, d'information, de recherche : organisation de cours, actualisation des recommandations avec, cette année, l’élaboration d’arbres décisionnels d’oncogénétique avec le réseau des laboratoires et la mise en place d’une base de données nationale en cours d’harmonisation avec la base européenne ENETS. La promotion de la recherche se traduit par l’attribution d’un fonds de recherche mutualisé et par la mise en place de protocoles multicentriques et de nombreuses publications. Les réseaux cliniques partenaires RENATEN et TENpath contribuent par ailleurs à l’amélioration de la prise en charge des patients. Après 3 années passées à la présidence du GTE, j’arrive au terme de mon mandat et je souhaitais remercier les membres du bureau, du conseil scientifique et d’administration, ainsi que tous ceux qui contribuent par leur implication et leur travail à faire du GTE un groupe dynamique. Nul doute que les actions seront poursuivies et amplifiées par le nouveau bureau qui sera élu en début d’année !
Bonne lecture et très belle année 2013 à tous !

Fonds de recherche 2012 du Groupe d’étude des tumeurs endocrines (GTE) en partenariat avec les laboratoires Ipsen Pharma, Keocyt, Pfizer Oncologie et Novartis
LAURÉATS 2012

Corinne Bousquet : 20 000 euros
Vers un traitement plus adapté des insulinomes par les analogues de somatostatine et les inhibiteurs de mTOR.

Jérôme Cros : 20 000 euros
Identification de nouvelles cibles diagnostiques et thérapeutiques dans les tumeurs neuroendocrines digestives et pulmonaires de grade intermédiaire.

Traitements locorégionaux des métastases hépatiques des tumeurs endocrines digestives. Indications et modalités pratiques
Régis Cohen (Bobigny)
On utilise de plus en plus des traitements locorégionaux pour traiter les métastases hépatiques. Ces nouvelles modalités sont efficaces (quasiment 100 % d’efficacité pour de petites lésions bien localisées), mais elles présentent des contre-indications, des complications, des coûts et des circonstances d’efficacité qu’il faut connaître.
Trois de ces méthodes ont été présentées lors du dernier congrès national des tumeurs neuroendocrines : la radiofréquence et la chimioembolisation (T. De Baere, Villejuif), et la radioembolisation (J.P. Pelage, Caen).
La radiofréquence peut être indiquée pour des tumeurs hépatiques, mais aussi pulmonaires ou osseuses. Elle est efficace pour des tumeurs de petite taille (moins de 2 cm). Elle est contre-indiquée en cas d’anastomose biliodigestive en raison des risques infectieux. Les difficultés de la localisation de la tumeur peuvent survenir au moment du traitement. Le scanner, avec parfois l'injection de lipiodol, et l’échographie de contraste sont alors utiles.
La chimioembolisation est indiquée plutôt dans les tumeurs de gros volume, chez des patients symptomatiques ou en progression. Elle utilise différents protocoles et des médicaments cytotoxiques. Elle présente un taux de succès important quand l’envahissement tumoral est inférieur à 30 % de l’ensemble du foie.
La radioembolisation, coûteuse (10 000 euros par traitement), consiste en l'injection de microsphères d’yttrium 90 (venant du Canada ou d’Australie). L’irradiation locale atteint 1 cm autour de la microsphère. Cette méthode est utilisée actuellement dans 15 centres en France. Elle est indiquée dans les carcinoïdes progressifs, en cas de maladie hépatique dominante ou avancée, etc. Elle est contre-indiquée en présence d’ascite, d’insuffisance hépatique, d’irradiation pulmonaire ou d’adhérence digestive. Elle nécessite un repérage préalable minutieux de la vascularisation de la tumeur pour éviter une diffusion inadéquate des microsphères, notamment dans la circulation gastrique.
En cas d’atteinte hépatique, on pourrait proposer ces différentes méthodes en fonction de l’histoire naturelle des métastases hépatiques (figure).
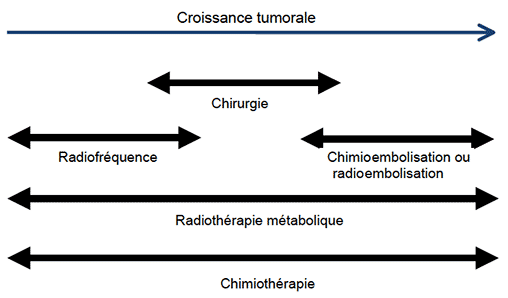
Figure. Chronologie de l’utilisation des différents traitements locaux pour les métastases.
Données récentes sur la génétique et l’épigénétique des tumeurs neuroendocrines pancréatiques
Jean-Yves Scoazec (Lyon)
La conférence prononcée par Aldo Scarpa (Centre for Applied Research on Cancer, Vérone, Italie), lors du Congrès national des tumeurs neuroendocrines, a été l’occasion d’une mise au point sur les avancées concernant les anomalies génétiques et épigénétiques observées dans les tumeurs neuroendocrines pancréatiques. Aldo Scarpa est l’un des principaux acteurs européens impliqués dans ces recherches.
L’une des particularités des tumeurs neuroendocrines pancréatiques est leur association avec plusieurs syndromes de prédisposition génétique : néoplasie endocrinienne multiple de type 1 (NEM1), maladie de von Hippel-Lindau (VHL), sclérose tubéreuse de Bourneville (Tuberous Sclerosis Complex [TSC]), pour ne citer que les principaux exemples. Chacun de ces syndromes est associé à la perturbation d’une voie différente : la régulation des interactions chromatiniennes pour NEM1, celle de la réponse à l’hypoxie pour VHL et la voie mTOR pour TSC. Plusieurs études récentes ont confirmé que les mêmes voies étaient perturbées dans les tumeurs neuroendocrines sporadiques du pancréas. L’un des travaux les plus importants à cet égard, et qui montre bien la puissance des technologies actuelles de “gene discovery”, est celui publié par Y. Jiao et al. en 2011 (1). Grâce à une technique de séquençage exomique, ces auteurs ont identifié des mutations de MEN1dans environ 40 % des tumeurs neuroendocrines sporadiques du pancréas et des mutations de gènes codant pour des protéines impliquées dans la voie mTOR dans environ 15 % des cas. De plus, cette étude a révélé le rôle de 2 gènes jusque-là insoupçonnés, DAXX et ATRX, codant pour 2 protéines formant un couple fonctionnel impliqué dans la régulation des interactions chromatiniennes et des télomères : c’est donc à nouveau la voie de régulation des interactions chromatiniennes qui est altérée. Les mutations de ces 2 gènes sont mutuellement exclusives et interviennent chacune dans environ 20 % des cas. La validation de ce travail pionnier est en cours.
Aldo Scarpa a montré des résultats personnels confirmant l’implication des nouveaux acteurs DAXX et ATRX. Il a rappelé les résultats antérieurs de ses collaborateurs, soulignant l’importance des anomalies de la voie mTOR. Ainsi, dans un travail publié en 2010 (2), une approche immunohistochimique leur avait permis de montrer la fréquence des pertes d’expression de 2 protéines clés de la voie mTOR (PTEN et TSC2) qui entraînent une activation constitutive du complexe mTOR dans près de 85 % des tumeurs neuroendocrines sporadiques du pancréas. En utilisant la même approche, Aldo Scarpa et al. ont également confirmé la perte fréquente d’expression de la protéine ménine codée par MEN1 dans les tumeurs neuroendocrines pancréatiques sporadiques (3). Le paysage des anomalies génétiques associées aux tumeurs neuroendocrines sporadiques du pancréas est donc aujourd’hui relativement bien défini et suggère l’implication prioritaire de 2 mécanismes : la perturbation de la régulation de la chromatine et celle de la voie mTOR.
L’un des mérites d’Aldo Scarpa est d’avoir montré que tout ne se résumait pas aux anomalies génétiques proprement dites et que d’autres pistes, notamment épigénétiques, devaient être explorées. Dans un travail publié dès 2006 (4), Aldo Scarpa et al. avaient montré que des anomalies d’expression de plusieurs miRNA, ARN non codants jouant un rôle important dans la régulation de l’expression génique, pouvaient être identifiées dans les tumeurs neuroendocrines pancréatiques sporadiques et que certaines d’entre elles pourraient avoir un intérêt pronostique ou physiopathologique. Il s’agit désormais de comprendre les interactions éventuelles entre anomalies génétiques et épigénétiques au cours de la tumorigenèse endocrine pancréatique.
De nouvelles avancées sont à attendre, avec le développement spectaculaire des technologies de séquençage à haut ou à très haut débit et leur utilisation par des consortiums internationaux mettant des ressources en commun. Aldo Scarpa a ainsi présenté des résultats préliminaires fondés sur le séquençage de la totalité du génome de 22 cas de tumeurs neuroendocrines pancréatiques. Ce séquençage a été réalisé dans le cadre de l’International Cancer Genome Consortium (ICGC) au sein duquel il est chargé de l’analyse des tumeurs pancréatiques rares, dont les tumeurs neuroendocrines. La découverte de nouvelles anomalies moléculaires aura sans doute des conséquences importantes sur la compréhension des mécanismes de la tumorigenèse endocrine pancréatique, mais aussi sur la prise en charge des patients et le choix des thérapeutiques.
Références bibliographiques
1. Jiao Y, Shi C, Edil BH et al. DAXX/ATRX, MEN1, and mTOR pathway genes are frequently altered in pancreatic neuroendocrine tumors. Science 2011;331:1199-203.
2. Missiaglia E, Dalai I, Barbi S et al. Pancreatic endocrine tumors: expression profiling evidences a role for AKT-mTOR pathway. J Clin Oncol 2010;28:245-55.
3. Corbo V, Dalai I, Scardoni M et al. MEN1 in pancreatic endocrine tumors: analysis of gene and protein status in 169 sporadic neoplasms reveals alterations in the vast majority of cases. Endocr Relat Cancer 2010;17:771-83.
4. Roldo C, Missiaglia E, Hagan JP et al. MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior. J Clin Oncol 2006;24:4677-84.

Chimioembolisation d’une métastase hépatique neuroendocrine
Thierry de Baere (Villejuif)
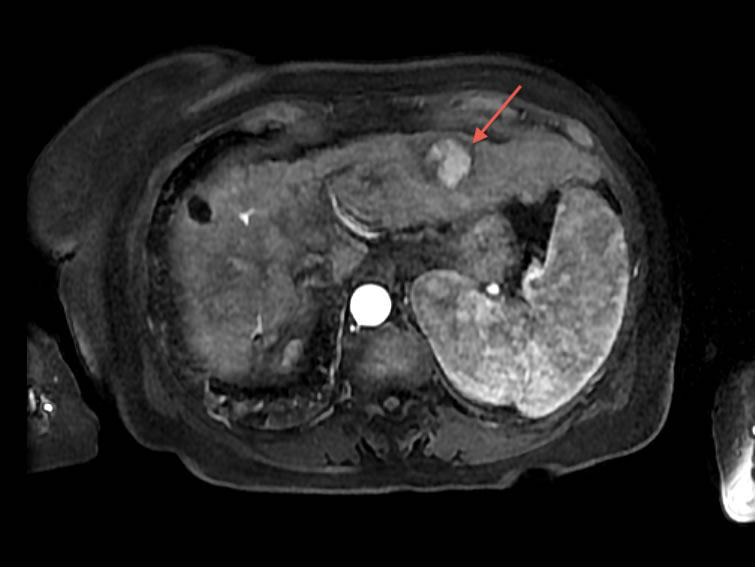
Figure 1. IRM hépatique séquence T1 injectée à la phase artérielle montrant une métastase hypervasculaire fortement rehaussée dans le lobe gauche du foie (flèche rouge). Il faut noter une métastase du foie droit déjà traitée par chimioembolisation et non rehaussée.
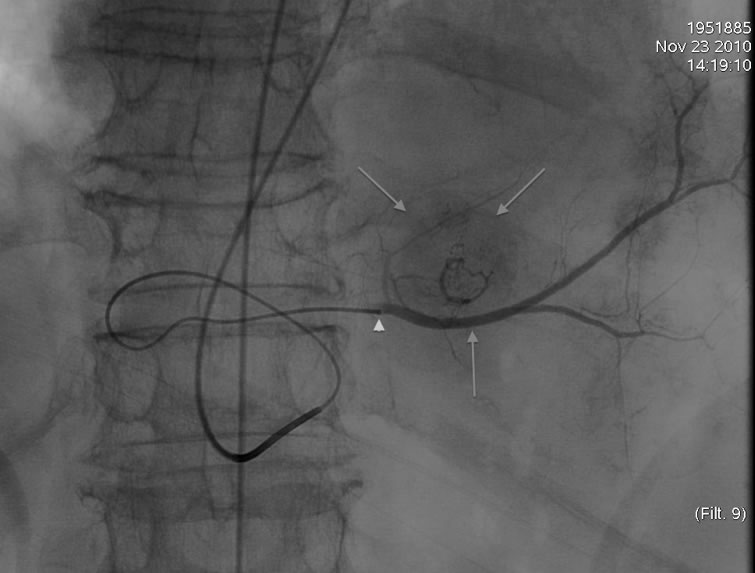
Figure 2. Artériographie hypersélective du lobe gauche avant chimiembolisation avec billes chargées de doxorubicine avec microcathéther (tête de flèche) et opacification de la métastase hypervasculaire du lobe gauche (flèches).
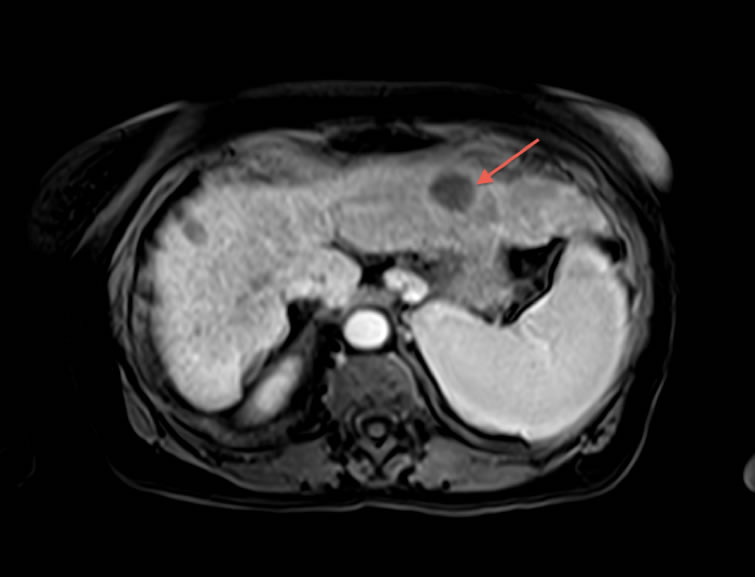
Figure 3. IRM obtenue 2 mois après la chimioembolisation montrant une dévascularisation complète de la métastase et une stabilité en taille. Le malade est donc en réponse complète mais en stabilité RECIST. Il faudra attendre plusieurs mois avant de voir la métastase diminuer de taille et donc avoir une réponse selon les critères RECIST.

Épigénétique et télomères, vers la compréhension d’un mécanisme
(d'après la conférence du Pr Aldo Scarpa : “Génétique et épigénétique des tumeurs endocrines digestives”)
Frédérique Savagner (Angers)
Le mécanisme de tumorigenèse des tumeurs neuroendocrines digestives est repris à la lueur des nouvelles technologies de séquençage qui permettent d’être exhaustif sur l’exome (5 % du génome) ou sur le génome entier des tumeurs. Les protéines ATRX ou DAXX ont ainsi été identifiées comme étant des facteurs de tumorigenèse du pancréas endocrine, en complément des acteurs plus habituellement impliqués que sont NEM1 et ceux de la voie PI3kinase/Akt/mTOR. Les gènes ATRX et DAXX présentent ainsi des mutations inactivatrices pour 43 % des tumeurs neuroendocrines pancréatiques sporadiques (1). Ces mutations, mutuellement exclusives, entraînent la disparition du marquage nucléaire des protéines, ce qui est alors un facteur de bon pronostic même en présence de métastases hépatiques. Outre le champ pronostique ouvert par l’étude du marquage histologique de ces protéines, leur implication dans le remodelage de la chromatine doit être exploré sous l’angle de la réponse des cellules aux dommages de l’ADN (DNA Damage Response [DDR]).
La disparition du signal protéique des gènes ATRX et DAXX – considérés comme des gènes suppresseurs de tumeurs – est corrélée au phénotype ALT (Alternative Lenthening of Telomeres) correspondant au mécanisme de maintenance de la longueur des télomères qui est indépendant de l’activité télomèrase. Ce mécanisme est actif dans 5 à 10 % des cancers et implique l’extension des télomères par recombinaison homologue. Les télomères sont des séquences répétées à l’extrémité des chromosomes qui les protègent des fusions ou de l'instabilité. Le dysfonctionnement des télomères conduit normalement au dommage chronique de l’ADN et à l’arrêt du cycle cellulaire. DAXX est une protéine chaperonne spécifique de l’histone H3.3, variant de l’histone H3 exprimé tout au long du cycle cellulaire. Il peut être incorporé dans la chromatine, notamment au niveau des télomères, nécessitant alors la coopération de la protéine ATRX pour son recrutement (2). La perte de la fonction d’ATRX conduit plus particulièrement à des niveaux anormaux de méthylation de l’ADN, au niveau des zones répétées que sont les télomères. De façon très intéressante, le syndrome NEM1 de prédisposition aux tumeurs neuroendocrines pancréatiques par mutation germinale dans le gène de la ménine constitue un modèle d’étude de la cinétique d’inactivation de ATRX et DAXX. Il est ainsi rapporté que 6 % des tumeurs neuroendocrines pancréatiques chez des patients porteurs d’une mutation dans le gène NEM1 présentent une perte nucléaire du marquage ATRX /DAXX, associée au phénotype ALT observé dans les tumeurs (3). Cette perte de marquage ne survient que dans les tumeurs de plus de 3 cm et peut donc être considérée comme un événement tardif dans la tumorigenèse neuroendocrine pancréatique. Le faible pourcentage de tumeurs présentant cette absence de marquage par rapport aux tumeurs pancréatiques sporadiques (6 % versus 43 %) semble être lié à la taille des tumeurs explorées dans les 2 études (1,9 cm versus 4,9 cm). De même, la recherche des anomalies moléculaires des gènes ATRX et DAXX dans de nombreuses tumeurs du système nerveux central (notamment les glioblastomes) montre qu’il existe une forte corrélation entre l’inactivation de ces protéines et le phénotype ALT (4). Le modèle pour lequel la perte de fonction du complexe ATRX-DAXX a un impact sur la stabilisation des télomères par réduction de l’incorporation de l’histone H3.3 est donc un mécanisme de tumorigenèse plus général (5, 6). C’est un mécanisme à part entière qui peut être associé aux anomalies du gène NEM1 mais qui reste distinct dans le processus de tumorigenèse DDR-dépendant. Il semble cependant que d’autres mécanismes épigénétiques soient nécessaires pour maintenir ce phénotype ALT (7).
Ainsi, la forte corrélation entre la perte du marquage nucléaire ATRX/DAXX et l’activité ALT fait de ces protéines de bons marqueurs diagnostiques des tumeurs pour lesquelles l’activation de la voie ALT est associée à des réarrangements géniques des micronucléations faisant partie du mécanisme DDR. L’identification de cette activité ALT peut avoir un impact sur la prise en charge thérapeutique antitélomère/télomérase des tumeurs, notamment pour les tumeurs neuroendocrines digestives.
Références bibliographiques
1. Jiao Y, Shi C, Edil BH et al. DAXX/ATRX, MEN1, and mTOR pathway genes are frequently altered in pancreatic neuroendocrine tumors. Science 2011;331:1199-203.
2. Lewis PW, Elsaesser SJ, Noh KM, Stadler SC, Allis CD. Daxx is an H3.3-specific histone chaperone and cooperates with ATRX in replication-independent chromatin assembly at telomeres. Proc Natl Acad Sci USA 2010;107:14075-80.
3. De Wilde RF, Heaphy CM, Maitra A et al. Loss of ATRX or DAXX expression and concomitant acquisition of the alternative lengthening of telomeres phenotype are late events in a small subset of MEN-1 syndrome pancreatic neuroendocrine tumors. Mod Pathol 2012;25:1033-9.
4. Heaphy CM, de Wilde RF, Jiao Y et al. Altered telomeres in tumors with ATRX and DAXX mutations. Science 2011;333:425.
5. Goldberg AD, Banaszynski LA, Noh KM et al. Distinct factors control histone variant H3.3 localization at specific genomic regions. Cell 2010;140:678-91.
6. Law JA, Jacobsen SE. Establishing, maintaining and modifying DNA methylation patterns in plants and animals. Nat Rev Genet 2010;11:204-20.
7. Lovejoy CA, Li W, Reisenweber S et al. Loss of ATRX, genome instability, and an altered DNA damage response are hallmarks of the alternative lengthening of telomeres pathway. PLoS Genet 2012;8:e1002772.
Pièges diagnostiques - Fausses métastases en imagerie conventionnelle
Abdallah Al Salameh (Bobigny)
La caractérisation des métastases hépatiques d’une tumeur neuroendocrine (TNE) est primordiale pour la prise en charge et cette caractérisation dépend essentiellement du caractère hypervasculaire des tumeurs neuroendocrines.
Typiquement, les métastases d’une TNE pancréatique apparaissent sur le scanner comme une image hypodense avant l’injection, hypervasculaire dans le temps artériel, puis à nouveau hypodense dans le temps portal ou tardif (du fait de leur lavage rapide) ; celles d’une TNE intestinale (carcinoïde) apparaissent, elles, comme une image plutôt isodense avant l’injection, hypervasculaire dans le temps artériel, puis à nouveau hypodense dans le temps portal ou tardif. Sur l’IRM, les métastases sont généralement hypo-intenses en T1 et hyperintenses en T2. En plus du caractère hypervasculaire, le recours au mode diffusion améliore la détection des métastases (environ 80 % des cas). En diffusion, les métastases d’une TNE sont hyperintenses du fait de leur forte cellularité.
Mais tout ce qui est hypervasculaire n’est pas une métastase de TNE et certains diagnostics différentiels doivent être évoqués :
• le carcinome hépatocellulaire : la différenciation se fait par la clinique (état général, antécédents, etc.), les examens biologiques et la morphologie du foie en imagerie, notamment à l’échographie ;
• l’angiome : à l’inverse des métastases des TNE, l’angiome n’apparaît pas hypovasculaire dans la phase tardive du fait de son remplissage. À l’IRM, on peut trouver une couronne périphérique en cas d’angiome ;
• l’hyperplasie nodulaire focale (HNF) : c’est un diagnostic rare qu'il faut connaître. L’HNF apparaît comme une image isodense en T1, discrètement hyperintense en T2 ; elle prend le contraste mais l’absence de lavage fait la différence avec les métastases. L’échodoppler peut aider, car on retrouve une artère centrale dans le cas de l’HNF ;
• les lésions kystiques : même si elles ne sont pas hypervasculaires, elles peuvent mimer les métastases des TNE. En cas de doute, la différenciation se fait facilement par l’échographie (caractère anéchogène = kyste).
Ainsi, l’acquisition d’une imagerie complète (scanner avec clichés en 4 phases et/ou IRM avec diffusion) et l’étude soigneuse des images par un radiologue expérimenté dans les TNE sont indispensables pour confirmer ou infirmer l’existence des métastases hépatiques.

Comment gérer une tumeur neuroendocrine de primitif inconnu ?
Abdallah Al Salameh (Bobigny), Régis Cohen (Bobigny)
Si on excepte les secrétions hormonales révélatrices (insulinome, tumeurs carcinoïdes), une maladie métastatique neuroendocrine sans primitif connu représente une circonstance diagnostique rare (moins de 1 %). Généralement, une immunohistochimie positive pour la chromogranine A, la synaptophysine et le CD 56 signent la nature neuroendocrine de la tumeur.
Dans cette circonstance, si le scanner thoraco-abdomino-pelvien et la scintigraphie à l’octréotide marqué sont négatifs, il faudra un dialogue multidisciplinaire afin de répondre à plusieurs questions.
• S’agit-il vraiment d’une tumeur neuroendocrine (TNE) bien différenciée ? L’indice de mitose et le pourcentage de fixation du Ki-67 élimineront une tumeur de haut grade orientant d’emblée vers une chimiothérapie. C’est surtout pour les tumeurs de bas grade 1 ou 2 que l’origine nécessite d’être précisée.
• S’agit-il d’une tumeur d’origine neuroectodermique ou endodermique ? Des indices morphologiques peuvent être utiles (stroma amyloïde dans le cancer médullaire de la thyroïde [CMT], architecture en nid dans les lymphadénopathies généralisées persistantes et les phéocromocytomes [PHEO]). De plus, l’anatomopathologiste peut encore aider par l’utilisation d’autres marqueurs immuno-histochimiques : cytokératine, CK7, TTF1, calcitonine, sérotonine, CDX2 PDX1 en fonction de l’aspect anatomopathologique. TTF1 oriente vers un CMT ou une origine bronchique. La cytokératine positive élimine un PHEO.
• En ajoutant les examens biologiques et l’imagerie, le clinicien arrive à caractériser une grande partie de ces TNE : dosage de la calcitonine pour le CMT, scanner positif dans les TNE thymiques, etc.
• Au terme de cette première enquête, il conviendra de déterminer si la tumeur est pancréatique ou digestive. L’imagerie interventionnelle peut alors s’avérer nécessaire (ou très utile).
Ainsi, cet aller-retour entre le clinicien, le biologiste et l’anatomopathologiste permet d’orienter le diagnostic du primitif qui peut être invisible à l’imagerie, mais qui induit des choix thérapeutiques très différents.
Attention : les données présentées ici, issues de la recherche, sont susceptibles de ne pas être validées par les autorités de santé françaises. Ces informations sont sous la seule responsabilité des auteurs qui sont garants de l'objectivité de cette publication.
