
Accédez au site  |

Après les fêtes et avant la galette... à consommer sans modération
Madame, Monsieur, cher(e)s collègues, chèr(e)s ami(e)s,
C’est avec un grand plaisir que nous vous faisons parvenir cette nouvelle newsletter Hypophyse inaugurant l’année. Pas de thème spécifique cette fois, mais une sélection d’articles sur des thèmes aussi variés que l’hypercorticisme (épidémiologie et morbimortalité), l’acromégalie (l’étude princeps de l’octréotide implantée), et pour les plus curieux, la description détaillée phénotypique du syndrome de déficit en IGSF1, rapporté pour la première fois à la fin de 2012. Le Pr Gatta-Cherifi nous fait également le plaisir d’assurer la mise au point de cette newsletter sur le rôle potentiel des analogues du GLP-1 dans la prise en charge de l’obésité des patients suivis pour craniopharyngiome (avant le lancement prochain de son PHRC). Enfin, une newsletter Hypophyse sans l’image IRM commentée du Pr Bonneville serait un peu comme une galette sans sa fève : nous ne dérogeons pas à la règle établie il y a déjà plusieurs années.
Bonne lecture et bonne année 2014.
Frédéric Castinetti
Endocrinologie, hôpital de la Timone, Marseille

Octréotide hydrogel sous-cutanée implantée: des résultats prometteurs
Frédéric Castinetti (Marseille)
Il s’agit de la première étude de phase III, ouverte, en intention de traiter, portant sur 163 patients acromégales répondeurs à l’octréotide (IGF1 normalisée et Gh < 2,5 ng/ml), comparant l’efficacité de l’octréotide hydrogel implantée (84 mg) à l’octréotide LAR.
Le protocole imposait une préphase avec injection à dose fixe d’octréotide (10 à 40 mg tous les 28 jours) pendant au moins 3 mois, dont au moins 2 avec contrôle de l’hypersécrétion. Puis randomisation 3 : 1 octréotide implantée (6 mois) versus poursuite des injections d’octréotide à la même dose efficace.
Critère principal : efficacité et tolérance pendant 24 semaines de l’octréotide implantée. Consultation de suivi toutes les 4 semaines. Contrôle de l’hypersécrétion défini par l’association d’une IGF1 normalisée et d’un taux de GH < 2,5 ng/ml.
Résultats : à 24 semaines, on constate 86 % de contrôle des taux de GH et IGF1 sous implant et 84 % sous octréotide LAR. Avec l’implant, on note une augmentation des taux d’octréotidémie jusqu’à J 8, puis un pic entre J 14 et J 28, et niveaux relativement stables (avec une diminution modérée) au cours des 5 mois suivants. La tolérance était globalement bonne, avec, semble-t-il, plus de diarrhées et de céphalées avec l’implant (environ 10 % versus 5 à 7 % des cas dans le groupe octréotide LAR). Des effets secondaires locaux (prurit, douleur) ont été rapportés par 13,5 % des patients traités par l’implant. Quatre sujets n’ont pas pu bénéficier d’une exérèse complète de l’implant à la fin de l’étude (!). Comme attendu, 82,5 % des sujets ayant bénéficié de l’implant souhaitaient conserver ce traitement à l’arrêt de l’étude.
Au total, des résultats intéressants, quoiqu’incomplets, et un clair conflit d’intérêts pour les 4 auteurs de cette étude, dont 2 sont employés par Endo Health Solutions, qui fabrique l’octréotide implantée. Il est dommage que les auteurs n’aient pas précisé si les effets secondaires se maintenaient pendant les 6 mois avec l’implant ou s'ils n’étaient que transitoires. À confirmer par de nouvelles études multicentriques, donc…
Référence bibliographique
Chieffo C, Cook D, Xiang Q, Frohman LA. Efficacy and safety of an octreotide implant in the treatment of patients with acromegaly. J Clin Endocrinol Metab. 2013 Oct;98(10):4047-54.
Le syndrome de déficit en IGSF1: caractéristiques phénotypiques
Frédéric Castinetti (Marseille)
Le syndrome de déficit en IGSF1 a été récemment décrit (Sun, Nature Genetics, décembre 2012) : il est dû à des mutations pertes de fonction ou des délétions du gène IGSF1 (Immunoglobulin Superfamily Member 1). La transmission est liée à l’X. Ce syndrome se manifeste principalement par une hypothyroïdie centrale et une macro-orchidie. IGSF1 est une glycoprotéine membranaire, fortement exprimée au sein de la poche de Rathke et de l’hypophyse adulte. Sur le plan cellulaire, les mutations de IGSF1 pourraient affecter le trafficking vers la membrane.
Des données portant sur 24 patients (hémizygotes) porteurs de mutations d’IGSF1, issus de 10 familles différentes ainsi que de 18 femmes hétérozygotes, ont été rapportées dans cette étude.
Les patients hémizygotes présentaient tous une hypothyroïdie centrale et une macro-orchidie. L’hypothyroïdie centrale était profonde et dépistée en néonatal. Dans 67 % des cas, une hypoprolactinémie était associée, ainsi qu’un déficit en GH transitoire dans l’enfance dans 13 % des cas. Ils présentaient tous un retard pubertaire avec un retard de production de testostérone (discordant avec l’augmentation de volume testiculaire). Malgré les traitements substitutifs, la majorité des patients présentaient à l’âge adulte un surpoids (63 %), voire un syndrome métabolique (après l’âge de 55 ans).
Les femmes porteuses hétérozygotes présentaient un déficit thyréotrope dans 33 % des cas, et une hypoprolactinémie dans 11 % des cas.
L’explication physiopathologique des caractéristiques phénotypiques de ce syndrome reste obscure. Les auteurs évoquent une association entre l’hypothyroïdie et l’augmentation de volume testiculaire en se basant sur une étude ayant démontré que le nombre de cellules de Sertoli augmentait en présence de niveaux bas de T3, mais cette hypothèse semble très discutable.
Compte tenu de la faible incidence des déficits thyréotropes néonataux, le dépistage génétique des mutations de IGSF1 devrait être proposé systématiquement devant tout patient porteur d’un déficit thyréotrope et/ou d’une macro-orchidie.
Référence bibliographique
Joustra SD, Schoenmakers N, Persani L, et al. The IGSF1 Deficiency Syndrome: Characteristics Of Male And Female Patients. J Clin Endocrinol Metab. 2013 Oct 9. [Epub ahead of print]
Morbimortalité et hypercorticisme : 2 études, 2 approches, 1 seul résultat concordant…
Frédéric Castinetti (Marseille)
Deux études portant sur les complications de l’hypercorticisme, mais avec 2 approches radicalement différentes ont été rapportées dans le Journal of Clinical Endocrinology and Metabolism en 2013.
La première est une étude de cohorte de patients porteurs d’hypercorticisme par comparaison avec une population générale. Dekkers et al. comparent ainsi 343 cas d’hypercorticisme, de toute étiologie à l’exception des causes malignes (corticosurrénalome malin, syndrome de Cushing ectopique) diagnostiqués entre 1980 et 2010, à 34 300 contrôles, indemnes de pathologie, appariés pour l’âge et le sexe (1 patient pour 100 contrôles). Pour prendre en compte une pré-exposition aux corticoïdes avant le diagnostic, les auteurs ont également recherché les antécédents des patients Cushing dans les 3 ans précédant le diagnostic. Point important, tous les patients porteurs d’un hypercorticisme devaient avoir été opérés (permettant théoriquement, comme le mentionnent les auteurs, d’exclure les diagnostics douteux).
Les résultats suivants ont été observés.
À l’inclusion, les patients avec hypercorticisme présentaient plus de diabète (13,1 versus 1,4 %), d’HTA (25,4 versus 2,6 %) et d’antécédents de cancer (7,6 versus 2,8 %).
Dans le cadre du suivi jusqu’à 30 ans après le diagnostic :
- mortalité : risque relatif (RR) de 3,5 la première année après le diagnostic, puis de 2,1 ;
- événement thrombo-embolique : RR de 2,6 (et un risque 60 fois plus élevé dans les 3 mois, et 20 fois plus élevé la première année après la chirurgie) ;
- infarctus du myocarde : RR 3,7 ;
- accident vasculaire cérébral : RR 2,0.
Tous ces risques étaient déjà augmentés les 3 années précédant le diagnostic d’hypercorticisme.
- insuffisance cardiaque : RR 1,1 ;
- ulcère gastrique : RR 0,6 ;
- infections : RR 5,5 ;
- fractures : RR 1,7.
Point important, les risques au long cours étaient également augmentés quand les patients étaient traités chirurgicalement et considérés comme en rémission (avec par exemple un déficit corticotrope en postopératoire immédiat). Il n’existait pas de différence significative en fonction de l’étiologie.
Les limites de cette étude sont évidentes et très bien exposées par les auteurs : l’association initiale plus marquée avec diabète et HTA, l’absence de critères permettant de déterminer si les patients étaient guéris ou non ou dernier bilan de suivi, l’absence de données sur le niveau adéquat de substitution des patients opérés présentant d’autres déficits hypophysaires… Ces limites sont bien évidemment contrebalancées par le formidable outil démographique dont disposent les auteurs, avec un recueil de l’ensemble des événements survenus de façon exhaustive pour tous les patients. Même en se mettant dans la situation la plus défavorable (l’intégralité des patients en hypercorticisme n’étaient pas guéris), cette étude confirme la surmorbidité et mortalité induite par l’hypercorticisme. Si l’on considère de façon plausible qu’environ la moitié de ces patients étaient guéris, les chiffres présents sont inquiétants et doivent nous imposer une surveillance accrue et une meilleure prise en charge des complications de l’hypercorticisme (y compris chez les patients considérés comme guéris).
La seconde étude publiée, par Lambert et al., ne porte que sur les patients porteurs de maladie de Cushing et s’intéresse rétrospectivement aux facteurs prédictifs de morbi-mortalité, à partir d’une cohorte de 346 patients opérés par un seul chirurgien (Mount Sinai, New York, Etats-Unis). Le suivi moyen était de 6,3 ans et la durée moyenne théorique d’exposition à un hypercorticisme (définie des premiers signes théoriques à la rémission…) de 40 mois. Au diagnostic, 72 % des patients étaient hypertendus, 27 % diabétiques et 22 % dépressifs. Au dernier suivi, 89,4 % des patients étaient en rémission, incluant 13,6 % traités par radiothérapie ou surrénalectomie bilatérales complémentaires. 21,1 % des patients ont présenté une récidive, en moyenne 5,8 ans après la chirurgie.
Une mortalité a été rapportée chez 9 % des patients, en moyenne 11 ans après la chirurgie, le plus souvent du fait d’une étiologie cardiovasculaire (44 % des cas). Le risque était d’autant plus marqué que le temps d’exposition à l’hypercorticisme, l’âge au diagnostic et le taux initial d’ACTH étaient plus élevés.
Sur l’ensemble de la cohorte, 30 événements cardiovasculaires ont été observés. Les facteurs de risque étaient le sexe masculin, l’âge au diagnostic, mais les facteurs confondants tels que le tabagisme ou les antécédents familiaux de pathologie cardiovasculaire n’étaient pas évalués.
Ces 2 études n’apportent pas énormément de nouveautés par rapport à ce qui est généralement admis par la communauté endocrinologique : l’hypercorticisme est responsable d’une surmorbidité et d’une surmortalité. Leur principal avantage est de pouvoir passer de vérités assénées à des données brutes, sur de vraies populations. Le message principal à retenir est probablement que les patients vus en consultation pour un diagnostic d’hypercorticisme sont déjà à risque élevé de complications (du fait d’une exposition prédiagnostique), que ce risque est accru dans les suites immédiates postchirurgicales, et qu’il persiste vraisemblablement, bien qu’à un niveau moins important, après la rémission. La nécessité d’un suivi très prolongé de ces patients, et d’une prise en charge agressive des facteurs de risque cardiovasculaire peu de temps après la chirurgie, est donc avérée.
Références bibliographiques
Dekkers OM, Horváth-Puhó E, Jørgensen JO, et al. Multisystem morbidity and mortality in Cushing's syndrome: a cohort study. J Clin Endocrinol Metab. 2013 Jun;98(6):2277-84.
Lambert JK, Goldberg L, Fayngold S, Kostadinov J, Post KD, Geer EB. Predictors of mortality and long-term outcomes in treated Cushing's disease: a study of 346 patients. J Clin Endocrinol Metab. 2013 Mar;98(3):1022-30.

Obésité hypothalamique liée au craniopharyngiome : place des analogues du GLP1
Blandine Gatta Cherifi (Bordeaux)
L‘obésité hypothalamique est fréquente après le traitement par chirurgie ou radiothérapie des craniopharyngiomes. Elle peut toucher jusqu’à 60 % des patients. Certains facteurs de risque ont été identifiés : le jeune âge au diagnostic, l’indice de masse corporelle (IMC) maternel élevé, l’IMC élevé au diagnostic, la présence d’une endocrinopathie associée (1). Plus récemment ont été aussi retrouvés comme facteurs de risque le degré d’atteinte visible à l’IRM, la prise en charge dans des centres non experts et la réalisation d’une chirurgie extensive (2, 3).
Physiopathologie des obésités hypothalamiques
La physiopathologie de ces obésités est complexe. Une insensibilité "organique" à la leptine, dans ce contexte de lésions des noyaux hypothalamiques impliqués dans la régulation de la prise alimentaire, peut participer à la physiopathologie de l’obésité. Certains auteurs ont ainsi mis en évidence, chez des patients ayant une obésité hypothalamique, des concentrations de leptine plasmatique plus élevées que celles de sujets ayant une obésité commune, à niveaux d’IMC équivalents (4). L’hyperinsulinisme participe aussi au développement de cette obésité (5). En effet, la cellule bêta pancréatique possède une double innervation sympathique et parasympathique provenant de l’hypothalamus. Les lésions de l’hypothalamus ventromédian entraînent un déséquilibre de la balance du système nerveux autonome avec une activation du tonus vagal responsable d’une augmentation de la libération de l’acétylcholine au niveau des récepteurs muscariniques de la cellule bêta. Cette libération d’acétylcholine va, par différents mécanismes, potentialiser la sécrétion d’insuline induite par le glucose.
La diminution de la dépense énergétique participe aussi au développement de cette obésité. Elle est elle aussi d’origine multiple : atteinte du système nerveux sympathique, interruption de la voie de signalisation de la leptine ou encore troubles du sommeil qui accompagnent les obésités. De plus, le métabolisme de base est aussi modifé. Shaikh G et al. ont ainsi montré que le métabolisme de base, après ajustement sur la masse maigre mesurée par absorptiométrie biphotonique, est diminué chez les enfants ayant une obésité hypothalamique par rapport à des enfants ayant une obésité commune ou un hypopituitarisme congénital (6).
Prise en charge de l’obésité hypothalamique
Cette physiopathologie complexe accentue la difficulté de la prise en charge de cette obésité.
Compte tenu de l’hyperinsulinisme dont nous avons précédemment parlé, le bénéfice d’un traitement par octréotide a été étudié dans ce contexte. Il s’agissait d’une étude en double aveugle contre placebo, en parallèle, portant sur 20 enfants. Après 6 mois de traitement, l’octréotide permet de diminuer significativement le poids et l’IMC par rapport au placebo (7). Cependant, une étude multicentrique internationale réalisée sur une population adulte ne permettra pas de confirmer cet effet sur le poids, et la phase d’extension de l’étude sera associée à une augmentation significative des lithiases biliaires.
La sibutramine, inhibiteur sélectif de la recapture de la sérotonine et de la noradrénaline, aujourd’hui retirée du marché, a aussi fait l’objet d’une étude randomisée en cross over dans l’obésité hypothalamique (8).
En dehors de ces 3 études randomisées, les études publiées sont des “case reports” dont les effectifs ne dépassent pas le nombre de 5, concernent des approches thérapeutiques peu conventionnelles comme l’association diazoxide/metformine et sont plutôt à considérer comme anecdotiques (9-13).
Plus récemment, la question de la chirurgie bariatrique a pu être posée. Dans notre centre, 4 patients ont ainsi pu bénéficier d’une chirurgie bariatrique pour une obésité hypothalamique (sleeve n = 2 , court-circuit gastrique = 2). Si 3 des patients ont pu perdre du poids, la 4e patiente a vu son IMC augmenter de 37,7 à 50 kg/m2 lors de la dernière évaluation, 36 mois après la réalisation du court-circuit gastrique (14). Une méta-analyse publiée en 2013 dans le JCEM présente les résultats obtenus après chirurgie bariatrique pour une obésité hypothalamique liée au craniopharyngiome. Pour 19 patients, le suivi est disponible à 6 mois et la perte de poids de 20,86 kg [-35,42 ; -6,30] (moyenne, intervalle de confiance à 95 %). Pour 17 patients, le suivi à 12 mois est disponible avec une perte de poids moyenne de 15,11 kg [-31,68 ; +1,39] (15). Néanmoins, la HAS précise bien que, dans les obésités hypothalamiques, "l’indication doit être exceptionnelle et discutée au cas pas cas par l’équipe pluridisciplinaire de chirurgie de l’obésité et les praticiens habituellement en charge de ces pathologies".
Place des analogues du Glucagon-Like peptide (GLP1)
Flint et al. ont été les premiers à mettre en évidence, dans un travail publié dans le Journal of clinical investigation, qu’une infusion de GLP1 à des sujets normopondéraux entraînait, par rapport à la perfusion de sérum salé, une augmentation de la satiété, de la plénitude gastrique, une diminution de la faim ainsi qu’une diminution de l’apport calorique lors d’un buffet présenté en quantité excédentaire après l’infusion (16). Des résultats comparables ont par la suite été mis en évidence avec les analogues du GLP1 (17). Enfin, il a aussi été mis en évidence, chez le sujet obèse non diabétique, que les analogues du GLP1 permettent d’obtenir une perte de poids significative par rapport au traitement par placebo (18,19).
En dehors des effets hypothalamiques du GLP1 (20), son action sur la prise alimentaire des analogues du GLP1 peut être expliqué par des effets sur le cortex préfrontal (21), par des effets au niveau du noyau du tractus solitaire, ou encore par des effets sur la vidange gastrique ou la dépense énergétique (22).
Thondam SK et al. ont été les premiers à publier les effets bénéfiques métaboliques d’un traitement par analogue du GLP1 chez un sujet ayant été traité à l’âge de 9 ans pour un craniopharyngiome, ayant atteint l’IMC maximal de 63,3 kg/m² à l’âge de 20 ans (23). Des résultats encourageants obtenus sur 8 patients ont été publiés par la suite (perte de 13,1 ± 5,1 kg, [9-22] ; diminution de la résistance à l’insuline, augmentation de la satiété) [24].
Il est maintenant nécessaire de confirmer ces résultats par une étude multicentrique randomisée. C’est l’objet de l’étude CRANOEXE. Il s’agit d’une étude randomisée, en parallèle, en double insu, dont l’objectif principal est de comparer à 6 mois l’évolution du poids obtenue sous exénatide par rapport à celle obtenue sous placebo, chez des patients adultes ayant une obésité hypothalamique secondaire au traitement d’un craniopharyngiome. Les objectifs secondaires sont de comparer à 6 mois la tolérance des 2 stratégies lors de chaque évaluation, les facteurs de risque cardiométabolique, le comportement alimentaire, la qualité de vie, la dépense énergétique. Les principaux critères d’inclusion sont un âge compris entre 18 et 65 ans, un antécédent de craniopharyngiome traité par chirurgie associée ou non à une radiothérapie, sans signe de récidive évolutive depuis 12 mois, un IMC > 30 kg/m² avec prise de poids vérifiée depuis le traitement du craniopharyngiome, la présence d’au moins un déficit antéhypophysaire attestant de l’atteinte hypothalamo-hypophysaire, la substitution correcte des déficits antéhypophysaires. Les principaux critères d’exclusion sont un traitement préalable par analogues du GLP, les patients diabétiques de type 2 insulinotraités, un antécédent d’acidocétose, une hypertriglycéridémie > 4 g/l, un antécédent de cancer pancréatique, une élévation de la calcitonine plasmatique.
CRANIOEXE est financée par un PHRC national et soutenue par BMS qui fournira la molécule et le placebo. L’étude démarrera début 2014.
Références bibliographiques
- Karavitaki N, Warner JT, Marland A, et al. GH replacement does not increase the risk of recurrence in patients with craniopharyngioma. Clin Endocrinol (Oxf). 2006 May;64(5):556-60.
- Müller HL, Gebhardt U, Teske C, et al. Post-operative hypothalamic lesions and obesity in childhood craniopharyngioma: results of the multinational prospective trial KRANIOPHARYNGEOM 2000 after 3-year follow-up. Eur J Endocrinol. 2011 Jul;165(1):17-24. doi: 10.1530/EJE-11-0158. Epub 2011 Apr 13.
- Elowe-Gruau E, Beltrand J, Brauner R, et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. J Clin Endocrinol Metab. 2013 Jun;98(6):2376-82.
- Wilken B, Hanefeld F, Schröter W, Leonhardt U. Hyperphagia in children with craniopharyngioma is associated with hyperleptinaemia and a failure in the downregulation of appetite. Eur J Endocrinol. 1998 Jan;138(1):89-91.
- Goldstone AP, Patterson M, Kalingag N, et al. Fasting and postprandial hyperghrelinemia in Prader-Willi syndrome is partially explained by hypoinsulinemia, and is not due to peptide YY3-36 deficiency or seen in hypothalamic obesity due to craniopharyngioma. J Clin Endocrinol Metab. 2005 May;90(5):2681-90.
- Shaikh MG, Grundy RG, Kirk JM. Hyperleptinaemia rather than fasting hyperinsulinaemia is associated with obesity following hypothalamic damage in children. Eur J Endocrinol. 2008 Dec;159(6):791-7.
- Lustig RH, Hinds PS, Ringwald-Smith K, et al. Octreotide therapy of pediatric hypothalamic obesity: a double-blind, placebo-controlled trial. J Clin Endocrinol Metab. 2003 Jun;88(6):2586-92.
- Danielsson P, Janson A, Norgren S, Marcus C Impact sibutramine therapy in children with hypothalamic obesity or obesity with aggravating syndromes. J Clin Endocrinol Metab. 2007 Nov;92(11):4101-6. Epub 2007 Aug 28.
- Fernandes JK, Klein MJ, Ater JL, Kuttesch JF, Vassilopoulou-Sellin R. Triiodothyronine supplementation for hypothalamic obesity. Metabolism. 2002 Nov;51(11):1381-3.
- Mason PW, Krawiecki N, Meacham LR. The use of dextroamphetamine to treat obesity and hyperphagia in children treated for craniopharyngioma. Arch Pediatr Adolesc Med. 2002 Sep;156(9):887-92.
- Ismail D, O'Connell MA, Zacharin MR. Dexamphetamine use for management of obesity and hypersomnolence following hypothalamic injury. J Pediatr Endocrinol Metab. 2006 Feb;19(2):129-34.
- Greenway FL, Bray GA Treatment of hypothalamic obesity with caffeine and ephedrine. Endocr Pract. 2008 Sep;14(6):697-703.
- Hamilton JK, Conwell LS, Syme C, Ahmet A, Jeffery A, Daneman D. Hypothalamic Obesity following Craniopharyngioma Surgery: Results of a Pilot Trial of Combined Diazoxide and Metformin Therapy. Int J Pediatr Endocrinol.
- Gatta B, Nunes ML, Bailacq-Auder C, Etchechoury L, Collet D. Tabarin A Is bariatric surgery really inefficient in hypothalamic obesity? Clin Endocrinol (Oxf). 2013 Apr;78(4):636-8. doi: 10.1111/cen.12031.
- Bretault M, Boillot A, Muzard L, et al. Clinical review: Bariatric surgery following treatment for craniopharyngioma: a systematic review and individual-level data meta-analysis. J Clin Endocrinol Metab. 2013 Jun;98(6):2239-46.
- Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest. 1998 Feb 1;101(3):515-20.
- Pinelli NR, Jantz A, Smith Z, Abouhassan A, Ayar C, Jaber NA, et al, 2009 et 2011. Effect of administration time of exenatide on satiety responses, blood glucose, and adverse events in healthy volunteers. J Clin Pharmacol. 2011 Feb;51(2):165-72.
- Astrup A, Rössner S, Van Gaal L, et al ; NN8022-1807 Study Group. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet. 2009 Nov 7;374(9701):1606-16. doi: 10.1016/S0140-6736(09)61375-1 et Astrup A, Carraro R, Finer N, et al. ; NN8022-1807 Investigators. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond). 2012 Jun;36(6):843-54. doi: 10.1038/ijo.2011.158. Epub 2011 Aug 16.
- Rosenstock J, Klaff LJ, Schwartz S, et al. Effects of exenatide and lifestyle modification on body weight and glucose tolerance in obese subjects with and without pre-diabetes. Diabetes Care. 2010 Jun;33(6):1173-5. doi: 10.2337/dc09-1203. Epub 2010 Mar 23
- Schlögl H, Kabisch S, Horstmann A, et al. Exenatide-induced reduction in energy intake is associated with increase in hypothalamic connectivity. Diabetes Care. 2013 Jul;36(7):1933-40. doi: 10.2337/dc12-1925. Epub 2013 Mar 5.
- Pannacciulli N, Le DS, Salbe AD, et al. Postprandial glucagon-like peptide-1 (GLP-1) response is positively associated with changes in neuronal activity of brain areas implicated in satiety and food intake regulation in humans. Neuroimage. 2007 Apr 1;35(2):511-7. Epub 2007 Jan 18.
- Dushay J, Gao C, Gopalakrishnan GS, et al. Short-term exenatide treatment leads to significant weight loss in a subset of obese women without diabetes. Diabetes Care. 2012 Jan;35(1):4-11.
- Thondam SK, Cuthbertson DJ, Aditya BS, Macfarlane IA, Wilding JP, Daousi C. A glucagon-like peptide-1 (GLP-1) receptor agonist in the treatment for hypothalamic obesity complicated by type 2 diabetes mellitus. Clin Endocrinol (Oxf). 2012 Oct;77(4):635-7
- Zoicas F, Droste M, Mayr B, Buchfelder M, Schöfl C. GLP-1 analogues as a new treatment option for hypothalamic obesity in adults: report of nine cases. Eur J Endocrinol. 2013 Apr 15;168(5):699-706.

Des calcifications intrasellaires piégeuses
J.F. Bonneville, J. Kreutz , J. Potorac (Liège)
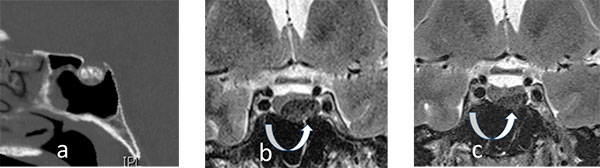 |
||
| Figure 1 | Figure 2 | Figure 3 |
Gérard, 47 ans, présente des céphalées chroniques. Un scanner demandé pour éliminer une sinusite révèle des calcifications "en motte" occupant les deux tiers d’une selle turcique d’allure normale (figure 1). L’IRM réalisée secondairement met en évidence une lésion intrasellaire, ovalaire, bien limitée, hypo-intense en T2 (figure 2).
Un craniopharyngiome, une lithiase hypophysaire, un kyste de la poche de Rathke sont évoqués.
Cependant, le bilan hormonal fait découvrir un taux de prolactine à 6600 mUI/L.
Le prolactinome présente une nette diminution de volume après 3 mois de traitement par cabergoline et la prolactine est normalisée à 77 mUI/L (figure 3).
Commentaires : Les calcifications sont considérées comme rares dans les adénomes hypophysaires. Elles ont été signalées après hémorragie intratumorale et après radiothérapie et plus volontiers dans les adénomes non fonctionnels et les adénomes somatotropes. Elles sont plutôt curvilinéaires que nodulaires.

