|
Solange Grunenwald |
Chers Collègues,
En cette fin d’année 2020, où notre vie a été chamboulée et nos rendez-vous endocrinologues habituels adaptés, reportés et parfois annulés, la Lettre de la Thyroïde résiste et est au rendez-vous !
Vous y trouverez bien sûr LE thème de l’année à travers une mise au point du Pr Philippe Caron sur les atteintes thyroïdologiques liées au Covid-19. Sans doute avez-vous remarqué une recrudescence de thyroïdites subaiguës ces derniers mois…
Mais ce virus n’a pas interrompu le reste de la recherche en thyroïdologie, et d’autres sujets passionnants seront abordés dans cette lettre.
Dans le domaine de la fertilité, Gérard Chabrier nous rassure sur la fonction ovarienne des patientes traitées par iode 131. Puis Magalie Haissaguerre nous met en garde sur l’adaptation des traitements par L-thyroxine tout au long de la grossesse.
En cancérologie, Camille Buffet met à l’honneur une correspondance de Lionel Groussin publiée récemment dans le New England Journal of Medicine. La redifférenciation des cancers thyroïdiens réfractaires est un concept séduisant pour pouvoir traiter ces patients par iode 131. Après les inhibiteurs de BRAFV600E et/ou les inhibiteurs de MEK, les inhibiteurs de NTRK pourraient eux aussi, chez les patients présentant une fusion du gène NTRK tumoral, permettre une irathérapie.
Enfin, Nicolas Chevalier nous alerte sur l’impact des composés perfluorés (perturbateurs endocriniens présents notamment dans les surfaces antiadhésives) sur la fonction thyroïdienne chez les femmes enceintes.
Bonne lecture à tous et joyeuses fêtes de fin d’année !
S. Grunenwald déclare avoir des liens d’intérêts avec Merck, Genevrier, Pfizer, Novartis, Ipsen, Novonordick, Sanofi.
Philippe Caron
Service d’endocrinologie et maladies métaboliques, pôle cardiovasculaire et métabolique, CHU-Larrey, Toulouse.
Les hormones thyroïdiennes jouent un rôle important dans la régulation de la réponse immunitaire. Toute anomalie fonctionnelle thyroïdienne peut entraîner une réponse immunitaire anormale participant à la physiopathologie des manifestations viscérales du Covid-19. En outre, au cours des formes sévères, le SARS-CoV-2 peut entraîner une hyperactivité de la réponse immune responsable d’un “orage cytokinique”, avec libération de cytokines pro-inflammatoires (IL-6, TNFa).
La mise en évidence de l’ARNm du SARS-CoV-2 dans le sérum des patients témoigne d’épisodes de virémie expliquant les atteintes viscérales extrapulmonaires observées chez les patients Covid-19. L’enzyme de conversion 2 (ACE2), une carboxypeptidase membranaire et un “récepteur” pour le SARS-CoV-2, est présente en particulier sur les cellules folliculaires thyroïdiennes et sur les cellules hypophysaires [1, 2].
Ces données peuvent expliquer, d’une part, l’apparition des altérations des paramètres fonctionnels thyroïdiens et, d’autre part, les atteintes thyroïdiennes au cours des épisodes infectieux chez les patients atteints de Covid-19.
Altérations des paramètres fonctionnels thyroïdiens
Plusieurs études [3-5] ont mis en évidence des anomalies des paramètres fonctionnels thyroïdiens chez les patients Covid-19. Chen T et al. rapportent une diminution des concentrations de la TSH et de la T3 chez les patients Covid-19, plus importante dans les formes sévères ayant entraîné le décès des patients par rapport à celle observée chez des patients qui ont survécu à l’épisode Covid-19 [3]. Chen M et al., dans une étude rétrospective, retrouvent également une diminution de la TSH et de la T3 chez 64 % des patients présentant une atteinte pulmonaire au cours du Covid-19. Ces anomalies sont plus importantes que celles retrouvées dans le bilan des sujets contrôles et des patients ayant une pneumopathie non Covid-19 (perturbations du bilan thyroïdien corrélées à la sévérité de l’atteinte infectieuse Covid-19).
Ces altérations des paramètres fonctionnels thyroïdiens sont comparables à celles observées au cours des affections non thyroïdiennes et décrites comme “syndrome de basse T3”, caractérisées par une diminution de la T3 qui témoigne d’une diminution de l’activité des désiodases, alors que la concentration de T4 est soit normale soit discrètement diminuée. Ces anomalies seraient à rattacher à un stress chronique lié à l’hypoxie, à une sécrétion de glucocorticoïdes et à la libération de cytokines pro-inflammatoires (IL-6) liées à l’infection au Covid-19. La diminution de la concentration de la TSH est également liée à une atteinte des cellules hypophysaires par le SARS-CoV-2.
Ces anomalies du bilan fonctionnel thyroïdien, fréquentes chez les patients Covid-19, sont le plus souvent transitoires et n’imposent pas de traitement.
Thyrotoxicoses
Un épisode de thyrotoxicose auto-immune pourrait être déclenché par l’infection à SARS-CoV-2, mais les observations de maladie de Basedow sont rares au cours de la pandémie de Covid-19. En revanche, plusieurs études épidémiologiques mettent en évidence une prévalence augmentée des thyrotoxicoses secondaires à une thyroïdite “destructrice” subaiguë ou silencieuse chez les patients Covid-19. Dans une étude rétrospective portant sur 287 patients italiens, 20,2 % des patients présentent une thyrotoxicose soit clinique (10,8 %) soit subclinique (9,4 %) lors d’une hospitalisation pour Covid-19 [6]. La prévalence de la thyrotoxicose est corrélée à l’augmentation de la concentration d’IL-6, en faveur d’une thyroïdite secondaire à “l’orage cytokinique” ou à l’atteinte directe des cellules folliculaires thyroïdiennes par le SARS-CoV-2.
Muller et al. rapportent également une prévalence élevée de thyrotoxicose (15 %) chez les patients Covid-19 hospitalisés en unité de réanimation pour une atteinte pulmonaire sévère par rapport aux patients Covid-19 hospitalisés en soins intensifs (2 %) ou à ceux hospitalisés en réanimation respiratoire pour une pneumopathie non liée au Covid-19 (1 %) [7]. Les auteurs décrivent chez ces patients une “thyrotoxicose à T4” marquée par une T4l normale ou augmentée avec une TSH et une T3l basses : la thyroïdite subaiguë ou silencieuse entraînerait une libération de T4 alors que, chez les patients présentant une forme sévère de Covid-19, il existe une diminution de la concentration de T3l. Après 2 mois de suivi, 75 % des patients sont euthyroïdiens. Une amélioration rapide des tableaux clinicobiologiques chez la plupart des patients traités par de faibles doses de corticoïdes était également rapportée dans la littérature.
Par ailleurs :
- une augmentation des complications thromboemboliques et des épisodes de fibrillation auriculaire chez les patients thyrotoxiques est rapportée par Lania et al. [6]. Toute thyrotoxicose non contrôlée augmente le risque de complications au cours d’une infection au Covid-19, en particulier chez le sujet âgé ;
- une infection liée au Covid-19 peut entraîner une crise thyrotoxique chez les patients présentant une thyrotoxicose non contrôlée. Il faut rappeler la nécessité de continuer un traitement par antithyroïdiens de synthèse chez les patients présentant une hyperthyroïdie auto-immune en particulier ;
- une surveillance hématologique est nécessaire chez les patients traités par antithyroïdiens de synthèse afin de diagnostiquer en urgence une leucopénie ou une agranulocytose dans le contexte d’une infection au Covid-19.
Insuffisance thyroïdienne
L’insuffisance thyroïdienne est fréquente, présente chez plus de 20 % des sujets âgés, surtout de sexe féminin, dont le traitement repose sur la lévothyroxine.
Dans une étude rétrospective portant sur 3 703 patients Covid-19, van Gerwen et al. n’observent pas d’augmentation du risque d’hospitalisations, de séjours en réanimation respiratoire et de décès chez les 251 patients (6,8 %) présentant une hypothyroïdie traitée par rapport aux patients non hypothyroïdiens (figure) [8].
Figure. Survie chez les patients hypothyroïdiens traités ou non hypothyroïdiens, hospitalisés pour une infection Covid-19 [8].
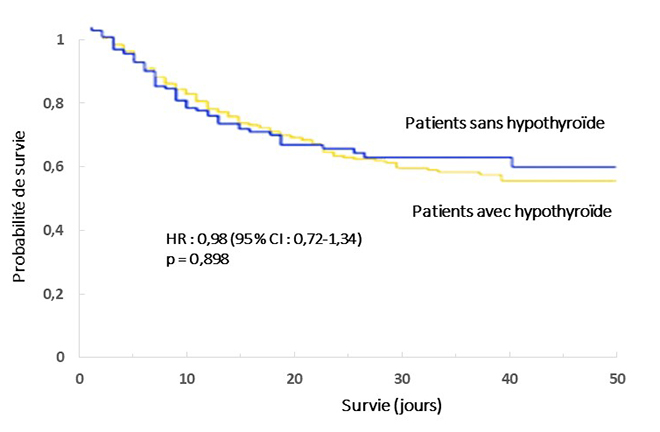
Alors qu’une hypothyroïdie non traitée augmente la susceptibilité aux infections, cette étude montre que le traitement de l’hypothyroïdie n’augmente pas le risque de formes graves ou de décès liés au SARS-CoV-2. Cela permet d’insister sur la poursuite du traitement substitutif par lévothyroxine chez les patients hypothyroïdiens, en particulier pendant toute la durée d’un éventuel confinement.
Références bibliographiques
1. Lazartigues E et al. Endocrine significance of SARS-CoV-2’s reliance on ACE2. Endocrinology 2020;161(9):bqaa108.
2. Rotondi M et al. Detection of SARS-COV-2 receptor ACE-2 mRNA in thyroid cells: a clue for COVID-19-related subacute thyroiditis. J Endocrinol Invest 2020:1-6.
3. Chen T et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ 2020;368:m1091.
4. Chen M et al. Thyroid function analysis in 50 patients with COVID-19: a retrospective study. Thyroid 2020. doi: 10.1089/thy.2020.0363
5. Li T et al. Characteristics of laboratory indexes in COVID-19 patients with non-severe symptoms in Hefei City, China: diagnostic value in organ injuries. Eur J Clin Microbiol Infect Dis 2020;39(12):2447-55.
6. Lania A et al. Thyrotoxicosis in patients with Covid-19: the THYRCOV study. Eur J Endocrinol 2020;183:381-7.
7. Muller I et al. SARS-CoV-2-related atypical thyroiditis. Lancet Diabetes Endocrinol 2020;8(9):739-41.
8. Van Gerwen M et al. Outcomes of patients with hypothyroidism and COVID-19: a retrospective cohort study. Front Endocrinol (Lausanne) 2020;11:565.
P. Caron déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Gérard Chabrier
Centre d’endocrinologie, Strasbourg ; Service médecine interne, endocrinologie et nutrition, hôpital de Hautepierre, hôpitaux universitaires de Strasbourg.
Les effets potentiellement délétères à long terme du traitement par l’iode radioactif (IRA) sur la fertilité suscitent souvent l’inquiétude chez les jeunes femmes prises en charge pour un cancer différencié de la thyroïde (CDT) en âge de procréer.
Publiées en 2008 puis en 2011, 2 revues systématiques sur ce sujet [1, 2], souvent citées, avaient abouti à des conclusions plutôt rassurantes. Les effets sur la fertilité avaient été évalués chez des jeunes femmes ayant un CDT traitées par IRA. Ces études avaient conclu à l’absence d’éléments probants en faveur de la persistance, au-delà de 12 mois, d’effets indésirables de l’administration d’IRA sur la fonction gonadique, la fertilité ou le déroulement des grossesses ainsi que sur la morbimortalité néonatale et les malformations congénitales. Seule la survenue d’une ménopause à un âge légèrement plus précoce avait été identifiée chez les femmes traitées. Mais ces 2 revues s’appuyaient sur des études rétrospectives, et la majorité d’entre elles n’intéressait qu’un petit nombre de patientes.
Au cours de la dernière décennie, des travaux sur le même sujet se sont concentrés tout particulièrement sur les effets de l’administration de doses ablatives d’IRA sur la fonction ovarienne. Ces recherches ont pu être réalisées à l’aide de marqueurs tels que l’hormone antimüllérienne (AMH), dont on sait que les taux sériques sont fortement corrélés au nombre de follicules antraux, représentant ainsi un bon reflet de la réserve ovarienne et un bon paramètre d’évaluation de l’état de fertilité.
Ces nouvelles données ont permis à une équipe néerlandaise [3] de revisiter l’ensemble des études effectuées de 1970 à janvier 2020, sous la forme d’une revue systématique de la littérature et d’une méta-analyse. Piek et al. ont ainsi analysé l’effet du traitement par IRA sur la fonction ovarienne, la fertilité et le devenir des grossesses chez des jeunes femmes adultes en âge de procréer, atteintes d’un CDT et ayant eu une thyroïdectomie totale suivie d’une thérapie par IRA. Les populations comparatives étaient soit des femmes atteintes de CDT n’ayant bénéficié que d’une thyroïdectomie totale, soit des femmes en bonne santé. Les résultats des différentes études comportaient en tout ou partie l’évaluation de la fonction et/ou de la réserve ovarienne via différents marqueurs dont les taux d’AMH en particulier, mais aussi de la fertilité, des troubles du cycle menstruel, de la ménopause et de l’issue de la grossesse. Au total, 689 références ont ainsi été identifiées, mais seulement 22 études ont été retenues pour la revue détaillée, concernant 36 215 patientes. La majorité des études reposait sur des populations monocentriques et était réalisée rétrospectivement. Une méta-analyse a été réalisée pour déterminer les différences dans les taux de grossesse.
Quelles sont les principales observations à retenir ?
Sur 4 études observationnelles dont une prospective ne s’intéressant qu’aux données cliniques, au cours de la 1re année suivant le traitement par IRA (doses cumulées d’I131 allant de 2 997 MBq à 59 GBq (81 à 1 595 mCi)), les altérations du cycle menstruel étaient constatées chez 12 % à 31 % des patientes traitées, de façon significativement plus fréquente que dans les groupes témoins (31,1 % versus 14,5 %, p = 0,02) [4]. Des périodes d’aménorrhées étaient décrites chez 8 % à 16 % des patientes entre 4 et 10 mois après l’administration d’IRA. Dans une seule étude, la ménopause apparaissait à un âge légèrement plus précoce chez les femmes traitées par IRA que chez celles n’ayant pas reçu ce traitement (49,5 ans versus 51 ans respectivement, p < 0,001) [5].
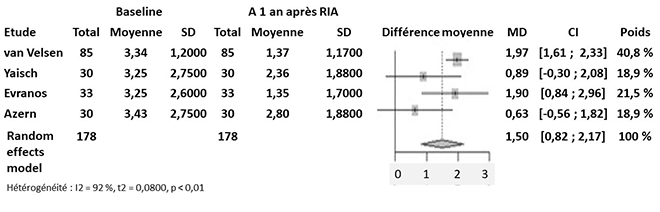
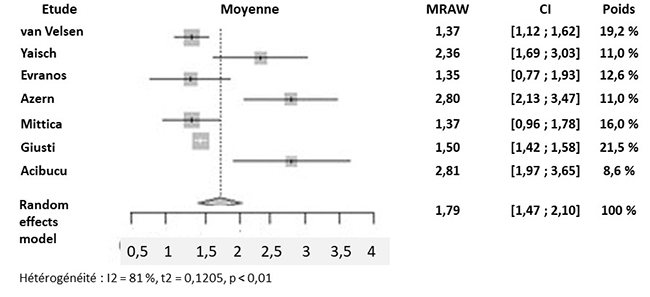
Sept études ont examiné l’effet du traitement par IRA sur la réserve ovarienne, via les taux d’AMH. Dans 4 d’entre elles, pour des doses d’I131 allant de 1 110 à 5 550 MBq (30 à 150 mCi), les taux d’AMH étaient significativement plus bas, dès le 3e mois et jusqu’à 1 an après le traitement par IRA, par rapport aux taux de base (différence moyenne 1,50 ng/mL) (figure 1a). Les taux d’AMH groupés des patientes des 7 études traitées par IRA étaient de 1,79 ng/mL, significativement plus bas que les taux de base (figure 1b).
Figure 1. (a) Taux moyens d’AMH avant et 1 an après traitement par IRA chez les patientes atteintes de CDT. (b) Taux moyens d’AMH après traitement par IRA chez les patientes atteintes de CDT.
(1a)
(1b)
Dans 1 étude prospective récente [6] évaluant les taux d’AMH après administration d’IRA, les taux d’AMH diminuaient de 50 % par rapport aux taux de base, et ce jusqu’à 12 mois après une seule dose d’I131 pour se stabiliser par la suite. La diminution des taux d’AMH était moins marquée chez les patientes de moins de 35 ans que chez celles de plus de 35 ans.
Deux études indiquaient que de fortes doses d’IRA altéreraient davantage la réserve ovarienne évaluée par les taux d’AMH. En revanche, des doses plus faibles jusqu’à 1 110 MBq (30 mCi), comme celles proposées pour l’ablation des reliquats thyroïdiens, semblaient inoffensives.
A contrario, 3 études ne trouvaient pas de relation statistiquement significative entre l’exposition à l’IRA et les niveaux d’AMH, le principal facteur de diminution des taux d’AMH étant l’âge des patientes traitées et non le type de traitement. En outre, il n’était pas identifié de corrélation entre les niveaux d’AMH et la fertilité et/ou la survenue de grossesse.
Quant à la méta-analyse, elle a montré que les patientes traitées par IRA n’avaient pas moins de chances que les femmes du groupe témoin de tomber enceinte et de mener une grossesse à terme (OR = 0,98 [IC95 : 0,72-1,33] ; p = 0,909). Ces résultats suggèrent que le traitement par IRA n’était pas associé à une infertilité à long terme (figure 2).
Figure 2. Différences de taux de grossesse entre patientes traitées par IRA et patientes contrôles.

Il s’agit, somme toute, de données rassurantes, mais néanmoins encore porteuses de quelques incertitudes quant à l’impact de l’administration d’IRA sur la réserve ovarienne.
La revue de Piek et al. [3] n’a pas pu prendre en compte la publication récente d’un autre travail hollandais [7] s’intéressant plus spécifiquement au devenir à long terme de la fertilité chez les femmes survivantes d’un CDT infantile (diagnostic à ≤ 18 ans entre 1970 et 2013) et traitées par IRA (dose cumulative médiane d’I131 administrée de 7,4 GBq). Étaient évalués d’une part diverses caractéristiques reproductives (âge de la ménarche et ménopause, obtentions et issues de grossesses, besoin d’assistance à la procréation) au moyen de questionnaires et examens de dossiers médicaux, et d’autre part, les taux d’AMH (comparés à ceux de 420 femmes non traitées pour un cancer, l’âge à l’évaluation de l’AMH ne différant pas entre survivantes du CDT et groupe témoin). 55 femmes ayant survécu à un CDT infantile, d’âge médian 31,0 ans, ont ainsi été évaluées après un suivi moyen de 15,4 ans.
Parmi les 55 femmes, âgées de 18 ans ou plus lors de l’évaluation, 25 ont déclaré 64 grossesses, dont 45 ont abouti à la naissance d’un enfant vivant. Sur ces 55 patientes, 10,9 % ont eu recours à une aide à la procréation. Aucune patiente n’a signalé de ménopause précoce. Les niveaux médians d’AMH ne différaient pas entre les femmes ayant survécu à un CDT infantile et le groupe témoin (2,0 μg/L contre 1,6 μg/L, p = 0,244). La dose cumulative d’I131 n’était pas associée aux niveaux d’AMH chez les survivantes de CDT.
Ainsi, les patientes traitées par IRA pendant l’enfance ne semblent pas présenter d’anomalies majeures dans les caractéristiques reproductives, ni dans les marqueurs prédictifs de l’insuffisance ovarienne.
En conclusion, il ne semble pas y avoir d’argument probant signifiant que les femmes en âge de procréer aient une fertilité diminuée à long terme après avoir été traitées par de l’131 pour un CDT, quelle que soit la période à laquelle s’est déroulé le traitement. En revanche, il semble y avoir une influence négative sur le cycle menstruel pendant la première année qui suit le traitement et des concentrations sériques d’AMH fréquemment réduites au cours de cette même période, affectant potentiellement la réserve ovarienne et donc la fertilité à court terme. Une prise en charge plus spécifique pourrait être discutée chez les femmes de plus de 35 ans exprimant un désir de grossesse à court terme et chez lesquelles un traitement par IRA est programmé.
Références bibliographiques
- Sawka AM et al. A systematic review examining the effects of therapeutic radioactive iodine on ovarian function and future pregnancy in female thyroid cancer survivors. Clin Endocrinol (Oxf) 2008;69(3):479-90.
- Sioka C, Fotopoulos A. Effects of I-131 therapy on gonads and pregnancy outcome in patients with thyroid cancer. Fertil Steril 2011;95(5):1552-9.
- Piek MW et al. The effect of radioactive iodine therapy on ovarian function and fertility in female thyroid cancer patients: a systematic review and meta-analysis. Thyroid 2020. doi: 10.1089/thy.2020.0356. Online ahead of print.
- Sioka C et al. Menstrual cycle disorders after therapy with iodine-131. Fertil Steril 2006;86(3):625-8.
- Ceccarelli C et al. 131I therapy for differentiated thyroid cancer leads to an earlier onset of menopause: results of a retrospective study. J Clin Endocrinol Metab 2001;86(8):3512-5.
- Van Velsen EFS et al. Longitudinal analysis of the effect of radioiodine therapy on ovarian reserve in females with differentiated thyroid cancer. Thyroid 2020;30(4):580-7.
- Nies M et al. Long‐term effects of radioiodine treatment on female fertility in survivors of childhood differentiated thyroid carcinoma. Thyroid 2020;30(8):1169-76.
G. Chabrier déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Magalie Haissaguerre
Service d'endocrinologie et de cancérologie endocrinienne Pr Tabarin, hôpital Haut-Lévêque, CHU de Bordeaux, Pessac.
Les besoins du fœtus en hormones thyroïdiennes sont assurés par le passage transplacentaire des hormones thyroïdiennes maternelles. L’hypothyroïdie et l’hyperthyroïdie maternelle avérée sont associées à un petit poids de naissance. Actuellement, d’après l’American Thyroid Association (ATA) [1], les recommandations formelles de traitement par hormones thyroïdiennes pendant la grossesse concernent : les patientes enceintes avec une TSH > 10 mU/L et les patientes enceintes ayant des anticorps anti-TPO positifs et une TSH > 4m U/L. Pour les patientes enceintes présentant une hypothyroïdie infraclinique (définie par une TSH entre 4 et 10 mU/L, une T4L normale et des Ac anti-TPO négatifs) ou les femmes enceintes avec une TSH comprise entre 2,5 et 4 mU/L dans un contexte d’anticorps anti-TPO positifs, un traitement par lévothyroxine “peut être considéré”. À ce jour, la majorité des études randomisées montre que le traitement par lévothyroxine pendant la grossesse des femmes ayant une hypothyroïdie infraclinique, notamment au premier trimestre de la grossesse, ne semble pas améliorer significativement le devenir des enfants sur le plan intellectuel et cognitif [2, 3].
L’impact potentiel des dysthyroïdies biologiques infracliniques sur le poids de naissance n’est pas bien connu, et les résultats diffèrent selon les études.
Pour répondre à cette question, Korevaar et al. ont réalisé une méta-analyse, publiée dans The Lancet en juin 2020 [4], portant sur les données individuelles de 20 cohortes prospectives (dont 5 non publiées) de femmes enceintes, dont le bilan biologique thyroïdien et le poids de naissance des enfants étaient connus. Étaient exclues les femmes ayant une grossesse multiple ou résultant d’une FIV, une thyroïdopathie préexistante à la grossesse, un traitement pour la thyroïde, et celles ayant fait une fausse couche ou ayant eu un enfant mort-né. L’objectif était d’étudier le poids de naissance en fonction de l’âge gestationnel. Les données ont été ajustées pour l’âge maternel, l’IMC, l’origine ethnique, le tabagisme, la parité, l’âge gestationnel au moment des prises de sang, le sexe fœtal et l’âge gestationnel à la naissance. Parmi les 48 145 mères, 1 275 (3 %) et 929 (2 %) présentaient respectivement une hypothyroïdie infraclinique (TSH élevée mais T4L normale) ou une hypothyroxinémie (TSH normale mais T4L diminuée).
L’hypothyroïdie infraclinique maternelle était associée à un risque plus élevé de petit poids pour l’âge gestationnel (PAG). Cette association était 5 fois plus forte au 3e trimestre qu’au 1er trimestre. Lorsque les Ac anti-TPO maternels étaient positifs, cette association entre une hypothyroïdie infraclinique et un petit poids de naissance était 5 fois plus forte par rapport aux mères sans Ac anti-TPO.
L’hypothyroxinémie maternelle isolée était associée à un risque moins élevé de PAG et à un poids de naissance plus élevé par rapport aux femmes enceintes dites euthyroïdiennes. Une augmentation de la concentration plasmatique de T4L de 1 DS était liée à une réduction du poids de naissance de 21 g, et cette association était plus forte au 3e trimestre. Des concentrations plus élevées de T4L étaient associées à un poids de naissance plus petit, même lorsque la T4L restait dans les normes habituelles du laboratoire. La relation négative, concentration-dépendante, entre la T4L et le poids de naissance pourrait s’expliquer soit par le passage transplacentaire de la T4L maternelle, avec un effet direct de la T4L sur la croissance fœtale, ce qui induit une augmentation du catabolisme lipidique et protéique au niveau fœtal ; soit par un mécanisme impliquant l’hCG. Pour les auteurs, une hypothyroxinémie maternelle ne reflète pas nécessairement un défaut de fonction thyroïdienne, mais pourrait être un état spécifique lié à la grossesse et non pas un état pathologique.
Au final, Korevaar et al. concluent que l’hypothyroïdie infraclinique pendant la grossesse serait un facteur de risque de PAG et serait associée à une réduction du poids de naissance, d’autant plus si les anticorps anti-TPO maternels sont positifs. Au contraire, l’hypothyroxinémie isolée, en particulier au 3e trimestre de la grossesse, serait associée à un poids de naissance plus élevé et à une réduction du risque de PAG (figure). De plus, les femmes enceintes qui présentaient une concentration de T4L normale, mais dans les valeurs hautes des seuils des laboratoires, avaient un risque plus élevé de PAG et d’enfants nés avec un faible poids de naissance.
Figure. Synthèse des résultats : association de la concentration plasmatique de la TSH et de la T4L maternelle avec le poids intra-utérin et le poids de naissance.

Ces résultats sont cohérents avec ceux d’un essai randomisé récent publié dans The New England Journal of Medicine [5], qui montre qu’un traitement par petite dose de lévothyroxine était associé de manière non significative à un risque plus élevé de PAG.
À la suite d’une autre publication suggérant un retentissement neurocognitif chez les enfants de mères traitées par lévothyroxine pendant la grossesse [6], ce travail repose la question du risque de surtraitement par hormones thyroïdiennes pendant la grossesse [7, 8]. Est-ce que les femmes enceintes traitées par hormones thyroïdiennes (quelle qu’en soit la raison) nécessiteraient un meilleur contrôle de la T4L, durant toute la grossesse (et pas seulement au 1er trimestre), pour éviter d’éventuels effets préjudiciables d’un excès d’hormones thyroïdiennes sur le fœtus, notamment sur le poids de naissance et le développement cognitif ? Cette association décrite entre T4L et poids de naissance étant dose-dépendante et plus prononcée au 3e trimestre de la grossesse, cet article incite à une réflexion dans le suivi thyroïdien régulier des femmes enceintes traitées par lévothyroxine, y compris en fin de grossesse.
Références bibliographiques
1. Alexander EK et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-89.
2. Casey BM et al. Treatment of Subclinical Hypothyroidism or Hypothyroxinemia in Pregnancy. N Engl J Med 2017;376(9):815-25.
3. Lazarus JH et al. Antenatal thyroid screening and childhood cognitive function. N Engl J Med 2012;366(6):493-501.
4. Derakhshan A et al. Association of maternal thyroid function with birthweight: a systematic review and individual-participant data meta-analysis. Lancet Diabetes Endocrinol 2020;8(6):501-10.
5. Dhillon-Smith RK et al. Levothyroxine in Women with Thyroid Peroxidase Antibodies before Conception. N Engl J Med 2019;380(14):1316-25.
6. Hales C et al. Controlled Antenatal Thyroid Screening II: Effect of Treating Maternal Suboptimal Thyroid Function on Child Cognition. J Clin Endocrinol Metab 2018;103(4):1583-91.
7. Korevaar TIM et al. Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood: a population-based prospective cohort study. Lancet Diabetes Endocrinol 2016;4(1):35-43.
8. Korevaar TIM et al. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nat Rev Endocrinol 2017;13(10):610-22.
des cancers thyroïdiens réfractaires ?
Camille Buffet
Unité fonctionnelle des pathologies thyroïdiennes et tumeurs endocrines, hôpital Pitié-Salpêtrière, Paris.
La prise en charge des cancers thyroïdiens métastatiques réfractaires à la thérapie classique par l’iode radioactif représente un défi pour le clinicien. Les inhibiteurs de tyrosine kinase (ITK), classiquement prescrits dans ce contexte, peuvent échouer en raison de résistance primaire ou acquise à la molécule ou en raison d’effets indésirables graves ou modérés mais chroniques et délétères imposant l’arrêt du médicament. Ainsi a émergé le concept de redifférenciation, qui consiste à traiter les patients avec un ou plusieurs médicaments capables de restaurer la sensibilité à l’iode radioactif de cancers réfractaires. Plusieurs composés (sorafénib, acide rétinoïque, inhibiteur d’histone désacétylase, etc.) ont été testés il y a une dizaine d’années environ avec des résultats décevants. Un regain d’intérêt pour cette stratégie est apparu avec la publication d’un essai pilote incluant 24 patients, montrant des résultats prometteurs obtenus avec un inhibiteur pharmacologique de MEK (le sélumétinib) prescrit pendant 4 semaines [1]. Cette publication a ouvert le champ à la stratégie de redifférenciation avec les inhibiteurs de la voie MAPK, en particulier les inhibiteurs de BRAF V600E et/ou les inhibiteurs de MEK. Les résultats de cette stratégie sont encourageants, affichant des taux de restauration du captage de l’iode de l’ordre de 60 à 70 % [2], ce qui représente un des progrès majeurs de ces dernières années dans la prise en charge des cancers thyroïdiens graves. Un autre progrès majeur est l’apparition de thérapies ciblant très sélectivement une anomalie moléculaire responsable de la tumorigenèse thyroïdienne, à l’inverse des précédents ITK multicibles ayant notamment une action antiangiogénique responsable de nombreux effets indésirables. Le larotrectinib, inhibiteur sélectif de NTRK, en est en exemple, et a montré une efficacité significative (taux de réponse globale de 75 %) avec une bonne tolérance dans une étude de phase I-II chez 55 patients ayant une tumeur solide avec fusion NTRK [3].
Étant donné que les protéines de fusion NTRK entraînent l’activation constitutionnelle de nombreuses voies de signalisation conduisant au cancer, dont la voie des MAPK, l’hypothèse que les inhibiteurs de NTRK puissent avoir un effet de redifférenciation dans les cancers thyroïdiens réfractaires peut être faite.
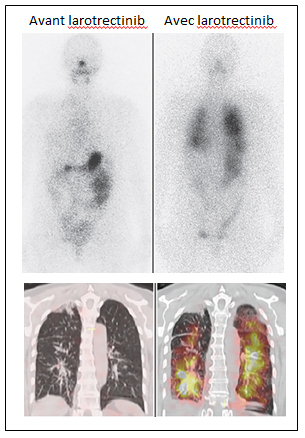
Le cas d’une patiente rapporté cette année dans le New England Journal of Medicine[4] va dans le sens de cette hypothèse. Une patiente de 64 ans atteinte d’un cancer papillaire de la thyroïde et opérée 34 ans plus tôt avait reçu, dans un contexte de progression des métastases pulmonaires avec pleurésie, le lenvatinib, un ITK multicible à action antiangiogénique, arrêté en raison d’effets indésirables sévères et remplacé par le larotrectinib compte tenu de la mise en évidence d’une fusion EML4-NTRK3 dans la tumeur. Cette patiente avait un cancer thyroïdien classé réfractaire après l’administration d’une dose cumulée de 1 400 mCi d’iode 131 et une scintigraphie corps entier blanche lors du 8e et dernier traitement. La scintigraphie diagnostique à l’iode 131 (10 mCi), réalisée après 3 semaines de traitement par larotrectinib, montre une restauration du captage de l’iode 131 au sein de la quasi-totalité des métastases pulmonaires, alors que la scintigraphie diagnostique à l’iode 131 faite sous lenvatinib était blanche (figure). En parallèle, le larotrectinib avait induit une réponse partielle au bout de 2 mois. En raison de la forte activité cumulée d’iode 131 déjà administrée, la patiente n’avait pas reçu de nouvelle dose thérapeutique d’iode 131 lors de la publication du cas. Toutefois, ces données suggèrent la possibilité de traiter à nouveau par iode 131 des patients atteints de cancers thyroïdiens réfractaires traités par larotrectinib.
Sur le plan fondamental, la mise au point de modèles précliniques, notamment d’une lignée cellulaire dérivée d’un cancer de la thyroïde avec fusion NTRK, qui n’existe pas à l’heure actuelle, serait particulièrement intéressante pour étudier le phénomène de redifférenciation sous inhibiteur de NTRK.
Figure. Scintigraphie diagnostique avant et pendant le traitement par larotrectinib.
Références bibliographiques
- Ho AL et al. Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer. N Engl J Med 2013;368(7):623-32.
- Buffet C et al. Redifferentiation of radioiodine-refractory thyroid cancers. Endocr Relat Cancer 2020;27(5):R113-32.
- Drilon A et al. Efficacy of Larotrectinib in TRK fusion-positive cancers in adults and children. N Engl J Med 2018;378(8):731-9.
- Groussin L et al. Larotrectinib-enhanced radioactive iodine uptake in advanced thyroid cancer. N Engl J Med 2020;383(17):1686-7.
C. Buffet déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Nicolas Chevalier
Département d’endocrinologie-diabétologie-reproduction, hôpital de l’Archet, CHU de Nice ; Université Côte d’Azur.
Malgré des arguments expérimentaux (in vitro et in vivo) et épidémiologiques de plus en plus nombreux, l’impact sanitaire des perturbateurs endocriniens (PE) sur la glande thyroïde reste un objet de débat.
De par leur structure chimique, les PE peuvent interférer à plusieurs niveaux clés de la fonction thyroïdienne, mais ils peuvent également modifier finement les concentrations circulantes en hormones thyroïdiennes. Si ces modifications peuvent paraître trop minimes pour avoir une répercussion clinique chez l’adulte, il n’en est probablement pas de même dans certaines périodes clés de la vie (grossesse, petite enfance).
L’équipe de Tim Korevaar a d’ailleurs montré l’existence d’une relation non quadratique, en U inversé, entre les concentrations maternelles en T4 libre (fT4) mesurées avant 18 semaines de grossesse et le développement neurocognitif de l’enfant à naître, évalué par la mesure du QI à l’âge de 6-8 ans et la réalisation d’IRM cérébrale à l’âge de 8-10 ans [1, 2].
L’étude rapportée ci-dessous [3] étudie l’impact possible des composés perfluorés, présents dans notre environnement quotidien de manière quasi ubiquitaire, notamment en tant que surfactants (en particulier antiadhésifs), sur la fonction thyroïdienne de femmes gestantes. Leur longue chaîne polycarbonée les protège de la dégradation, ce qui explique une longue demi-vie, qui varie entre 3 et 8 ans chez l’être humain pour les 2 chefs de fil majoritaires des composés perfluorés que sont le PFOS et le PFOA. La contamination se fait principalement par voie orale (aliments et eau contaminés) ou respiratoire (poussières domestiques). À partir d’une cohorte prospective de naissance (Shangai Birth Cohort) qui a inclus 4 127 femmes enceintes de 6 hôpitaux différents, entre 2013 et 2016, les auteurs ont analysé les données de 1 885 femmes, sans antécédents thyroïdiens, pour lesquelles ils disposaient d’un bilan thyroïdien mesuré par RIA avant 14 semaines de grossesse.
Les femmes avaient un âge médian de 29 ans, étaient primipares pour 85,6 % d’entre elles et avaient un IMC médian de 21,5 kg/m2 en début de grossesse. 12,1 % d’entre elles (n = 223) avaient des stigmates d’auto-immunité thyroïdienne (représentés par la présence d’anticorps anti-TPO au-delà de 60 UI/mL) ; leurs caractéristiques générales n’étaient pas différentes des femmes sans auto-immunité thyroïdienne, sauf pour le taux de TSH qui était significativement plus élevé. Le taux médian de fT4 était de 15,4 pmol/L (12,21-19,82), celui de fT3 de 4,74 pmol/L (3,92-5,88) et celui de TSH de 1,40 mUI/L (0,15-3,76).
Dix composés perfluorés ont été dosés par spectrométrie de masse (HPLC/MS-MS), sur un échantillon sanguin réalisé entre la 9e et la 16e semaine de grossesse. Les 2 composés les plus représentés étaient le PFOA et le PFOS, dont les taux médians respectifs étaient de 12,32 ng/mL (9,47-16) et de 9,25 ng/mL (6,59-13,58).
Les auteurs ont pu mettre en évidence une corrélation non quadratique, en U inversé (figure 1), entre les concentrations de PFOS, de PFOA et les taux circulants de fT3 ( β = 0,179) et de fT4 ( β = 0,121).
Figure 1. Association entre concentrations maternelles en hormones thyroïdiennes et concentrations plasmatiques en composés perfluorés chez des patientes sans (A) ou avec anticorps (B) anti-TPO, après ajustement pour l’âge maternel, l’IMC préconceptionnel, l’âge gestationnel et le niveau socioéconomique.

Ce résultat était significatif, y compris après ajustement multiparamétrique et pour plusieurs nœuds (10e, 50e et 90e percentile). En revanche, cette corrélation n’était pas statistiquement significative pour les patientes ayant des anticorps anti-TPO. Pour expliquer cette observation, les auteurs évoquent une compétition des composés perfluorés avec les hormones thyroïdiennes sur les molécules de transport et/ou une compétition avec l’iodure.
Ce dernier argument est particulièrement intéressant, puisque dans un article de recherche fondamentale, des chercheurs ont évalué l’effet du PFOS et du PFOA sur la capture d’iode par des cellules thyroïdiennes murines FRTL-5 [4]. Ils ont ainsi pu montrer que seul le PFOS était capable d’induire une diminution temps- et concentration-dépendante de la capture d’iode, avec un IC50 de 1,0 µM et une plus faible dose avec effet (LOAEL) de 0,3 µM = 150 ng/mL (p < 0,05) (figure 2). Aux plus fortes doses (100 µM = 50 µg/mL), le PFOS entraîne une inhibition du symporteur sodium/iodure (NIS) quasi complète, de 95 %, identique à celle observée avec le perchlorate de sodium. Le mécanisme d’inhibition du NIS reste peu clair : liaison directe et compétition avec l’iodure ? Encombrement allostérique du NIS ?
Figure 2. Effets du PFOS à différentes concentrations sur la capture et sur la concentration intracellulaire d’iodure de sodium dans des cellules thyroïdiennes murines FRTL-5 in vitro. A : capture de l’iodure de sodium en fonction du temps et de l’exposition à des concentrations croissantes de PFOS. B : concentration intracellulaire en iodure mesurée à t = 20 min en fonction de la dose d’exposition au PFOS. C : capture de l’iodure de sodium en fonction du temps après exposition à 100 µM de PFOS, de PFOA ou de perchlorate de sodium (NaClO4). D : effet de 100 µM de PFOS, de PFOA ou de perchlorate de sodium (NaClO4) sur la concentration intracellulaire en iodure mesurée à t = 20 min.
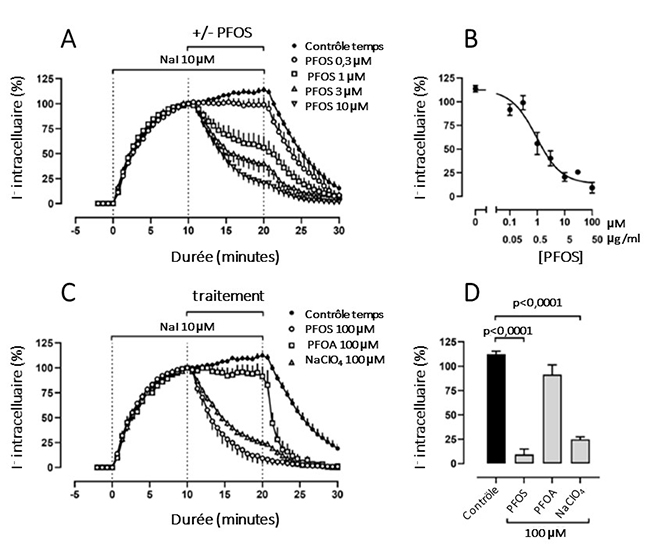
Tous ces éléments sont autant de nouveaux arguments qui démontrent bien que la fonction thyroïdienne est une cible des PE à ne pas méconnaître, non seulement dans les évaluations sanitaires, mais aussi probablement au niveau clinique.
Références bibliographiques
1. Korevaar TIM et al. Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood: a population-based prospective cohort study. Lancet Diabetes Endocrinol 2016;4(1):35-43.
2. Jansen TA et al. Maternal thyroid function during pregnancy and child brain morphology: a time window-specific analysis of a prospective cohort. Lancet Diabetes Endocrinol 2019;7(8):629-37.
3. Aimuzi R et al. Perfluoroalkyl and polyfluroalkyl substances and maternal thyroid hormones in early pregnancy. Environ Pollut 2020;264:114557.
4. Conti A et al. Perfluorooctane sulfonic acid, a persistent organic pollutant, inhibits iodide accumulation by thyroid follicular cells in vitro. Mol Cell Endocrinol 2020;515:110922.
N. Chevalier déclare avoir des liens d’intérêts avec Abbott, AstraZeneca, Eli Lilly, Gilead, Medtronic, Merck, MSD, NovoNordisk, Novartis, Sanofi, SVR.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 Paris– Courriel : webmaster@sfendocrino.org

