Anne Bachelot
Service d’endocrinologie et médecine de la reproduction, IE3M, Centre de référence des maladies endocriniennes rares de la croissance et du développement, Centre de maladies gynécologiques rares, Institute of Cardiometabolism and Nutrition, ICAN, hôpital Pitié-Salpêtrière, Paris
Chers collègues,
Nous avons le plaisir de vous présenter cette nouvelle newsletter Reproduction !
Cette nouvelle version comprend tout d’abord un point sur l’actualité, avec deux résumés d’articles, le premier portant sur les études publiées cette année par des équipes françaises sur l’effet des hormones sexuelles et des traitements hormonaux sur la repolarisation myocardique, le second sur l’étude (difficile) du retentissement des perturbateurs endocriniens sur la fertilité féminine. Elle comprend aussi trois mises au point sur les recommandations récentes : du syndrome des ovaires polykystiques, de la contraception de l’adolescente et du duo thyroïde et grossesse.
En espérant que vous prendrez autant de plaisir à lire cette newsletter que nous en avons eu à l'écrire, nous vous souhaitons de belles fêtes de fin d’année et à très bientôt pour une nouvelle newsletter Reproduction !
Au programme :
Actualités
- « Être ou ne pas naître, ou tenter de comprendre la complexité des perturbateurs endocriniens et de leurs effets néfastes » par Nicolas Chevalier
- « La repolarisation cardiaque, une question de genre ? » par Virginie Grouthier
Mises au point
- « Recommandations internationales 2018 concernant la prise en charge du syndrome des ovaires polykystiques (hors infertilité) : que retenir pour la pratique clinique ? » par Geoffroy Robin
- « Contraception de l’adolescente, recommandations de bonnes pratiques » par Lise Duranteau
- « Que retenir des recommandations américaines ATA 2017 en cas de pathologie thyroïdienne pendant la grossesse ? » par Julie Sarfati
Actualités
Nicolas Chevalier
Département d’endocrinologie-diabétologie, médecine de la reproduction ; Inserm U1065 - C3M - Cellular Basis and Signaling of Tumor Metabolism, CHU de Nice, Hôpital de l’Archet 2.
Le rôle néfaste des perturbateurs endocriniens sur le développement et le fonctionnement des gonades a été bien étudié, tant in vitro qu’in vivo, chez l’animal. Un certain nombre de ces effets sont rapportés également dans l’espèce humaine, notamment concernant le sexe masculin (en particulier le syndrome de dysgénésie testiculaire décrit par N. Skakkebaek [1]). Plus récemment, des données ont été rapportées chez la femme, avec un rôle possible dans le déterminisme du syndrome des ovaires polykystiques (2) mais également d’une hypofertilité plus globale (3, 4). Néanmoins, l’analyse des effets possibles dans l’espèce humaine est rendue très délicate, en particulier du fait de facteurs confondants possibles.
Les composés perfluorés (perfluoroalkyl acids [PFAA]) sont des polluants organiques persistants, principalement utilisés comme retardateurs de flamme et surfactants, qui peuvent s’accumuler dans le tissu adipeux du fait de leur caractère lipophile. Des études ont rapporté qu’une concentration maternelle élevée en PFAA pouvait être responsable d’une augmentation du délai nécessaire pour concevoir (DNC) [5, 6], mais avec des résultats non reproductibles d’une étude à une autre. L’une des explications possibles est que la fécondité et la fécondabilité évoluent dans le temps et sont directement corrélées à l’âge, l’indice de masse corporelle ou le tabagisme par exemple, ce qui en fait des facteurs confondants potentiels. Par ailleurs, on sait maintenant que les concentrations de PFAA diminuent pendant la grossesse et pendant l’allaitement, par passage transplacentaire et dans le lait maternel (contaminant ainsi le fœtus et le nourrisson), et qu’elles peuvent ensuite réaugmenter compte tenu de leur présence dans notre environnement domestique. La concentration mesurée au début d’une étude n’est donc pas forcément celle qui sera néfaste, ou du moins corrélée à la survenue d’une grossesse ou non.
L’équipe danoise de C. Bach et de T. Henriksen appartient au vaste programme FETOTOX, qui comprend 5 grandes cohortes de naissances du nord de l’Europe. L’objectif de ces cohortes est de déterminer les relations possibles entre une exposition prénatale à des polluants organiques persistants et la survenue de pathologies dans la descendance, parmi lesquelles des troubles du développement neurocognitif (autisme, troubles déficitaires de l’attention) et de la fécondité ultérieure. À partir de l’une de ces 5 cohortes de naissances, les auteurs ont tenté de modéliser la toxicocinétique des PFAA chez une femme en âge de procréer (figure 1), mettant ainsi en évidence tous les facteurs confondants possibles à prendre en compte dans l’interprétation des données épidémiologiques (7).
Figure 1. Modélisation des facteurs confondants à considérer dans l’interprétation des données épidémiologiques concernant l’influence d’une exposition aux composés perfluorés (PFAA) durant la grossesse. La concentration initiale diminue pendant la grossesse et l’allaitement, ce qui conditionne une nouvelle concentration, elle-même soumise à des facteurs de modulation à prendre en compte pour l’analyse statistique (adapté de Carlsen Bach C et al. [7]).

Dans leur cohorte incluant 1251 patientes, 75 % des femmes avaient des taux détectables de PFAA en début de grossesse (entre 7 et 10 semaines d’aménorrhée), les congénères les plus représentés étaient le PFOA (acide perfluorooctanoïque) et le PFOS (sulfonate de perfluorooctane). Parmi les nullipares (n = 638), il n’a pas été mis en évidence de corrélation entre les taux mesurés de PFAA et le DNC, quel que soit le congénère considéré. En revanche, chez les femmes ayant déjà accouché (n = 613), il existait une association entre les taux de PFAA mesurés en début de nouvelle grossesse et le DNC, et ce, tout particulièrement pour le PFOA et le PFOS, avec des DNC pouvant atteindre parfois 5 ans (diminution respective de 21 et de 31% de la fécondité pour les quartiles les plus élevés). Néanmoins, cette corrélation reste faible (rs = 0,18). En se basant sur leur modélisation, les auteurs ont considéré que, puisqu’il n’y avait pas de résultats significatifs entre les taux préconceptionnels et le DNC, mais qu’il existait au contraire une corrélation entre taux préconceptionnels et DNC pour les patientes ayant déjà accouché, il ne pouvait pas exister de lien de causalité directe entre une exposition aux PFAA et le DNC.
Ils ont donc étudié l’évolution des concentrations de PFAA entre le moment du premier accouchement et la grossesse suivante. Ils ont ainsi pu mettre en évidence qu’après une diminution des taux maternels de PFAA durant la grossesse et la lactation, il existait une réaugmentation de ces taux au bout de 2 ans, pouvant parfois dépasser les taux initiaux (figure 2). Les taux sont d’autant plus élevés que le délai entre 2 grossesses est allongé, avec une corrélation plus robuste (rs = 0,32).
Figure 2. Évolution des taux maternels de différents composés perfluorés (PFAA) chez 604 patientes entre leur premier accouchement et la grossesse suivante. Données issues de la Danish National Birth Cohort 1996-2002, adapté de Carlsen Bach C et al. (7).
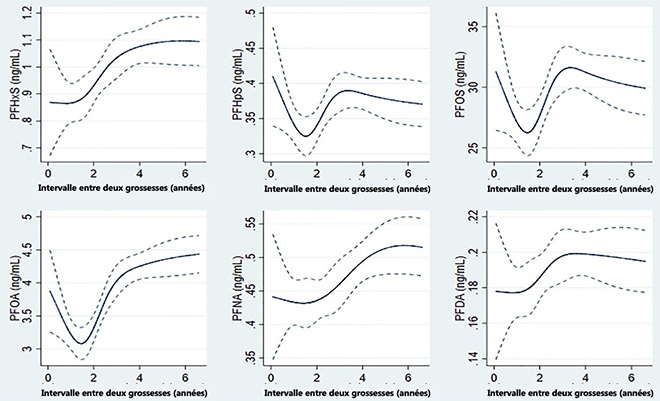
Idéalement, pour déterminer le rôle des perturbateurs endocriniens sur la fertilité féminine, il faudrait donc s’adresser à des cohortes de nullipares, ce qui n’est pas possible et également source de biais. Il faut donc être prudent sur l’interprétation des résultats épidémiologiques et, surtout, essayer de considérer l’intervalle entre les grossesses pour valider la pertinence de chaque résultat observé. Voilà de quoi probablement semer encore plus de doutes et de troubles parmi les réfractaires, mais cela semble la seule voie pour fournir des données pragmatiques.
Références bibliographiques
1. Skakkebaek NE, Rajpert-De Meyts E, Main KM. Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects. Hum Reprod 2001;16(5):972-8.
2. Rutkowska AZ, Diamanti-Kandarakis E. Polycystic ovary syndrome and environmental toxins. Fertil Steril 2016;106(4):948-58.
3. Du YY, Guo N, Wang YX et al. Urinary phthalate metabolites in relation to serum anti-Mullerian hormone and inhibin B levels among women from a fertility center: a retrospective analysis. Reprod Health 2018;15(1):33.
4. Karwacka A, Zamkowska D, Radwan M, Jurewicz J. Exposure to modern, widespread environmental endocrine disrupting chemicals and their effect on the reproductive potential of women: an overview of current epidemiological evidence. Hum Fertil (Camb) 2017:1-24.
5. Bach CC, Bech BH, Nohr EA et al. Serum perfluoroalkyl acids and time to pregnancy in nulliparous women. Environ Res 2015;142:535-41.
6. Bach CC, Vested A, Jorgensen KT et al. Perfluoroalkyl and polyfluoroalkyl substances and measures of human fertility: a systematic review. Crit Rev Toxicol 2016;46(9):735-55.
7. Carlsen Bach C, Bjerregard Matthiesen N, Olsen J, Brink Henriksen T. Conditioning on Parity in Studies of Perfluoroalkyl Acids and Time to Pregnancy: An Example from the Danish National Birth Cohort. Environ Health Perspect 2018;126(11):117003.
L’auteur déclare ne pas avoir de liens d’intérêts.
Virginie Grouthier 1 ; Joe-Elie Salem 2 ; Anne Bachelot 1
1 Service d’endocrinologie et médecine de la reproduction, Centre de référence des maladies endocriniennes rares de la croissance, Centre de référence des pathologies gynécologiques rares hôpital Pitié-Salpêtrière, AP-HP ; université Paris Sorbonne, Paris.
2 Service de pharmacologie, CIC-1421, unité de pharmacovigilance, hôpital Pitié-Salpêtrière, AP-HP ; INSERM, UMR ICAN 1166 ; université Paris Sorbonne, Paris.
La repolarisation ventriculaire, mesurée par la durée de l’intervalle QT corrigée par la fréquence cardiaque (QTc), est influencée par les hormones sexuelles. Un QTc au-delà de 460 ms prédispose au risque de torsades de pointes (TdP) ; des arythmies ventriculaires pouvant conduire à la mort subite.
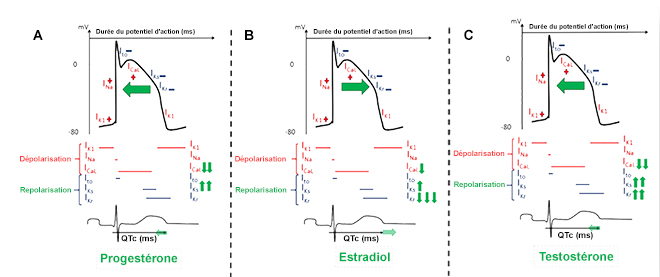
De la puberté à la ménopause, le QTc est plus long chez les femmes que chez les hommes (~10-15 ms de différence), et il varie chez la femme en fonction du cycle menstruel (~5-10 ms). Cela explique le risque augmenté de TdP chez les femmes par rapport aux hommes. Ce risque est maximal chez les femmes pendant la phase folliculaire par rapport à la phase lutéale. Nous avons récemment montré que l'estradiol détermine un allongement du QTc, et la progestérone comme la testostérone son raccourcissement (Figure 1) [1-3].
Figure 1. Influence de différentes hormones stéroïdiennes sur les courants ioniques, le potentiel d’action ventriculaire et la durée de l’intervalle QTc : progestérone (A), estradiol (B) et testostérone (C) [d’après (1)].
Face à ces observations, 2 situations cliniques chez la femme nous ont particulièrement intéressés pour évaluer l’effet des traitements hormonaux sur la durée du QTc et donc le risque potentiel de TdP : la prise de contraception estroprogestative en fonction du pouvoir plus ou moins androgénique du progestatif, et le traitement hormonal anti-estrogénique dans le contexte de cancer du sein.
La première étude est une analyse ancillaire de l’étude de cohorte prospective (GENEREPOL), dont l’objectif principal était la recherche de polymorphisme génétique associé à un allongement du QTc chez des sujets recevant une dose de 80 mg de sotalol (médicament induisant un allongement du QTc et donc présentant un risque connu de TdP induite). Quatre cent six femmes non ménopausées en bonne santé, prenant ou non une contraception orale (CO) combinée estroprogestative, ont été incluses (4). Les CO étudiées contenaient du lévonorgestrel (LNG) [qui a un pouvoir androgénique], prises par 137 femmes de la cohorte, ou de la drospirénone (qui a des propriétés anti-androgéniques) prises par 62 femmes. Deux cent sept femmes ne prenaient aucune CO et étaient considérées comme groupe témoin. Il n’y avait pas de différence significative de la durée du QTc au temps basal entre ces groupes. Cependant, 3 heures après l’injection de sotalol, l’allongement du QTc-L était plus important chez les femmes sous drospirénone (allongement de 31,2 ± 12,6 ms par rapport au temps basal) que chez les femmes sans COP (allongement de 24,6 ± 12,5 ms ; p = 0,005) ou chez celles sous LNG (allongement de 24,2 ± 13,7 ms ; p = 0,005). Ces résultats concordent avec ceux retrouvés dans une étude de disproportionnalité à partir de la base de pharmacovigilance européenne qui rapporte les effets indésirables des CO avec drospirénone et LNG. La drospirénone était associée à un allongement du QTc et à un taux plus élevé d’arythmies ventriculaires par rapport au LNG (respectivement OR = 6,2 [IC95 : 1,3-30,8] ; p = 0,01 et OR = 3,3 [IC95 : 1,7-6,3] ; p < 0,001). Au total, la drospirénone, CO aux propriétés anti-androgéniques, était associée à un allongement significatif du QTc contrairement au LNG, CO aux propriétés plus androgéniques.
La deuxième étude a porté sur les modulateurs sélectifs des récepteurs aux estrogènes (SERM), qui ont des propriétés estrogéniques (au niveau cardiaque) et anti-estrogéniques tissu-dépendant, et sur les anti-aromatases (AA), qui inhibent l’aromatisation de testostérone en estrogènes, entrainant donc une diminution du taux d’estradiol. Les effets de ces 2 classes médicamenteuses sur le risque de QTc-L et de TdP sont inconnus. Nous avons réalisé une autre étude de disproportionnalité à partir de la base de pharmacovigilance européenne qui collige les effets indésirables des SERM (tamoxifène et torémifène) et AA (anastrozole, exémestane et létrozole), afin d’évaluer le rapport des cotes (OR) de QTc-L, de TdP et d’arythmie ventriculaire associé à ces 2 classes médicamenteuses (5). Les SERM étaient associés à un taux plus élevé de QTc-L comparés aux AA (26/8318 versus 11/14851, OR = 4,2 [IC95 : 2,11-8,55] ; p < 0,001). Ils étaient également associés à un taux plus élevé de TdP et d’arythmies ventriculaires comparativement aux AA (respectivement 6/8318 versus 2/14851, OR= 5,4 [IC95 : 1,29-26,15] ; p = 0,02 ; 16/8318 versus 12/14851, OR = 2,38 [IC95 : 1,15-4,94] ; p = 0,02). La situation s’améliorait avec la normalisation du QTc une fois ces médicaments arrêtés. Cependant, même si ces cas sont rares, ils sont graves, la mortalité étant de 38 % chez les patients présentant des arythmies ventriculaires sous SERM. L'influence du tamoxifène sur la repolarisation ventriculaire a été étudiée dans plusieurs modèles animaux. Les données ont principalement montré une inhibition d’un canal potassique cardiaque (IKr), mécanisme également impliqué dans les LQT induits par l'œstradiol et par la plupart des médicaments déjà connus comme étant allongeurs du QTc (6). Il existe à ce jour peu d’études expliquant l’effet des anti-aromatases sur le repolarisation cardiaque. Kurokawa et al. ont récemment montré que l’ablation de taux circulants d’estradiol chez des souris knock-out à l’aromatase atténuait l’effet allongeur du QTc de E-4031, un inhibiteur de l’IKr (7). De plus, il a été prouvé que l'anastrozole à fortes doses conduit à un raccourcissement de l'intervalle QT chez le chien. Ainsi, en accord avec leurs propriétés estrogéniques sur le tissu cardiaque, les SERM semblent donc associés à un taux plus élevé de QTc-L, de TdP et d’arythmies ventriculaires comparés aux AA.
Figure 2. Schéma synthétisant l’effet des modulateurs sélectifs des récepteurs aux estrogènes (SERM) allongeant le QTc et l’effet des anti-aromatases raccourcissant le QTc (d’après [5]).
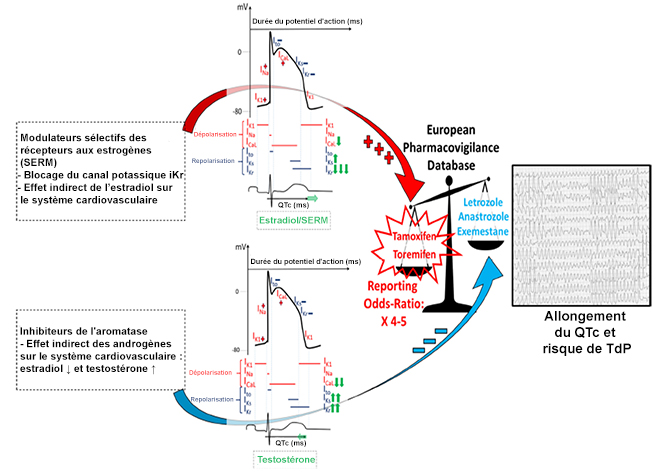
En conclusion, même si les effets sur la repolarisation cardiaque de ces traitements hormonaux restent minimes sur le plan clinique, une attention cardiologique particulière devrait être portée chez ces patientes, en particulier s’ils sont associés à d’autres traitements ou maladies ayant un effet d’allongement du QTc.
Références bibliographiques
1. Salem JE, Alexandre J, Bachelot A, Funck-Brentano C. Influence of steroid hormones on ventricular repolarization. Pharmacol Ther 2016;167:38-47.
2. Abehsira G, Bachelot A, Badilini F et al. Complex influence of gonadotropins and sex steroid hormones on QT interval duration. J Clin Endocrinol Metab 2016;101:2776-84.
3. Salem JE, Waintraub X , Courtillot C et al. Hypogonadismas a reversible cause of torsades de pointes in men. Circulation 2018;138:110-3.
4. Salem JE, Dureau P, Bachelot A et al. Association of oral contraceptives with drug-induced QT interval prolongation in healthy non menopausal women. JAMA Cardiol 2018;3:877-82.
5. Grouthier V, Lebrun-Vignes B, Glazer AM et al. Increased long QT and torsade de pointes reporting on tamoxifen compared with aromatase inhibitors. Heart 2018;104:1859-63.
6. He J, Kargacin ME, Kargacin GJ, Ward CA. Tamoxifen inhibits Na+ and K+ currents in rat ventricular myocytes. Am J Physiol Heart Circ Physiol 2003;285:H661-8.
7. Kurokawa J, Sasano T, Kodama M et al. Aromatase knockout mice reveal an impact of estrogen on drug-induced alternation of murine electrocardiography parameters. J Toxicol Sci 2015;40:339-48.
Mises au point
Geoffroy Robin
Service de gynécologie médicale, orthogénie et sexologie et service d’assistance médicale à la procréation et préservation de la fertilité, hôpital Jeanne-de-Flandre, CHU de Lille.
Lors du congrès de l’European Society of Human Reproduction and Embryology (ESHRE) en juillet 2018, les dernières recommandations internationales concernant le diagnostic et le suivi des patientes atteintes d’un syndrome des ovaires polykystiques (SOPK) ont été présentées. L’objectif de cet article est de résumer les principaux points concernant ces recommandations.
L’application des critères diagnostiques de Rotterdam est conservée sur le principe, avec quelques nouvelles nuances. Deux des 3 critères suivants doivent être présents :
- trouble de la fonction ovulatoire, dont le maître symptôme est le trouble du cycle ;
- hyperandrogénie clinique et/ou biologique ;
- présence d’un OPK échographique.
Le diagnostic de SOPK doit rester un diagnostic d’exclusion. Ainsi, ces critères ne sont applicables qu’après avoir éliminé toutes les autres causes de dysovulation/anovulation et d’hyperandrogénie.
Une des premières nouveautés de ces recommandations internationales est d’avoir acté officiellement le fait qu’un OPK échographique se définit par un volume ovarien ≥ 10 ml et/ou la présence d’au moins 20 follicules antraux par ovaire (le seuil était fixé à 12 dans les critères diagnostiques de Rotterdam en 2003). Le seuil de 20 follicules par ovaire n’est applicable que si l’échographie est réalisée par voie endovaginale et si la fréquence de la sonde endocavitaire est ≥ 8 MHz. Cette dernière recommandation est essentielle, car – comme cela est défendu par de nombreux experts depuis maintenant plusieurs années – c’est la performance (et donc la fréquence) des sondes qui doit aider un opérateur à déterminer le seuil du nombre de follicules par ovaire afin de déterminer si un ovaire est polykystique ou non.
L’autre élément notable concerne l’appréciation de l’hyperandrogénie biologique. Celle-ci est surtout pertinente pour le diagnostic de SOPK lorsque les signes d’hyperandrogénie clinique sont discrets voire absents. Alors que dans le consensus de Rotterdam, il était recommandé de doser la testostérone totale, il est désormais plutôt privilégier le calcul de la testostérone libre et/ou biodisponible (à partir de la testostérone totale et de la SHBG [sex hormone-binding globulin]) et/ou l’index de testostérone libre, éventuellement en complément de la testostérone totale. Pour les dosages directs de testostérone totale, seules les méthodes très performantes comme la LCMS (chromatographie en phase liquide – spectrométrie de masse) ou les dosages par méthodes immunologiques couplés à une extraction/chromatographie sont recommandées. Les autres méthodes présentant des coefficients de variation médiocres et une mauvaise reproductibilité dans les valeurs basses de testostérone ne devraient plus être utilisées dans l’exploration des hyperandrogénies féminines. Les dosages d’androstènedione et de sulfate de déhydroépiandrostérone (DHEAS) ne sont utiles que dans les situations où la testostéronémie est normale.
Le dosage de l’hormone antimüllérienne (AMH) plasmatique est fortement corrélé au comptage des follicules antraux. Ce dosage peut être utile lorsque l’échographie pelvienne est peu contributive. Il peut être considéré par certains auteurs comme un équivalent du comptage folliculaire. De plus, l’élévation des taux plasmatiques d’AMH constatée chez les patientes souffrant de SOPK serait le reflet d’une certaine “dysfonction” de la granulosa impliquée dans le trouble de la folliculogenèse observé dans cette maladie ovarienne. Les experts considèrent aujourd’hui que la performance diagnostique des différentes techniques de dosage est encore trop hétérogène, et aucun seuil consensuel n’est donc pour l’instant validé sur le plan international. C’est pourquoi, le dosage de l’AMH n’est pas recommandé en première intention dans un bilan initial de trouble du cycle et/ou d’hyperandrogénie. La généralisation des dosages automatisés, qui sont davantage reproductibles, permettra peut-être un jour d’utiliser ce marqueur biologique dans le diagnostic du SOPK.
Les troubles métaboliques et les pathologies cardiovasculaires sont des complications assez fréquentes chez les patientes présentant un SOPK. Plusieurs recommandations importantes ont été présentées à ce sujet :
- importance de la surveillance pondérale au cours du suivi sur le long terme ;
- nécessité de dépister et – lorsque cela est possible – de lutter contre les autres facteurs de risque vasculaires ;
- en dehors du contexte de désir de grossesse, il est recommandé de dépister une intolérance aux hydrates de carbone ou un diabète de type 2 chez toute femme ayant un SOPK avéré :
- soit en réalisant une glycémie à jeun si l’IMC est inférieur à 25 kg/m2,
- soit en réalisant une HPO à 75 g de glucose si l’IMC est supérieur à 25 kg/m2, si la patiente présente une HTA (même traitée) ou s’il existe des antécédents personnels de diabète gestationnel ou familiaux de type 2 ;
- en cas de surpoids ou d’obésité, une perte pondérale d’au moins 5 à 10 % du poids initial sur une durée de 6 mois permet d’améliorer un certain nombre de manifestations cliniques du SOPK (hyperandrogénie clinique, irrégularités menstruelles).
Le risque de diabète gestationnel est augmenté chez les patientes souffrant d’un SOPK. Un dépistage ciblé et rigoureux est vivement recommandé par le groupe d’experts internationaux. Un dépistage préconceptionnel par une HPO à 75 g de glucose devrait être proposé chez toute patiente présentant un SOPK. Si cet examen n’a pas pu être pratiqué avant la grossesse, il devrait idéalement être réalisé au cours de celle-ci (avant 20 semaines de grossesse et entre 24 et 28 semaines de grossesse).
La plupart des méta-analyses confirment que les patientes atteintes de SOPK ont 2 à 6 fois plus de risque de présenter une cancer endométrial que les femmes non SOPK : un dépistage par échographie pelvienne (± biopsie d’endomètre) est donc recommandé chez les patientes SOPK ou ex-SOPK en surpoids (car le surpoids et, a fortiori, l’obésité sont des facteurs de risque indépendants de cancer de l’endomètre), qui ont présenté des épisodes prolongés d’aménorrhée et/ou qui ont des problématiques de méno- et/ou métrorragies. Chez les patientes présentant des troubles du cycle sévères (oligospanioménorrhée voire aménorrhée), l’utilisation des contraceptions estroprogestatives ou des progestatifs serait en théorie une approche séduisante pour limiter le risque de cancer endométrial. En effet, l’effet protecteur des contraceptions hormonales sur le risque de développer ce type de cancer a été démontré en population générale. Néanmoins, il n’existe pas d’études spécifiques sur ce sujet concernant les patientes atteintes de SOPK.
Concernant la prise en charge spécifique des troubles du cycle et des signes d’hyperandrogénie, il est bien mis en exergue par le groupe d’experts que la contraception estroprogestative devrait être le traitement de première intention. En l’absence de contre-indications – en particulier vasculaires et métaboliques volontiers plus fréquentes chez ces patientes – la contraception estroprogestative présenterait une balance bénéfice-risque particulièrement favorable ayant de nombreux effets positifs extracontraceptifs : efficacité sur l’acné, sur l’hirsutisme minime à modéré, prévention des épisodes d’hyperménorrhée voire de ménorragies (10 à 30 % des femmes atteintes de SOPK décrivent des ménorragies), prévention du risque d’hyperplasie endométriale et de cancer de l’endomètre...
Les anti-androgènes (en France : l’acétate de cyprotérone “macrodosé” [25 à 50 mg] ou la spironolactone) peuvent être proposés en cas de contre-indication aux estroprogestatifs ou d’efficacité insuffisante de ces derniers sur les signes d’hyperandrogénie. En France, depuis septembre 2018, l’acétate de cyprotérone fait l’objet d’une surveillance particulière des autorités de santé, avec des recommandations très strictes encadrant la prescription de ce traitement et la surveillance. En effet, d’après les données préliminaires d’une étude française (à ce jour non publiée), l’utilisation prolongée de ce progestatif à des doses d’au moins 25 mg/j serait associée à une augmentation du risque de développer des méningiomes. Ainsi, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) exige une information claire suivie de la signature d’un consentement par la patiente et le prescripteur. Une IRM cérébrale doit être pratiquée avant l’instauration du traitement, puis après 5 ans d’utilisation. Si le traitement est poursuivi au-delà de 5 ans, des IRM cérébrales devront être réalisées tous les 2 ans. Rappelons néanmoins que l’incidence des méningiomes dans la population générale est de 8/100 000 femmes-années.
L’utilisation de la metformine ne doit être proposée qu’en complément des mesures hygiénodiététiques chez toute femme dont l’IMC est supérieur à 25 kg/m2 présentant un SOPK. Dans ce contexte, la metformine a fait la preuve de son efficacité dans la prévention mais surtout dans la prise en charge des troubles métaboliques associés. Cette recommandation est encore plus forte lorsqu’une intolérance aux hydrates de carbone ou un diabète de type 2 ont été diagnostiqués. L’augmentation progressive des doses (de 500 mg en 500 mg) par palier de 7 à 14 jours permet d’améliorer la tolérance clinique de ce traitement. Aucune dose minimale efficace de metformine dans cette indication n’est mentionnée dans ce consensus. Les experts rappellent que, dans la majeure partie des pays du monde, la metformine n’a pas d’indication officielle dans la prise en charge des patientes atteintes de SOPK éligibles à un tel traitement (en dehors de celles qui présentent un diabète de type 2). Cet élément doit impérativement être mentionné aux patientes à qui l’on souhaite prescrire ce traitement.
Le résumé de ces nouvelles recommandations n’est bien entendu pas exhaustif. Le texte intégral de ces recommandations est disponible dans les revues suivantes :
- Teede HJ, Misso ML, Costello MF et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Hum Reprod 2018;33(9):1602-18.
- Teede HJ, Misso ML, Costello MF et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril 2018;110(3):364-79.
- Teede HJ, Misso ML, Costello MF et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Clin Endocrinol (Oxf) 2018;89(3):251-68.
Ainsi, il faut espérer que la publication de ces recommandations internationales, fondées sur les données actualisées de l’Evidence-Based Medicine mais aussi sur l’expérience des plus grands experts de cette pathologie, permettra enfin d’uniformiser au niveau mondial la prise en charge diagnostique et thérapeutique d’une pathologie gynéco-endocrinienne très fréquente. Optimiser la prise en charge des femmes souffrant de SOPK, c’est également optimiser leur qualité de vie !
L’auteur déclare ne pas avoir de liens d’intérêts en rapport avec les données publiées dans cet article.
Lise Duranteau
Unité de gynécologie adolescente et jeune adulte, hôpital Bicêtre, hôpitaux universitaires Paris Sud, Le Kremlin-Bicêtre.
La contraception chez l’adolescente représente un enjeu de santé publique. Des recommandations de bonnes pratiques ont été émises en 2018 par la Haute Autorité de santé et le Collège national des gynécologues et obstétriciens français (CNGOF) [1, 2]. Nous souhaitons rappeler ici quelques principes essentiels et rapporter les stratégies de contraception dans la population adolescente.
Chez les adolescentes, les méthodes contraceptives les plus efficaces, que sont la contraception hormonale et le dispositif intra-utérin (DIU), sont à privilégier. Elles doivent toujours être associées à l’utilisation du préservatif.
La contraception hormonale est la principale méthode utilisée, et il est important de connaître les spécificités d’efficacité et de tolérance dans cette population. En l’absence de contre-indication cardiovasculaire, en particulier de risque de maladie thromboembolique veineuse, la contraception estroprogestative représente la méthode de première intention. Les associations contenant un progestatif de 2e génération sont à privilégier pour leur moindre risque vasculaire, notamment dans le cadre de la primo-prescription. La tolérance est excellente, et son utilisation est associée à des bénéfices qui favorisent l’acceptabilité. En effet, la réduction significative de la dysménorrhée, de l’abondance des règles, le bon contrôle du cycle et l’efficacité sur l’hyperandrogénie ont un impact positif sur la qualité de vie des adolescentes. La contraception microprogestative peut également permettre de réduire la dysménorrhée, en particulier en cas d’aménorrhée ; mais son efficacité est dépendante d’une observance scrupuleuse et de l’absence de potentielles interactions médicamenteuses. Elle est néanmoins la méthode de recours en cas de thrombophilie, d’obésité sévère, de dyslipidémie, d’hypertension artérielle, d’antécédents de migraine avec aura.
Il est actuellement suggéré de proposer aux adolescentes une méthode de contraception réversible de longue durée d’action (Long-Acting Reversible Contraceptive [LARC]), dont l’efficacité est supérieure aux contraceptions de courte durée d’action car indépendante de l’observance (3). Les LARC sont représentées par l’implant progestatif, le DIU au cuivre et le DIU au progestatif (la contraception progestative injectable est aussi une méthode de type LARC mais, en raison de sa mauvaise tolérance et de ses effets indésirables, elle est peu indiquée en contraception régulière). Une plus large utilisation des méthodes de type LARC pourrait entraîner une réduction des grossesses non désirées dans la population adolescente. L’étude CHOICE réalisée aux États-Unis a bien montré que l’utilisation des méthodes indépendantes de l’observance chez les adolescentes était associée non seulement à une réduction significative du nombre de grossesses non désirées mais également à une augmentation de la poursuite de la méthode contraceptive après 1 an d’utilisation, comparativement aux méthodes de courte durée d’action (tableau) [3, 4]. En France, même si le nombre d’IVG chez les mineures (environ 8/1 000 chez les 15-17 ans) diminue, le but est de continuer à réduire ce chiffre, qui est en outre 2 fois plus élevé dans les territoires d’outre-mer (14 à 18/1 000) [5]. En France, l’utilisation des LARC reste encore peu répandue. Les raisons du faible recours à ces contraceptions seraient une moindre connaissance de ces méthodes par les praticiens et leur crainte à les utiliser chez les adolescentes, notamment le DIU, en raison de la nulliparité. La mise en place de ces méthodes ne nécessite pas de conditions particulières mais est réalisée de préférence par un praticien expérimenté. Il faut également informer les adolescentes des possibles troubles du cycle pour éviter l’arrêt prématuré de la méthode.
La consultation de contraception chez l’adolescente doit également permettre de :
- éduquer sur l’intérêt d’une double protection afin de prévenir contre les infections sexuellement transmissibles et de la possibilité de dépistages gratuits ;
- adapter la contraception chez celles qui ont une maladie chronique ou un handicap ;
- dépister d’éventuelles situations de maltraitance.
Les dispositions législatives de 2016 permettent d’améliorer l’accès à la contraception grâce à la gratuité des contraceptifs, des consultations et des actes de biologie pour les mineures de moins de 15 ans. L’ensemble du parcours est protégé par la confidentialité. Les soignants mais aussi les éducateurs au contact des adolescentes doivent être sensibilisés à ces dispositifs.
Tableau. Méthodes de contraception progestative de longue durée d’action disponibles en France : efficacité, durée d’action et taux de poursuite de la méthode (d’après[4]).
Type de méthode |
DIU au cuivre |
DIU au progestatif |
Implant progestatif |
Efficacité |
0,5-0,8 % |
0,1-0,2 % |
< 1 % |
Durée d’efficacité (ans) |
5 à 10 |
3 (13,5 mg) |
3 |
Taux de poursuite de la méthode |
86 % |
88 % |
75-83 % |
| Particularités de la consultation et de la prescription de la contraception chez l’adolescente
|
Références bibliographiques
1. Haute Autorité de santé. Fiche Mémo « Contraception chez l’adolescente ». Juillet 2013, mise à jour mars 2018.
2. Pienkowski C, Cartault A. Contraception for adolescent: CNGOF Contraception guidelines. Gynecol Obstet Fertil Senol 2018 [Epub ahead of print].
3. Winner B, Peipert JF, Zhao Q et al. Effectiveness of long-acting reversible contraception. N Engl J Med 2012;366(21):1998-2007.
4. Diedrich JT, Klein DA, Peipert JF. Long-acting reversible contraception in adolescents: a systematic review and meta-analysis. Am J Obstet Gynecol. 2017;216:364e1-e12.
5. Annick Vilain, avec la collaboration de Sylvie Rey (DREES). 216 700 interruptions volontaires de grossesse en 2017. Études et Résultats, n° 1081, Drees, septembre 2018.
L’auteur déclare ne pas avoir de liens d’intérêts.
Julie Sarfati
Service endocrinologie, diabétologie et endocrinologie de la reproduction, hôpital Saint-Antoine, Paris.
La grossesse a un impact majeur sur la thyroïde. Au cours de la grossesse, le volume de la thyroïde s’accroît (de 10 à 40 % selon les pays), et la production d’hormones thyroïdiennes augmente. L’hypothyroïdie gestationnelle est associée à de multiples complications obstétricales, allant de l’augmentation des fausses couches prématurées à la diminution du QI dans l’enfance. Cette association est linéaire, ainsi plus la thyréostimuline (TSH) est élevée, plus les risques pour la grossesse augmentent. Ces risques sont amplifiés par la présence concomitante d’une auto-immunité thyroïdienne. L’un des points forts des recommandations publiées par l’American Thyroid Association (ATA) en 2017 est la proposition de nouvelle norme de TSH de la grossesse (1).
Physiologiquement, la TSH s’abaisse pendant la grossesse. Depuis plusieurs années, nous utilisons une limite supérieure de TSH à 2,5 mUI/l au cours du 1er trimestre de grossesse et à 3 mUI/l aux 2e et 3e trimestres basée sur les recommandations de l’ATA de 2011 et celles de l’European Thyroid Association (ETA) de 2014. Cependant, des études plus récentes, incluant de grandes cohortes de femmes, ont montré que ces limites étaient potentiellement trop basses, associées à un risque de surdiagnostic et de traitement inutile. En effet, avec ces limites, certaines études ont retrouvé jusqu’à 28 % de femmes enceintes présentant des taux de TSH pathologiques. L’idéal serait d’avoir des normes établies pour chaque trimestre de grossesse et adaptées à nos populations. En l’absence de telles normes, une limite de TSH à 4 mUI/l est proposée pour tous les trimestres de grossesse chez les femmes enceintes n’ayant pas d’auto-immunité thyroïdienne. En présence d’une auto-immunité thyroïdienne, la limite est de 2,5 mUI/l. En effet, des études observationnelles ont montré un risque plus élevé de fausses couches et d’accouchement prématuré chez des patientes TPO+ ayant une TSH supérieure à 2,5 mUI/l.
De plus, malgré de faibles preuves, il est largement recommandé de mettre en route une supplémentation en hormones thyroïdiennes pendant la grossesse en présence d’une hypothyroïdie infraclinique. Des études, plus récentes que les recommandations de l’ATA, n’ont pas mis en évidence d’effet bénéfique d’un traitement par lévothyroxine chez des patientes TPO+ tant que la TSH reste inférieure à 4 mUI/l. De même, une méta-analyse reposant sur 3 études randomisées n’a pas montré de bénéfice du traitement de l’hypothyroïdie infraclinique, tant sur les complications obstétricales et néonatales que sur le développement cognitif de l’enfant. Il est possible que cela soit en lien avec le début tardif du traitement ; 2 essais (T4life et TABLET) actuellement en cours évaluent l’effet d’un traitement en prégrossesse.
La difficulté de démontrer une efficacité du traitement de l’hypothyroïdie infraclinique est l’élément clé de l’absence de proposition de dépistage universel. En effet, la maladie est fréquente, le dépistage simple, mais il n’a de sens que s’il engendre un traitement efficace. Un dépistage ciblé est donc proposé (la cible est large : âge > 30 ans, signes cliniques de dysthyroïdie, goitre, antécédents thyroïdiens personnels ou familiaux, autre auto-immunité, IMC > 40 kg/m2).
En présence d’anticorps, le risque d’augmentation du taux de TSH en cours de grossesse est de l’ordre de 20 %. Ainsi, une surveillance mensuelle de la TSH est recommandée jusqu’au 5e mois de grossesse.
Dans le cas de procédure d’assistance médicale à la procréation, au moment de la rédaction des recommandations, les preuves d’amélioration du devenir médical des femmes euthyroïdiennes TPO+ étaient limitées. Cependant, un traitement peut être recommandé en mettant en balance son effet bénéfique potentiel versus les risques minimes de celui-ci.
Concernant l’hyperthyroïdie, comme dans les recommandations de l’Endocrine Society, si un traitement est nécessaire, celui-ci sera préférentiellement du propylthiouracile au 1er trimestre puis du méthimazole (carbimazole en France) dans la suite de la grossesse, afin d’éviter les cas d’insuffisance hépatique.
La prise en charge des nodules et cancer de la thyroïde doit être personnalisée selon la taille et l’évolutivité du nodule, la présence d’adénopathies, l’agressivité cytologique. La chirurgie peut être différée ou considérée.
Seule une minorité de ces recommandations repose sur un grand niveau de preuve. On aimerait avoir ainsi des études prospectives, randomisées, évaluant la supplémentation iodée, la prise de lévothyroxine très précocement au cours la grossesse, le traitement des femmes euthyroïdiennes TPO+, etc. On aimerait également mieux comprendre la mécanistique qui lie infertilité et fausses couches à l’auto-immunité thyroïdienne.
Référence bibliographique
1. Alexander EK, Pearce EN, Brent GA et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27:315-89.
L’auteur déclare ne pas avoir de liens d’intérêts.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 Paris– Courriel : webmaster@sfendocrino.org
