Olivier Chabre, Justine Cristante
Service d'endocrinologie, CHU Grenoble-Alpes
Chers passionnés des maladies de la surrénale,
Dans cette newsletter, nous aborderons différents articles récents qui montrent tous la place centrale de l’insuffisance surrénale dans la prise en charge des pathologies surrénaliennes.
En effet, vous verrez que l’on n’y parle pas “que” d’insuffisance surrénale, mais également d’hyperaldostéronisme primaire, d’hyperplasie surrénalienne macronodulaire bilatérale, de phéochromocytome, et même de traitement du cancer thyroïdien. C’est donc simple : si la surrénale vous intéresse, la Newsletter surrénale n° 10 est pour vous.
Tout d’abord, vous trouverez 2 articles qui témoignent d’une extension du domaine de l’insuffisance surrénale (ou plutôt de la possibilité d’une insuffisance surrénale), à évoquer chez des patients traités par antityrosine kinase ou pour hyperaldostéronisme primaire.
Puis, vous découvrirez 2 articles sur le rôle de l’insuffisance surrénale dans le choix du traitement chirurgical pour d’autres pathologies surrénaliennes : l’hyperplasie surrénalienne macronodulaire bilatérale et les phéochromocytomes bilatéraux.
Sur le plan diagnostique, nous évoquerons une révolution potentielle dans l’utilisation d’un test fétiche des endocrinologues : le test au Synacthène®.
Et enfin, sur le plan thérapeutique, place aux patients qui ont la difficile tâche d’ajuster leur traitement eux-mêmes, au jour le jour.
Bonne lecture !
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Actualités
Olivier Chabre, Justine Cristante
Service d'endocrinologie, CHU Grenoble-Alpes
Les cancers thyroïdiens réfractaires à l’iode sont par définition des cancers qui ne répondent pas au traitement par l’iode 131. Ils comprennent les cancers développés à partir du thyréocyte (papillaires, vésiculaires, peu différenciés, indifférenciés) ou des cellules C (médullaires). Des molécules à activité antityrosine kinase ont montré une efficacité pour le traitement de ces cancers, notamment lenvatinib pour les premiers et vandétanib pour les seconds. Ces traitements ont cependant une toxicité significative, comprenant en particulier une asthénie qui peut être invalidante, posant un réel problème quant à la qualité de vie des patients.
Dans un article récent (1), des auteurs milanais rapportent des données originales suggérant que cette asthénie pourrait être liée, au moins en partie, à une insuffisance surrénale périphérique iatrogène en lien avec ces molécules, et qu’un traitement substitutif par hydrocortisone serait bénéfique pour les patients.
En conséquence, la question se pose de savoir si la prise en charge des patients atteints de cancer thyroïdien réfractaire implique aujourd’hui pour les endocrinologues, voire les oncologues, de rechercher et éventuellement de traiter une insuffisance surrénale.
Que faut-il penser de ces données ?
Dans leur article, Colombo et al. (1) montrent que :
- le taux d’ACTH (adrénocorticotrophine) est élevé et/ou s’élève au cours du temps lors du traitement chez 10 patients sur 12 (sous lenvatinib : 6/7 et sous vandétanib : 4/5), présentant par ailleurs une asthénie de grade 1 (2/10) ou de grade 2 (8/10). Les patients pour lesquels le taux d’ACTH n’augmentait pas (2/12) ne rapportaient pas d’asthénie ;
- aucun de ces 10 patients n’a un taux de cortisol < 5µg/dL (= 50 µg/L ; = 138 nmol/L) à 8 h, mais 6 patients montrent des réponses insuffisantes au Synacthène® 250 µg : < 15 µg/dL (= 150 µg/L ; = 414 nmol/L), ce qui permet de retenir le diagnostic d’insuffisance surrénale périphérique ;
- le degré de fatigue des patients est réduit par l’administration d’un traitement substitutif par acétate d’hydrocortisone.
Il faut souligner que, chez ces patients, des métastases surrénaliennes étaient éliminées, et qu’ils n’étaient pas porteurs d’autoanticorps antisurrénaliens.
Alors, doit-on désormais traquer et traiter l’insuffisance surrénale chez les patients sous traitement par lenvatinib ou vandétanib, ce qui impliquerait d’ailleurs de ne pas se limiter aux seuls patients atteints de cancer thyroïdien réfractaire ?
Si la question mérite d’être posée, cet article contient néanmoins quelques points d’achoppement. Ainsi, dans cette étude, seul 1 patient a été évalué sur le plan surrénalien avant l’instauration du traitement par lenvatinib ou vandétanib, et on peut toujours imaginer que les autres patients avaient déjà une fonction surrénalienne altérée avant le début du traitement, cependant sans cause évidente. Il faut également souligner chez tous les patients une réelle progression du taux d’ACTH au cours du traitement.
Ces insuffisances surrénales ne sont pas très profondes (le cortisol de base n’est pas particulièrement bas) et, dans la mesure où l’hydrocotisone n’est pas administrée en aveugle contre placebo, il est possible qu’il y ait une part d’effet placebo dans la diminution de l’asthénie.
Malgré tout, il nous semble que cet article ouvre la possibilité d’un réel bénéfice en termes de qualité de vie pour ces patients, et les questions posées relèvent typiquement de la compétence des endocrinologues : il serait ainsi dommage qu’ils ne saisissent pas l’opportunité d’explorer et de traiter leurs patients, idéalement dans le cadre d’une étude prospective qui permettrait dans un premier temps de mieux évaluer le problème.
Dans un second temps, il serait alors intéressant de proposer un mécanisme pour cette insuffisance surrénale périphérique, qui n’apparaît pas évident, dans la mesure où la stimulation de la sécrétion de cortisol par l’ACTH utilise la voie AMP cyclique, laquelle n’est pas a priori directement affectée par ces médicaments. Cependant, on peut bien sûr toujours imaginer qu’un des acteurs de la voie AMP cyclique soit affecté par l’inhibition d’une des nombreuses protéines tyrosine kinases induite par ces traitements.
Référence bibliographique
1. Colombo C et al. Primary Adrenal Insufficiency During Lenvatinib or Vandetanib and Improvement of Fatigue After Cortisone Acetate Therapy. J Clin Endocrinol Metab 2019;104(3):779-84.
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Olivier Chabre, Justine Cristante
Service d'endocrinologie, CHU Grenoble-Alpes
Il est reconnu qu’après une surrénalectomie unilatérale pour adénome corticosurrénalien responsable d’un syndrome de Cushing, le patient est en insuffisance surrénale profonde. En effet, la surrénale controlatérale laissée en place est atrophique du fait de la freination chronique de la sécrétion d’ACTH (adrénocorticotrophine) par l’adénome.
En revanche, le dogme qui prévalait jusqu’alors était qu’après une surrénalectomie unilatérale pour hyperaldostéronisme primaire, ce risque n’existait pas. La surrénale enlevée n’étant théoriquement responsable que d’une hypersécrétion d’aldostérone ne freinant pas l’ACTH, le risque d’insuffisance surrénale après l’intervention était écarté.
L'article de Heinrich et al. (1), publié par l'équipe munichoise de Martin Reincke, vient attaquer ce dogme, qui d'ailleurs avait déjà commencé à être battu en brèche il y a 4 ans par Hona et al. (2). Ces derniers avaient en effet rapporté des déficits postopératoires modérés chez des patients après surrénalectomie unilatérale pour hyperaldostéronisme primaire, ces patients ne présentant ni syndrome de Cushing, ni syndrome de Cushing infraclinique.
Dans l’article de Heinrich et al. (1), un test au Synacthène® a été réalisé de façon prospective (prélèvement aux temps 0 puis 30 min après l’injection i.v. de 250 µg de Synacthène® immédiat) chez 100 patients traités par surrénalectomie unilatérale pour hyperaldostéronisme primaire latéralisé dans les 5 jours suivant l’intervention.
Les résultats étaient les suivants :
- 13 patients classés insuffisants surrénaliens sévères car présentant un taux de cortisol après l’injection de Synacthène® < 13,5 µg/dL (= 135 µg/L, = 372 nmol/L) ;
- 14 patients classés insuffisants surrénaliens modérés, avec un cortisol après l’injection de Synacthène® entre 13,5 µg/dL et 17 µg/dL (= 170 µg/L, = 470 nmol/L)
- 73 patients ayant des taux > 17 µg/dL.
Fait troublant, aucune des explorations préopératoires (CLU (cortisol libre urinaire), freinage 1 mg, cortisol salivaire à 22 h, taux d’ACTH à 8 h) ne permettait de distinguer en préopératoire les patients classés comme insuffisants surrénaliens sévères en postopératoire.
Enfin, après le test au Synacthène® postopératoire, tous les patients classés insuffisants surrénaliens sévères étaient traités par hydrocortisone (en moyenne 10 mg/j), ainsi qu’une partie des patients insuffisants surrénaliens modérés. Le test au Synacthène® était ensuite répété tous les 3 mois, ce qui a permis de montrer que les insuffisants surrénaliens sévères mettaient nettement plus de temps à récupérer un test au Synacthène® normal que les insuffisants surrénaliens modérés (353 contre 74 jours).
Alors, que penser de cette étude ? Doit-on réaliser systématiquement un test au Synacthène® après surrénalectomie unilatérale pour hyperaldostéronisme primaire et substituer, pendant 1 an en moyenne, les patients n’ayant pas une réponse normale ?
Il est regrettable que les auteurs n’aient pas précisé un caractère préopératoire pertinent pour la question d’une insuffisance postopératoire en cortisol : la présence et la taille d’un adénome en TDM. Il faut souligner que, dans cette étude, tous les patients opérés pour hyperaldostéronisme primaire étaient sélectionnés par cathétérisme des veines surrénaliennes, ce qui permet de retenir un diagnostic de latéralisation même quand il n’y a pas d’adénome visible en TDM.
En effet, on peut penser que la survenue d’une insuffisance postopératoire de sécrétion de cortisol est liée au fait que la surrénale réséquée a une hypersécrétion non seulement d’aldostérone mais également de cortisol, et que cela doit être plus fréquent dans les tumeurs visibles en imagerie, dont on sait maintenant que beaucoup ne sécrètent pas que de l’aldostérone mais également du cortisol (3) .
Cependant, il faut reconnaître que l’absence de “stigmates” biologiques préopératoires d’hypercortisolisme, même minimes, ne va pas dans le sens de cette hypothèse. Peut-être que la surrénale restante a tout simplement une masse cellulaire insuffisante pour assurer une réponse normale au Synacthène®, même si elle n’a pas été “freinée” par une hypersécrétion de cortisol par la surrénale controlatérale ?
Autrement dit, faut-il réaliser le test au Synacthène® chez tous les patients pour identifier 13 % d’insuffisants surrénaliens sévères, qui seront traités par hydrocortisone pendant 1 an, et 14 % d’insuffisants surrénaliens modérés qui récupéreront plus vite ?
Les auteurs donnent un argument clinique pour convaincre de la pertinence de leurs investigations : une insuffisance surrénale aiguë est survenue chez l’un des 13 patients insuffisants surrénaliens sévères. Cependant, il faut souligner que chez ce patient qui a fait une hypotension, une hyperkaliémie a également été décelée qui ne peut pas être attribuée à l’insuffisance de sécrétion de cortisol, mais plutôt d’aldostérone.
Le fin mot de l’histoire est donc que si l’on réalise un test au Synacthène® après l’opération, il ne faut pas manquer d’évaluer aussi la sécrétion d’aldostérone ; cette recommandation figurait déjà dans le consensus français sur l’hyperaldostéronisme primaire (4, 5).
Références bibliographiques
1. Heinrich DA et al. Adrenal insufficiency after unilateral adrenalectomy in primary aldosteronism - long-term outcome and clinical impact. J Clin Endocrinol Metab 2019. doi: 10.1210/jc.2019-00996. [Epub ahead of print]
2. Honda K et al. Adrenal reserve function after unilateral adrenalectomy in patients with primary aldosteronism. J Hypertens 2013;31(10):2010-7.
3. Arlt W et al. Steroid metabolome analysis reveals prevalent glucocorticoid excess in primary aldosteronism. JCI Insight 2017;2(8). pii: 93136.
4. Steichen O et al. SFE/SFHTA/AFCE consensus on primary aldosteronism, part 6: Adrenal surgery. Ann Endocrinol (Paris) 2016;77(3):220-5.
5. Amar L et al. SFE/SFHTA/AFCE primary aldosteronism consensus: Introduction and handbook. Ann Endocrinol (Paris) 2016;77(3):179-86.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Olivier Chabre, Justine Cristante
Service d'endocrinologie, CHU Grenoble-Alpes
Un article récent (1) suggère que, dans l’HSMBP (hyperplasie surrénalienne macronodulaire bilatérale primaire), la surrénalectomie unilatérale serait responsable d’une surmortalité à long terme. Mais cet article pose des problèmes méthodologiques qui doivent faire relativiser cette hypothèse.
L’HSMBP est une pathologie dont l’origine génétique a été démontrée, au moins pour les patients porteurs d’une mutation du gène ARMC5 (2). Dans l’HSMBP, on observe le développement progressif d’une hyperplasie nodulaire du cortex surrénalien, entraînant une hypersécrétion de cortisol primitivement surrénalienne, liée à la fois à l’expression surrénalienne anormale de récepteurs (3) et à la sécrétion surrénalienne in situ d’ACTH (adrénocorticotrophine) (4).
Fait remarquable, il existe une grande disproportion entre la taille (et la masse) du tissu corticosurrénalien hyperplasique, qui peut être considérable, et sa sécrétion de cortisol, qui reste modérée, témoignant du fait que les cellules hyperplasiques ont une faible sécrétion de cortisol (en accord avec l’effet contre-intuitif des mutations de ARMC5, qui inhibent la sécrétion de cortisol). Cependant, comme cette sécrétion persiste, même si l’ACTH hypophysaire est freinée, la progression “tumorale” de l’HSMBP au fil des années résulte en un hypercortisolisme “primaire” initialement modéré, mais qui peut devenir franc, généralement après la 4e décade, lorsque la masse surrénalienne totale atteint une taille considérable.
L’hypercortisolisme de l’HSMBP peut être traité par une stratégie pharmacologique élégante qui consiste à empêcher l’activation des récepteurs anormalement exprimés (en utilisant un antagoniste, comme le propranolol pour les récepteurs bêta-adrénergiques, ou en inhibant la sécrétion du ligand endogène, comme les agonistes GnRH qui suppriment la sécrétion de LH pour le récepteur LH/hCG (3)). Cependant, le nombre de patients rapportés être contrôlés au long cours par cette stratégie reste très faible, ce qui suggère qu’elle est rarement efficace ou tolérée sur le long terme.
Par ailleurs, certains auteurs ont proposé de traiter ces patients par un inhibiteur de la stéroïdogenèse, comme la métyrapone administrée le soir chez les patients porteurs d’un hypercortisolisme modéré (données encore non publiées). Mais il s’agirait d’un traitement à vie, dont l’efficacité et la tolérance à long terme restent à établir.
Ainsi, en pratique, les principales options thérapeutiques sont chirurgicales : surrénalectomie uni- ou bilatérale.
La surrénalectomie bilatérale a une efficacité absolue et définitive sur l’hypercortisolisme, mais elle condamne le patient à une insuffisance surrénale qui, elle aussi, est absolue et définitive, nécessitant un traitement substitutif à vie et un risque de décompensation d’insuffisance surrénale aiguë. Il faut souligner qu’il est maintenant démontré que l’insuffisance surrénale est responsable d’une surmortalité (5, 6), qui tient vraisemblablement à la fois à des insuffisances surrénales aiguës fatales et à une surmortalité d’origine cardiovasculaire chez des patients sans doute trop substitués. Cette surmortalité persiste chez les patients ayant reçu une éducation thérapeutique (7).
La surrénalectomie unilatérale n’a pas cet inconvénient majeur de l’insuffisance surrénale totale et définitive. Mais, jusqu’à ces dernières années, elle ne semblait pas suffisante pour contrôler un syndrome de Cushing franc, chez des patients ayant des dosages de CLU (cortisol libre urinaire) supérieurs à 2 fois la normale. Cependant, plusieurs travaux, dont celui d’une équipe multicentrique française à laquelle nous avons participé (8), ont démontré le contraire : l’efficacité de la surrénalectomie unilatérale sur la normalisation du CLU et le contrôle du syndrome de Cushing est excellente, soit 100 % dans la série française (8) et 91 % dans une revue répertoriant tous les cas publiés (9). La surrénalectomie unilatérale est même responsable d’une insuffisance surrénale dans 36 % des cas, mais il s’agit d’une insuffisance surrénale uniquement en cortisol et qui n’est que transitoire.
Il peut sembler surprenant que la surrénalectomie unilatérale soit aussi efficace alors qu’une seule surrénale est enlevée et que celle laissée en place est hyperplasique. Plusieurs explications peuvent être avancées. Premièrement, lorsqu’on enlève la plus grosse surrénale, la masse totale du tissu surrénalien sécrétant est divisée par plus de 2 ; deuxièmement, même si les 2 surrénales sont équivalentes et que l’on enlève que la moitié de la masse surrénalienne totale, il faut se rappeler que le CLU n’évolue pas de façon linéaire avec le taux de sécrétion de cortisol : lorsque la CBG (cortisol binding globuline) est saturée, un doublement du taux de sécrétion de cortisol fera bien plus que doubler le CLU et, inversement, une réduction par 2 du taux de sécrétion de cortisol diminuera bien plus le CLU.
Il peut sembler également étonnant que le patient HSMBP opéré par surrénalectomie unilatérale soit en insuffisance surrénale en postopératoire, alors qu’il lui reste une surrénale hyperplasique et que, somme toute, il se retrouve avec la même masse surrénalienne qu’auparavant (le temps de doublement), à une époque où il n’était pas en insuffisance surrénale.
Il faut ici réaliser que cette insuffisance surrénale postopératoire est d’origine secondaire, liée à la freination persistante, par inertie, de la sécrétion hypophysaire d’ACTH. En effet, même si les cellules corticosurrénaliennes d’HSMBP sont capables d’une sécrétion de cortisol indépendante de l’ACTH hypophysaire, elles restent sensibles à la stimulation par l’ACTH : s’il n’y a plus de sécrétion hypophysaire d’ACTH, elles ne peuvent produire que leur sécrétion “autonome”, qui, sur une seule surrénale n’est pas suffisante pour assurer les besoins. Cette insuffisance surrénale postopératoire est transitoire, le temps que l’inertie de la sécrétion hypophysaire d’ACTH soit levée.
La surrénalectomie unilatérale semblait donc considérée comme le traitement de 1re intention de l’hypercortisolisme de l’HSMBP, d’autant plus que, si jamais elle n’était pas suffisamment efficace – ce qui reste exceptionnel – ou s’il apparaissait une récidive, – ce qui est observé dans 15 % des cas dans un délai d’environ 5 ans –, il était toujours possible de “totaliser” la surrénalectomie en enlevant la surrénale restante.
Voici pourquoi, après cette très longue introduction, les travaux récents de l’équipe de Munich (1) jettent un pavé dans la mare en suggérant, à long terme, la surmortalité des patients HSMBP opérés par surrénalectomie unilatérale par rapport à ceux traités par surrénalectomie bilatérale.
Que penser de cet article, dont les données peuvent être résumées de la façon suivante : sur les 34 patients HSMBP avec hypercortisolisme franc, porteurs d’un syndrome de Cushing, 25 étaient traités par surrénalectomie unilatérale et 9 par surrénalectomie bilatérale.
Chez les 25 patients ayant une surrénalectomie unilatérale, le taux de contrôle postopératoire de l’hypercortisolisme était de 84 %, et le taux d’insuffisance surrénale de 50 %, avec un temps de récupération moyen de 3 mois. Aucun cas d’insuffisance surrénale aiguë n’était rapporté. On notait cependant un taux de récidive “biologique” de l’hypercortisolisme significatif, expliquant que seuls 68 % des patients restaient contrôlés 4 ans après l’intervention.
Enfin, et c’est le point central de cet article, le suivi à long terme mettait en évidence le décès de 3 patients traités par surrénalectomie unilatérale. Ces décès d’origine infectieuse et cardiovasculaire sont survenus chez des patients dont l’hypercortisolisme avait récidivé.
Par contraste, les 9 patients ayant eu une surrénalectomie bilatérale étaient tous en rémission définitive de l’hypercortisolisme et aucun décès n’était rapporté. Cependant, comme il fallait s’y attendre, ces patients ont présenté des décompensations d’insuffisance surrénale aiguë, avec 1 épisode par an en moyenne chez 38 % des patients.
Que faut-il conclure de ces données ? Bien sûr, la mise en évidence d’une possible surmortalité chez les patients traités par surrénalectomie unilatérale est à prendre en considération, et elle met le doigt sur le caractère imparfait de la rémission de ces patients : il est très probable que la majorité d’entre eux conservent une certaine sécrétion de cortisol en début de nuit, très comparable à ce qui est observé chez les patients porteurs d’un syndrome de Cushing infraclinique, et on sait maintenant que cet état est rattaché à une surmortalité (10, 11).
Comparons maintenant le groupe des 25 patients (où 3 décès sont survenus) au groupe des 9 patients (aucun décès rapporté) exposés au risque d’insuffisance surrénale aiguë, situation pourtant reconnue à risque de surmortalité. Est-ce que ces 2 groupes ont une mortalité statistiquement différente ? La réponse est : non ! En effet, la valeur p est à 0,19, comme l’a reconnu l’auteur correspondant de l’article (communication personnelle, mais qui a donné lieu à une lettre adressée à l’éditeur qui devrait être publiée prochainement).
Et pourtant, l’article indiquait, pour la comparaison de la mortalité, une valeur p à 0,008.
L’explication de cette discordance est simple, et elle n’aurait pas dû échapper aux relecteurs du Journal of clinical endocrinology and metabolism. Dans cet article, les auteurs ont ajouté un autre groupe de 39 patients traités par surrénalectomie unilatérale pour adénome cortisolique, et ils ont utilisé ce groupe comme contrôle. Ils retrouvaient alors une différence de mortalité significative (avec p = 0,008) en considérant d’un côté les 25 patients HSMBP traités par surrénalectomie unilatérale et, de l’autre, un groupe composite de 48 patients (9 patients HSMBP traités par surrénalectomie bilatérale et 39 traités par surrénalectomie unilatérale pour adénome cortisolique et dont aucun n’a présenté de décès).
On comprend facilement que ce groupe de 48 patients ne permet pas de comparer les risques de mortalité, car seuls 9 de ces 48 patients étaient exposés au risque de décès d’insuffisance surrénale aiguë.
Les auteurs de l’article ont voulu pallier le faible nombre de patients HSMBP traités par surrénalectomie bilatérale. Mais ils auraient dû utiliser comme groupe contrôle supplémentaire des patients traités par surrénalectomie bilatérale pour une autre pathologie.
Au final, le mérite de cet article est d’avoir mis le doigt sur un risque de mortalité à long terme chez les patients HSMBP traités par surrénalectomie unilatérale, vraisemblablement lié à la persistance d’un hypercortisolisme infraclinique ou à la récidive d’un hypercortisolisme plus significatif. En revanche, il ne démontre pas que ce risque est supérieur au risque de mortalité par insuffisance surrénale aiguë des patients traités par surrénalectomie bilatérale, qui lui est réel.
De ce fait, et en attendant d’autres études, le clinicien prenant en charge un patient HSMBP ayant un hypercortisolisme se trouve placé devant un choix difficile : une surrénalectomie unilatérale entraînant un risque de récidive et une certaine surmortalité ? ou une surrénalectomie bilatérale sans risque de récidive mais avec une certitude d’insuffisance surrénale totale et définitive et un risque d’insuffisance surrénale aiguë et de surmortalité ? Actuellement, il n’est pas possible de comparer ces 2 surmortalités.
En pratique, le clinicien devra bien sûr prendre en compte les désirs du patient pour choisir avec lui la meilleure décision, en gardant à l’esprit que si la voie de la surrénalectomie unilatérale est préférée, il sera toujours possible dans un second temps de changer pour la voie de la surrénalectomie bilatérale, à la condition d’avoir réussi à bien suivre le patient. Alors que l’inverse n’est pas vrai.
Références bibliographiques
1. Osswald A et al. Long-Term Outcome of Primary Bilateral Macronodular Adrenocortical Hyperplasia After Unilateral Adrenalectomy. J Clin Endocrinol Metab 2019;104(7):2985-93.
2. Assié G et al. ARMC5 mutations in macronodular adrenal hyperplasia with Cushing's syndrome. N Engl J Med 2013;369(22):2105-14.
3. Lacroix A et al. Ectopic and abnormal hormone receptors in adrenal Cushing's syndrome. Endocr Rev 2001;22(1):75-110.
4. Louiset E et al. Intraadrenal corticotropin in bilateral macronodular adrenal hyperplasia. N Engl J Med 2013;369(22):2115-25.
5. Bergthorsdottir R et al. Premature mortality in patients with Addison's disease: a population-based study. J Clin Endocrinol Metab 2006;91(12):4849-53.
6. Hahner S et al. High incidence of adrenal crisis in educated patients with chronic adrenal insufficiency: a prospective study. J Clin Endocrinol Metab 2015;100(2):407-16.
7. Hahner S. Acute adrenal crisis and mortality in adrenal insufficiency: Still a concern in 2018! Ann Endocrinol (Paris) 2018;79(3):164-6.
8. Debillon E et al. Unilateral Adrenalectomy as a First-Line Treatment of Cushing's Syndrome in Patients With Primary Bilateral Macronodular Adrenal Hyperplasia. J Clin Endocrinol Metab 2015;100(12):4417-24.
9. Cristante J, Chabre O. Unilateral adrenalectomy in primary bilateral macronodular hyperplasia. Curr Opin Endocr Metab Res 2019 [Epub ahead of print].
10. Di Dalmazi G et al. Cardiovascular events and mortality in patients with adrenal incidentalomas that are either non-secreting or associated with intermediate phenotype or subclinical Cushing's syndrome: a 15-year retrospective study. Lancet Diabetes Endocrinol 2014;2(5):396-405.
11. Debono M et al. Cortisol as a marker for increased mortality in patients with incidental adrenocortical adenomas. J Clin Endocrinol Metab 2014;99(12):4462-70.
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
chez les patients présentant un phéochromocytome bilatéral
Justine Cristante, Olivier Chabre
Service d'endocrinologie, CHU Grenoble-Alpes
Comme de nombreuses autres pathologies tumorales surrénaliennes, le phéochromocytome dans sa forme bilatérale n’échappe pas aux questions suivantes : doit-on proposer une surrénalectomie bilatérale “totale”, permettant de guérir le patient de sa pathologie tumorale et de limiter une possible récidive au prix d’une IS (insuffisance surrénalienne) définitive associée au risque lié aux insuffisances surrénaliennes aiguës ? Ou bien, faut-il préférer une intervention de type surrénalectomie épargnant le cortex surrénalien et limitant donc le risque d’insuffisance surrénalienne aiguë mais pouvant majorer le risque de récidive tumorale locale, voire métastatique ?
L’Endocrine Society indiquait dans ses recommandations de 2014 que l’approche chirurgicale devait être guidée par la taille, la localisation, mais aussi la mutation génétique sous-jacente, afin d’étudier la possibilité d’une surrénalectomie épargnant la corticale surrénalienne chez les patients à risque de développer un second phéochromocytome controlatéral ou ayant déjà eu une première surrénalectomie totale (1).
Une étude internationale rétrospective (2) effectuée à partir d’un registre prospectif tente de répondre à ces questions en comparant la mortalité du phéochromocytome, la mortalité liée à l’IS et le risque de récidive du phéochromocytome chez les patients ayant bénéficié d’une surrénalectomie totale (ST) versus une surrénalectomie avec épargne de la zone corticale (SEC).
Cette étude a inclus 625 patients. 84 % ont pu bénéficier d’une analyse génétique, qui retrouvait une mutation germinale (constitutionnelle) chez 96 % des patients : RET (53 %) et VHL (35 %) étaient les 2 principaux gènes mutés par ordre de fréquence, suivis de NF1, MAX, SDHD, TMEM127 et SDHB. Les patients NEM2 avaient plus de phéochromocytomes bilatéraux au diagnostic que les VHL et étaient plus souvent traités par ST.
On dénombre 849 surrénalectomies chez 625 patients (401 synchrones et 448 métachrones) ; 324 (52 %) ont bénéficié d’une SEC, avec absence d’IS chez 248 patients (76 %) (figure).
Figure. Répartition du type d'opération effectué chez les patients du registre et de leurs résultats (nécessité d'une substitution en glucocorticoïdes, nombre de récidives, nombre de patients métastatiques) (d’après (2)).
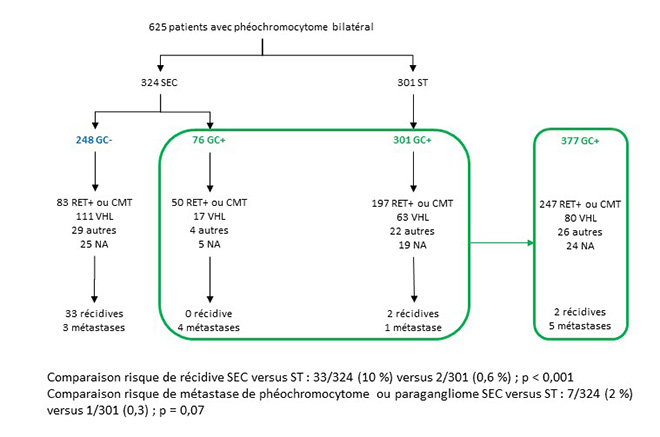
L’analyse statistique était effectuée à partir de la comparaison de 2 groupes : un groupe sans traitement glucocorticoïde substitutif (GC-), incluant les 248 patients SEC avec absence d’IS postchirurgicale, et un groupe avec traitement glucocorticoïde substitutif (GC+), regroupant l’ensemble des patients ST et les patients SEC avec IS postchirurgicale, soit un total de 377 patients. Les patients GC- avaient une meilleure survie que ceux GC+ (99 versus 85 %, IC95 = 11-18 %, p = 0,01). Toutefois, cette différence de mortalité était principalement liée à une proportion plus grande de patients NEM2 atteints de cancer médullaire métastatique dans le groupe GC+ (53 % de décès liés à un cancer médullaire de la thyroïde dans le groupe GC+ versus 38 %). Il n’existait pas de différence significative de mortalité spécifique au phéochromocytome entre les 2 groupes.
Concernant les crises d’insuffisance surrénale aiguë, 67 patients du groupes GC+ (17,7 %) ont eu au total 177 crises, dont 2 ont été fatales. Le motif principal de décompensation était l’infection. À l’inverse, 50 patients (13,2 %) présentaient des signes de surdosage en glucocorticoïdes.
Nous avons analysé la récidive locale en fonction du geste effectué (à noter que, dans l’article, cette analyse est faite en fonction du caractère GC+ ou GC-, ce qui ne nous paraît pas pertinent) : 10 % des patients SEC ont présenté une récidive de phéochromocytome après avoir subi une chirurgie bilatérale contre 0,6 % du groupe ST (valeur p calculée par nos soins < 0,001). Chez les patients GC- (donc ayant eu une SEC), un traitement substitutif a alors été nécessaire chez 30 %, après une nouvelle chirurgie d’exérèse.
8 patients ont développé un phéochromocytome métastatique : 1 dans le groupe ST et 7 dans le groupe SEC. Parmi les 8 patients, 4 avaient une mutation VHL, 1 une mutation MAX et 1 une mutation RET. Le geste thérapeutique en fonction de la mutation n’était pas décrit dans l’article. Des métastases étaient retrouvées chez 1 patient avant la chirurgie, et 3 patients métastatiques avaient également un paragangliome. Là encore, la classification précise de ces patients en fonction du geste et de la mutation n’est pas précisée. Le risque de métastases tend à être significativement plus important chez les patients ayant une chirurgie de type SEC. Toutefois, la prise en compte de métastases potentiellement liées à des paragangliomes chez 3 patients rend l’interprétation de ce résultat délicate.
On peut néanmoins relever quelques biais dans cette étude :
- Les patients analysés dans le registre avaient eu un diagnostic entre 1950 et 2018. Si cette longue période a permis d’obtenir une médiane de suivi conséquente et intéressante dans le contexte d’analyse de la récidive de phéochromocytome, l’ancienneté de certaines données se heurte à l’évolution des pratiques chirurgicales et de substitution. En particulier, la SEC est une technique récente (seulement 300 patients opérés avec cette technique en 2014) (3) et a été beaucoup plus pratiquée dans la cohorte de l’étude après 2010. De plus, ses résultats étaient meilleurs en termes d’épargne de la fonction glucocorticoïde surrénalienne après 2010. Enfin, les doses substitutives étaient généralement plus importantes (autour de 30 mg d’équivalent hydrocortisone) avant les années 1980-1990, ce qui peut avoir majoré le nombre de patients présentant des signes de surdosage en glucocorticoïdes dans cette période, mais a aussi pu limiter le risque de décompensation surrénalienne.
- Comme toute étude internationale rétrospective reposant sur un registre, la collecte des données n’a pas toujours pu être effectuée de façon uniforme, les protocoles thérapeutiques variant selon les centres, l’expérience du chirurgien n’a pas pu être évaluée.
En conclusion, comparer la SEC et la ST revient à évaluer les risques de mortalité liés d’une part à la récidive du phéochromocytome et, d’autre part, à l’insuffisance surrénale. Pour les auteurs, la SEC accroît le risque de récidive locale de phéochromocytome (10 versus 0,6 % pour la ST), mais n’augmente pas la mortalité liée au phéochromocytome, alors que la ST augmente le risque d’IS. L’interprétation des chiffres donnés pour les métastases est rendue complexe par la présence de patients déjà métastatiques au moment du geste chirurgical ou ayant des paragangliomes, qui ne devraient donc pas être inclus dans l’analyse statistique puisque leur caractère métastatique ne découle pas forcément d’une chirurgie incomplète. De même, la génétique n’est disponible que pour 6 des 8 patients métastatiques et il n’est pas précisé quel geste a été fait en fonction de la génétique et quelle était la génétique du patient déjà métastatique au diagnostic ainsi que celle des patients avec paragangliomes.
La mortalité par crise d’insuffisance surrénalienne aiguë reste faible dans cette cohorte, mais non négligeable (4,3 %). Et il faut souligner que le nombre de décompensations surrénaliennes aiguës avoisine les 50 % chez les patients nécessitant un traitement glucocorticoïde substitutif.
La chirurgie de type SEC reste donc une alternative à la ST, notamment chez des patients ayant des phéochromocytomes de petite taille et de présentation bilatérale d’emblée ou présentant une mutation génétique exposant au risque de phéochromocytome sur la glande surrénale controlatérale.
Références bibliographiques
1. Lenders JW et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99(6):1915-42.
2. Neumann HPH et al. Comparison of Pheochromocytoma-Specific Morbidity and Mortality Among Adults With Bilateral Pheochromocytomas Undergoing Total Adrenalectomy vs Cortical-Sparing Adrenalectomy. JAMA Netw Open 2019;2(8):e198898.
3. Castinetti F et al. MANAGEMENT OF ENDOCRINE DISEASE: Outcome of adrenal sparing surgery in heritable pheochromocytoma. Eur J Endocrinol 2016;174(1)R9-18.
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Justine Cristante, Olivier Chabre
Service d'endocrinologie, CHU Grenoble-Alpes
Le dépistage de l’insuffisance surrénalienne repose sur la mesure d’un cortisol de base à 8 h ou sur l’absence de réponse à un test au Synacthène® (TS). La pénurie de Synacthène® en 2014 ainsi que l’augmentation récente de son coût au Royaume-Uni ont incité une équipe écossaise à se poser la question de la valeur d’un dosage de cortisol plasmatique basal, sans stimulation par le Synacthène®, que ce cortisol basal soit dosé le matin, l’après-midi, en ambulatoire ou dans le contexte d’une hospitalisation (1). L’objectif était de déterminer un seuil de cortisol pouvant prédire la réponse à un test au Synacthène® (cortisol dosé 30 min après l’injection de 250 µg de Synacthène® immédiat) et de comparer les performances du cortisol mesuré le matin ou l’après-midi pour prédire cette réponse.
Il s’agissait d’une étude rétrospective ayant étudié la réponse de 1 624 TS dans une cohorte de patients ambulatoires (C1). Le seuil retenu pour atteindre une sensibilité de 95 % pour la prédiction d’un cortisol anormal au temps T + 30 min d’un TS était un taux de cortisol plasmatique < 275 nmol/L le matin (entre 8 h et 12 h) et < 250 nmol/L l’après-midi (entre 12 h et 18 h).
Ces seuils ont ensuite été testés et validés sur une seconde cohorte (C2) de patients consultant en ambulatoire à l’hôpital (soit 873 TS), mais aussi sur une troisième cohorte (C3), incluant cette fois-ci des patients hospitalisés (804 TS).
Le tableau ci-dessous indique les différentes valeurs de sensibilité (Se), spécificité (Sp), valeur prédictive positive (VPP, ici représentant les patients avec cortisol de base inférieur au seuil déterminé et non répondeurs au TS) et valeur prédictive négative (VPN, ici représentant les patients avec cortisol de base supérieur au seuil déterminé et répondeurs au TS) pour les 3 cohortes ainsi que l’existence d’une différence statistiquement significative dans ces différents paramètres entre les tests du matin et ceux de l’après-midi.
Les messages clés sont les suivants :
- La Sp et la VPP sont relativement faibles, voire médiocres, et il existe une différence significative pour ces paramètres entre les dosages du matin et ceux de l’après-midi (mais qui finalement n’est peut-être pas très intéressante au vu des valeurs faibles de Sp et VPP, y compris le matin). Les données des auteurs montrent donc que la grande majorité des patients classés insuffisants surrénaliens par le TS ont un taux de base du cortisol inférieur au seuil retenu (250 ou 275 nmol/L selon l’heure du TS), mais qu’en dessous de ce seuil, on retrouve également de nombreux patients non insuffisants surrénaliens ayant une réponse satisfaisante au TS.
- Les seuils retenus permettent une excellente Se et VPN (> 95 %) dans les 3 cohortes, pour les tests du matin comme de l’après-midi. La seule exception est une Se moindre à 89 % pour les tests de l’après-midi dans la cohorte C3. L’intérêt de ce seuil est donc surtout d’éliminer le diagnostic d’insuffisance surrénale chez les patients ayant un cortisol basal > 275 nmol/L, et il faut souligner que ce seuil est bien au-dessous de celui de 500 nmol/L proposé par le consensus de la Société française d'endocrinologie (2, 3) pour éliminer une insuffisance surrénale sans avoir recours à un test de stimulation.
Tableau. Performances statistiques de la mesure de cortisol plasmatique pour prédire la réponse au test au Synacthène® (d’après [1])
|
Cohorte C1 |
Cohorte C2 |
Cohorte C3 |
||||||
|
Matin |
Après-midi |
Différence significative |
Matin |
Après-midi |
Différence significative (versus cohorte 1) |
Matin |
Après-midi |
Différence significative (versus cohorte 1) |
Se |
92,2 |
96,1 |
Non |
98,6 |
100 |
Non |
97,4 |
89,2 |
Non |
Sp |
55,1 |
37,7 |
Oui |
56,8 |
48,9 |
Oui pour après-midi |
80,0 |
72,8 |
Oui pour matin et après-midi |
VPN |
98,4 |
98,9 |
Non |
99,3 |
100 |
Non |
99,6 |
98,6 |
Non |
VPP |
33,5 |
14,0 |
Oui |
38,0 |
18,8 |
Non |
35,2 |
24,3 |
Oui pour après-midi |
Il a été calculé que l’adoption de ces seuils pourrait permettre de réduire le nombre de tests au Synacthène® entre 48,2 et 73,8 % le matin et entre 36,2 et 39,7 % l’après-midi, selon la cohorte étudiée.
Le message clinique est donc le suivant : si le cortisol basal est > 275 nmol/L, le risque d’insuffisance surrénale est très faible, que ce cortisol soit mesuré le matin, l’après-midi, en ambulatoire ou au cours de l’hospitalisation. Ainsi, cette étude permet surtout des diagnostics plus rapides d’élimination de l’insuffisance surrénale chez les patients au-dessus de ce seuil qui n’auraient pas besoin de TS pour démontrer qu’ils ne sont pas insuffisants surrénaliens.
Il est dommage que ce seuil n’atteigne pas une sensibilité suffisante pour la mesure de l’après-midi chez les patients hospitalisés. En effet, ces patients représentent souvent un cas diagnostique pour lequel nous sommes sollicités (par exemple, cas du patient arrivant aux urgences à 15 h, pour lequel on suspecte une primo-décompensation surrénalienne, chez qui l’administration d’hydrocortisone “dans le doute” retardera le diagnostic, le cortisol ne pouvant pas être dosé le matin le jour suivant).
Ce défaut de sensibilité peut être expliqué par des profils de patients différents entre les cohortes. En effet, dans la cohorte de patients hospitalisés, 40 % des tests ont été réalisés pour une hyponatrémie (versus 3,4 % dans la C1 et 6,1 % dans la C2), 22 % pour une hypotension orthostatique (versus 3,7 % dans la C1 et 8,5 % dans la C2) et 19,6 % pour un motif inconnu (versus 5,3 % dans la C1 et 2,9 % dans la C2), qui semblent être des indications où l’insuffisance surrénalienne est plutôt un diagnostic d’élimination et où, justement, le cortisol plasmatique seul aurait un grand intérêt d’économie de santé.
À l’inverse, dans les cohortes 1 et 2, les motifs les plus fréquents de réalisation de TS sont des indications choisies : hypogonadisme central (respectivement 14,5 et 17,1 %), macroadénome non sécrétant (respectivement 13,4 et 4,3 %), radiothérapie hypophysaire (respectivement 15,1 et 7,2 %) et autre trouble hypophysaire (respectivement 13,0 et 7,8 %).
Bien entendu, ces seuils sont propres à la méthode de dosage utilisée (Architect®) et doivent donc être définis pour les autres trousses de dosage.
Cette étude ouvre donc la voie au diagnostic d’élimination de l’insuffisance surrénalienne par un cortisol dosé “à la volée”, pour le plus grand bonheur des “lève-tard”, sous réserve que ces seuils soient validés prospectivement.
Références bibliographiques
1. Mackenzie SD et al. Validated criteria for the interpretation of a single measurement of serum cortisol in the investigation of suspected adrenal insufficiency. Clin Endocrinol (Oxf) 2019. doi: 10.1111/cen.14071. [Epub ahead of print]
2. Reznik Y et al. SFE/SFEDP adrenal insufficiency French consensus: Introduction and handbook. Ann Endocrinol (Paris) 2018;79:1-22.
3. Chanson P et al. Group 2: Adrenal insufficiency: screening methods and confirmation of diagnosis. Ann Endocrinol (Paris) 2017;78:495-511.
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Justine Cristante, Olivier Chabre
Service d'endocrinologie, CHU Grenoble-Alpes
L’éducation thérapeutique des patients (ETP) insuffisants surrénaliens a beaucoup évolué au cours des dernières décennies tant sur le plan des doses substitutives de glucocorticoïdes proposées que sur celui des messages éducatifs d’augmentation des doses.
Dans le cadre du développement d’un programme d’ETP structuré, nos confrères allemands ont proposé à leurs patients de tenir un “journal” quotidien et de l’utiliser comme outil éducatif (1). Jour après jour, les patients devaient répondre à une question concernant le ressenti de leur état de santé général du moment, la survenue d’un problème de santé ou de symptômes générateurs “d’inconfort” et dire s’ils avaient modifié en conséquence leur dose habituelle de glucocorticoïdes. Ces informations étaient recueillies via 2 questions standardisées “oui/non”, sous forme de cases à cocher.
Pour chaque jour où il était répondu “oui” à l’une des 2 questions, les patients devaient noter la présence des symptômes, là encore en cochant la case correspondante (infection gastro-intestinale, autres infections, vomissements, fièvre, autres symptômes), voire en complétant dans une zone de texte libre. Les patients reportaient également le type de glucocorticoïdes utilisé et la dose supplémentaire prise, en précisant si elle leur avait été conseillée par un médecin ou s’il s’agissait d’un auto-ajustement.
Les auteurs ont ainsi créé un score de signes et symptômes (SSS), non validé, noté sur 10, permettant d’évaluer la sévérité d’un épisode “d’inconfort”. La présence de chaque symptôme valait 1 point (“inconfort”, infection, fièvre, diarrhée, anorexie ou nausée, vomissements, asthénie, tremblements/hypotension, douleur musculaire ou abdominale, pathologie intercurrente confirmée).
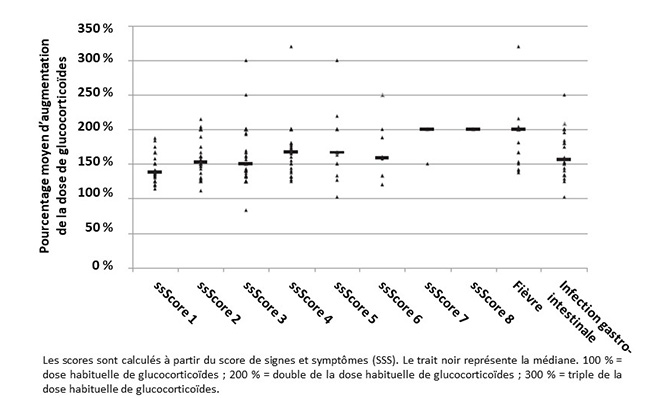
Les auteurs ont effectué un impressionnant travail, analysant 80 journaux de patients, soit 34 074 jours (médiane : 356 jours/patient). 71 patients ont relaté au moins 1 épisode symptomatique, soit 4 622 jours au total, représentant 486 épisodes, pour une médiane de 4 épisodes par patient. L’ajustement de dose n’était présente que pour 35 % des jours. Il n’y avait pas de différence dans le nombre d’épisodes ou la durée entre les patients présentant une insuffisance surrénalienne primaire et secondaire. En revanche, les épisodes “d’inconfort” étaient plus nombreux chez les femmes que chez les hommes. Les patients augmentaient leur dose quotidienne de glucocorticoïdes d’environ 50 % pour un SSS noté entre 1 et 3, de 60 % pour un SSS entre 4 et 6 et de 100 % pour un SSS de 7 ou de 8. Deux patients ont présenté des crises d’insuffisance surrénale aiguë.
L’analyse du graphique (figure) montre des comportements variés selon les patients, avec, par exemple, une augmentation moyenne de seulement 50 % de la dose quotidienne en cas d’infection gastro-intestinale. Cette donnée est intéressante, puisque dans l’étude de Hahner et al., le principal facteur déclenchant de crise d’insuffisance surrénale aiguë chez des patients ayant bénéficié d’un programme d’ETP était la gastroentérite (2). On relève également des comportements qui peuvent paraître inadaptés, par exemple le triplement de la dose pour un SSS faible ou bien, au contraire, l’augmentation de seulement 50 % de la dose chez certains patients lors d’épisodes de fièvre.
Cette étude montre donc que la survenue d’un épisode “d’inconfort“ ne déclenche pas automatiquement une augmentation des doses d’hydrocortisone, probablement parce que l’inconfort est perçu comme peu invalidant. Ces résultats mettent également en évidence des comportements variés, entre des patients qui ont tendance à trop augmenter leurs doses d’hydrocortisone, quand certains ne l’augmentent pas assez.
Le concept du journal nous semble intéressant en tant qu’outil éducatif, pour “débriefer” a posteriori les conduites d’adaptation du traitement par le patient, à l’instar de ce qui est fait en diabétologie avec les ajustements de doses d’insuline en fonction des glycémies et des glucides.
Figure. Représentation du pourcentage moyen d’augmentation de la dose de glucocorticoïdes chez des patients insuffisants surrénaliens, en cas de sensation “d’inconfort” ou de maladie (d’après (1))
Références bibliographiques
1. Schöfl C et al. Daily adjustment of glucocorticoids by patients with adrenal insufficiency. Clin Endocrinol (Oxf) 2019;91:256-62.
2. Hahner S et al. High incidence of adrenal crisis in educated patients with chronic adrenal insufficiency: a prospective study. J Clin Endocrinol Metab 2015;100:407-16.
O. Chabre déclare avoir des liens d’intérêts avec Ipsen, HRA Pharma, Novartis.
J. Cristante déclare ne pas avoir de liens d’intérêts.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 Paris– Courriel : webmaster@sfendocrino.org

