|
Solange Grunenwald |
Chers collègues,
Enfin une nouvelle newsletter Thyroïde, pleine de nouveautés et de diversités.
À travers 6 articles, nous vous proposons de parcourir les mondes de l’échographie, de la pédiatrie, de la cancérologie, de la gynécologie à travers le prisme de la thyroïdologie.
Tout d’abord, vous (re)découvrirez l’aspect échographique des tumeurs trabéculaires hyalinisantes grâce à l’expérience de l’équipe de Gilles Russ.
Vous vous questionnerez ensuite sur la possibilité que vos patients les plus jeunes, présentant un goitre multinodulaire ou un cancer thyroïdien différencié, soient porteurs d’une prédisposition génétique tumorale DICER1.
L’arrivée des thérapies ciblant spécifiquement RET vous redonnera de l’espoir pour vos patients atteints de CMT (cancer médullaire de la thyroïde) ou pour les cancers thyroïdiens différenciés les plus avancés.
Deux articles vous permettront d’aborder les questions d’auto-immunité et grossesse : anticorps anti-TPO et désir de grossesse pour l’un, anticorps antihormones thyroïdiennes et thyroïdite du post-partum pour le second.
Enfin, une synthèse d’articles de l’équipe japonaise de M. Ito relancera le débat sur la substitution par la seule L-thyroxine.
Bonne lecture et joyeuses fêtes de fin d’années !
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Gilles Russ, Bénédicte Royer, Claude Bigorgne, Agnès Rouxel, Marie Bienvenu-Perrard
Centre de pathologie et d’imagerie, 14 avenue René-Coty, 75014 Paris.
Les tumeurs trabéculaires hyalinisantes sont des lésions rares de la thyroïde, décrites pour la première fois par Carney en 1987 (1). Ce sont des tumeurs de souche folliculaire, atteignant surtout les femmes d’âge moyen. La description en 2019 par Nikiforova d’une anomalie moléculaire spécifique de cette tumeur, un réarrangement GLIS, éclaire d’une lueur nouvelle cette lésion (2). Le diagnostic est histologique et immunohistochimique, mais les caractéristiques cytologiques peuvent induire des confusions fréquentes avec un carcinome papillaire ou même avec un carcinome médullaire de la thyroïde. La comparaison des résultats cytologiques avec l’aspect échographique pourrait permettre de limiter ces erreurs. Quels sont donc les signes échographiques des tumeurs trabéculaires hyalinisantes (TTH) ?
Notre équipe a identifié dans sa base de données 5 cas de TTH entre 2001 et 2016. Leur aspect échographique était identique (figures 1 et 2) : il s’agissait de nodules de score EU-TIRADS 4 :
- de forme ovale ;
- aux contours réguliers (1 cas sur 5 présentait des irrégularités) ;
- comportant ou non un fin halo ;
- exclusivement solides ;
- modérément hypoéchogènes, mais dont l’hypoéchogénicité pouvait atteindre celle des muscles superficiels, sans la dépasser, expliquant en partie la difficulté à voir le halo par manque de contraste entre celui-ci et la tumeur elle-même ;
- sans ponctuations échogènes et, en particulier, sans microcalcifications ;
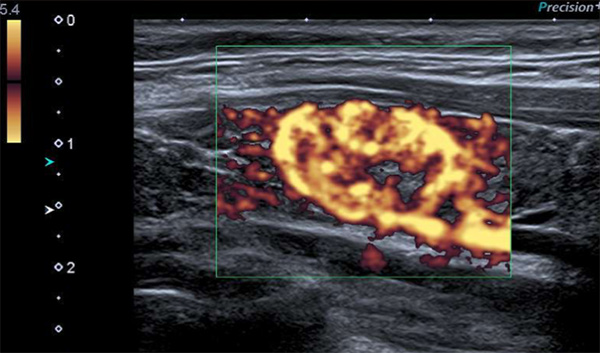
- comportant une vascularisation centrale intense.
Figure 1. Coupes longitudinale et transversale d’un nodule ovale, exclusivement solide, modérément hypoéchogène, mais dont l’échogénicité est celle des muscles superficiels, sans ponctuations hyperéchogènes.
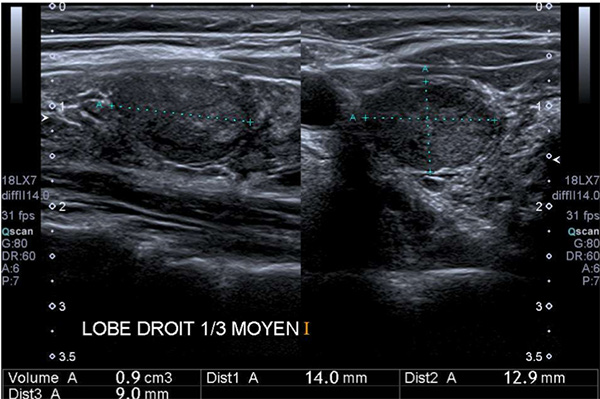
Figure 2. Étude au doppler puissance : hypervascularisation centrale diffuse.
L’étude la littérature permet d’identifier 3 séries principales sur les aspects échographiques des TTH, toutes provenant de Corée du Sud. Dans l’étude de Jang et al. (3), sur 12 TTH, les nodules étaient de forme ovale et vascularisés (100 %), hypoéchogènes (83 %) et sans calcifications (92 %). Dans 55 % des cas, la cytologie était suspecte de carcinome papillaire. Dans la série de Choi et al. (4), sur 24 cas, les nodules étaient de forme ovale, présentaient une vascularisation centrale dans 100 % des cas, avec des contours réguliers (88 %) et hypoéchogènes (75 %). La cytologie était classée dans la catégorie maligne (63 %) ou avec des atypies de signification indéterminée (37 %). De manière intéressante, la microbiopsie permettait en revanche constamment le diagnostic. Enfin, dans l’étude de Lee et al. (5), sur 10 cas, les nodules étaient ovales, solides, bien limités et sans microcalcifications (100 %), hypoéchogènes avec un halo (80 %). Le résultat cytologique était malin ou suspect de carcinome papillaire dans 80 % des cas.
Au cours des 15 dernières années, les TTH ont été considérées comme des lésions borderline à faible potentiel de malignité, plutôt que comme des adénomes bénins. Et cela en dépit du fait qu’aucune récidive n’ait été documentée en l’absence de caractère invasif au moment du diagnostic (6). Les réarrangements GLIS décrits par Nikiforova (2) ne sont pas observés dans les carcinomes papillaires, ou très rarement, ce qui plaide en faveur de la reclassification des TTH dans la catégorie des adénomes. Cela est cohérent avec l’aspect échographique EU-TIRADS 4 et l’absence de nodules EU-TIRADS 5 dans les TTH. En effet, les nodules de score EU-TIRADS 4 correspondent à des lésions peu agressives et rarement à des carcinomes papillaires de variante classique.
On a vu que l’étude cytologique était fréquemment mise en défaut. En pratique, dans le cas d’une discordance entre une lésion cytologiquement maligne ou suspecte de carcinome papillaire et un aspect échographique EU-TIRADS 4 comportant spécifiquement les caractéristiques décrites plus haut, il pourrait être intéressant de réévaluer le résultat cytologique. À l’inverse et surtout, un diagnostic cytologique évoquant une TTH alors que le score EU-TIRADS est 5 devrait également être considéré comme discordant.
En conclusion, les aspects échographiques décrits dans la littérature sont concordants avec ceux de notre série : les TTH sont des nodules de score EU-TIRADS 4 exclusivement solides et richement vascularisés.
Références bibliographiques
1. Carney JA et al. Hyalinizing trabecular adenoma of the thyroid gland. Am J Surg Pathol 1987;11: 583-91.
2. Nikiforova MN et al. GLIS Rearrangement is a Genomic Hallmark of Hyalinizing Trabecular Tumor of the Thyroid Gland. Thyroid 2019;29(2):161-73.
3. Jang H et al. Hyalinizing trabecular tumor of the thyroid: diagnosis of a rare tumor using ultrasonography, cytology, and intraoperative frozen sections. Ultrasonography 2016;35(2):131-9.
4. Choi WJ et al. The ultrasonography features of hyalinizing trabecular tumor of the thyroid gland and the role of fine needle aspiration cytology and core needle biopsy in its diagnosis. Acta Radiol 2015;56(9):1113-8.
5. Lee S et al. The ultrasonography features of hyalinizing trabecular tumor of the thyroid are more consistent with its benign behavior than cytology or frozen section readings. Thyroid 2011;21(3):253-9.
6. Carney JA et al. Hyalinizing trabecular tumors of the thyroid gland are almost all benign. Am J Surg Pathol 2008;32(12):1877-89.
Les auteurs déclarent ne pas avoir de liens d’intérêts en relation avec cet article.
Et si le cancer thyroïdien était comme le goitre multinodulaire : une porte d’entrée diagnostique pour le syndrome de prédisposition tumorale DICER1 ?
Isabelle Oliver-Petit
Unité d’endocrinologie, génétique, maladies osseuses et gynécologie de l’enfant, hôpital des enfants, CHU de Toulouse.
Le syndrome DICER1 se présente comme un spectre de tumeurs rares, bénignes et/ou malignes de l’enfant ou du sujet jeune qui s’est précisé et élargi ces dernières années.
Le gène DICER1 est exprimé de façon ubiquitaire : il code la protéine DICER1, une ribonucléase intervenant dans la régulation de l’expression de nombreux gènes, en particulier régulateurs de cancer, par le biais principalement d’une dysrégulation des micro-ARN matures. Dans le syndrome DICER1, les patients sont porteurs hétérozygotes au niveau constitutionnel d’un variant pathogène du gène DICER1 entraînant généralement une perte de fonction complète de la protéine ; au niveau tumoral, on observe une inactivation du second allèle. Le syndrome DICER1 entraîne donc une grande diversité de tumeurs : si on y trouve le classique pleuropneumoblastome du jeune enfant à l’origine de l’identification du syndrome, ou la tumeur ovarienne de type Sertoli-Leydig, il est reconnu aujourd’hui que la pathologie thyroïdienne en est l’expression phénotypique la plus fréquente avec le goitre multinodulaire (GMN), les nodules thyroïdiens du sujet jeune et, plus récemment confirmé, le cancer différencié de la thyroïde (CDT).
Depuis les premières descriptions cliniques du syndrome DICER1, le GMN est fréquemment associé au tableau clinique. Dans certaines familles porteuses de l’anomalie génétique, il peut même en être la seule expression phénotypique du syndrome (1). Ce n’est que fin 2015 que les premiers cas de CDT révélateurs de variants pathogènes constitutionnels de DICER1 chez des enfants et adolescents, avec ou sans GMN, ont été publiés. Les travaux récents rétrospectifs et prospectifs, comparant des cohortes de patients porteurs d’un variant pathogène constitutionnel de DICER1 à une population témoin, ont permis de mieux définir l’incidence et les modes d’expression de la pathologie thyroïdienne :
- l’incidence cumulée du GMN atteint chez la femme 50 % dès l’âge de 36 ans et 75 % à 40 ans si on associe le risque de GMN et le fait d’avoir subi une thyroïdectomie. Chez l’homme, l’incidence cumulée est plus faible (13 % et 17 %), mais cependant très significativement au-dessus de celle observée dans la population témoin. La recherche systématique d’un GMN clinique et échographique chez les sujets DICER1 asymptomatiques permet d’identifier une proportion plus importante de sujets porteurs de GMN que dans la population témoin, en particulier chez l’homme, mais aussi d’identifier des nodules thyroïdiens sans goitre, isolés ou multiples, faisant discuter l’intérêt de leur recherche systématique même en l’absence de signe d’appel (2) ;
- le nombre de cas de CDT rapportés à ce jour dans la littérature chez des patients ayant un variant pathogène constitutionnel de DICER1 est faible, concernant des enfants ou des sujets jeunes (toujours avant 40 ans). Tous sont des carcinomes différenciés, principalement papillaires, quelques-uns folliculaires, sans caractéristique notable tant dans leur présentation clinique, anatomopathologique ou évolutive. À partir des cohortes suivies, le risque théorique de CDT dans la population DICER1 par rapport à la population témoin semble multiplié par 16 (voire même par 24 si les thyroïdectomies précoces sont prises en compte dans le calcul) ;
- en revanche, il n’a pas été retrouvé de variant somatique ou constitutionnel de DICER1 dans les larges cohortes de CDT sporadiques de l’adulte.
Dans cet esprit, 2 équipes viennent de réaliser des travaux rétrospectifs sur des cohortes de tumeurs thyroïdiennes atteignant le sujet jeune ; J.D. Wasserman et al. (4) sur 30 cancers papillaires thyroïdiens (CPT) chez les moins de 18 ans, et A. Young (5) sur 15 cancers folliculaires thyroïdiens (CFT) chez les moins de 20 ans. Leur approche méthodologique était assez similaire : recherche systématique tissulaire et germinale d’altérations génétiques associées à ces formes de cancer thyroïdien du sujet jeune (par NGS ou whole exome sequencing). Les résultats sont assez stupéfiants mettant en évidence des variants pathogènes de DICER1 :
- 10 % des CPT ont des mutations somatiques, dont la moitié ont une mutation germinale ;
- 53 % des CFT ont des mutations somatiques, dont la moitié ont une mutation germinale.
Références bibliographiques
1. Oliver-Petit I et al. Multinodular goitre is a gateway for molecular testing of DICER1 syndrome. Clin Endocrinol (Oxf) 2019;91(5):669-75.
2. Reguerre Y et al. Syndrome associé aux variants pathogènes constitutionnels de DICER1 : où en sommes-nous en 2019 ? Bull Cancer, octobre 2019.
3. Schultz KAP et al. DICER1 and Associated Conditions: Identification of At-risk Individuals and Recommended Surveillance Strategies. Clin Cancer Res 2018;24(10):2251-61.
4. Wasserman JD et al. DICER1 Mutations Are Frequent in Adolescent-Onset Papillary Thyroid Carcinoma. J Clin Endocrinol Metab 2018;103(5):2009-15.
5. Young A et al. Predominant DICER1 Mutations in Pediatric Follicular Thyroid Carcinomas. ESPE (European Society for Paediatric Endocrinology) 2019, abstr. FC5.3.
D’après la communication orale de Cabanillas M, ESMO 2019, abstr. LBA93 (1)
Magali Haissaguerre
Service d’endocrinologie, diabétologie et nutrition, CHU de Bordeaux.
Le gène RET code pour un récepteur transmembranaire à activité tyrosine kinase qui est fréquemment altéré dans les carcinomes médullaires thyroïdiens (CMT), lié à des mutations dites activatrices responsables d’une prolifération cellulaire non contrôlée. Les mutations germinales de RET, présentes dans toutes les cellules de l’organisme, caractérisent les patients porteurs de NEM2A ou B. Plus de 60 % des CMT sporadiques, sans mutation germinale de RET, expriment une mutation activatrice de RET au niveau somatique tumoral.
Le proto-oncogène RET est également altéré dans certains cancers différenciés thyroïdiens (CDT) par un mécanisme différent dit de fusion du gène RET avec un autre gène, aboutissant à une protéine fonctionnelle parfois activée constitutionnellement. 10 à 20 % des CDT expriment des fusions de RET, en particulier avec le gène CCDC6 ou NCOA4. M. Cabanillas décrit également jusqu’à 17 % de mutations/fusions dans les carcinomes anaplasiques thyroïdiens (2).
Différentes thérapies ciblées inhibant RET existent, utilisant notamment le vandétanib et le cabozantinib qui disposent d’une AMM dans le traitement des CMT métastatiques progressifs (3, 4). Le LOXO-292 (selpercatinib) est un anti-RET en cours d’étude, caractérisé par son affinité hautement sélective pour RET, actif sur différentes mutations et fusions de RET, présentant une grande biodisponibilité, une bonne perméabilité vis-à-vis de la barrière hématoencéphalique et un faible risque d’interaction médicamenteuse par rapport à d’autres thérapies ciblées.
Les premiers résultats de l’étude internationale LIBRETTO-001 ont été présentés par M. Cabanillas en septembre 2019 à l’ESMO. Cette étude de phase I (escalade de dose ; 20 à 240 mg/j) et de phase II (expansion ; 160 mg/j) incluait 3 populations différentes de patients : 226 avaient un CMT muté RET, 27 un CDT avec fusion de RET et 253 étaient atteints de cancer bronchique avec fusion de RET. Parmi les patients ayant un CMT, 124 avaient été traités antérieurement par cabozantinib ou vandétanib, permettant d’étudier l’efficacité du médicament en 2e ligne d’anti-RET. Les 88 patients restants n’avaient jamais reçu de traitement par anti-RET. Tous les patients étaient progressifs à l’inclusion.
L’objectif principal de l’étude était d’évaluer la réponse objective selon les critères RECIST, les objectifs secondaires d’étudier la durée de la réponse, la survie sans progression et la tolérance du LOXO-292. L’étude est toujours en cours.
Les caractéristiques des 143 patients ayant un CMT muté RET étaient les suivantes : 55 prétraités par anti-RET et 88 naïfs d’anti-RET ; âge médian 57 ans ; 57 % de mutations RET au niveau du codon 918 ; 8 % de mutations RET au niveau du codon 804 ; 19 % au niveau d’une cystéine du domaine extracellulaire du récepteur et 16 % présentant des anomalies moléculaires variées.
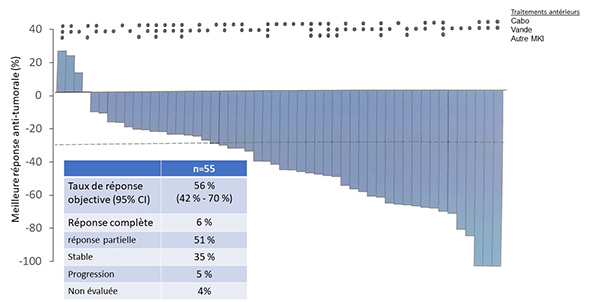
Chez les 53 patients traités antérieurement par anti-RET et donc en 2e ligne de traitement systémique, une réponse tumorale était observée dans 96 % des cas (figure 1) : 15 % de réponse complète ; 49 % de réponse partielle et 19 % de stabilisation. 13 % des patients ont progressé malgré le traitement. Une diminution de la calcitonine était observée chez 91 % des patients.
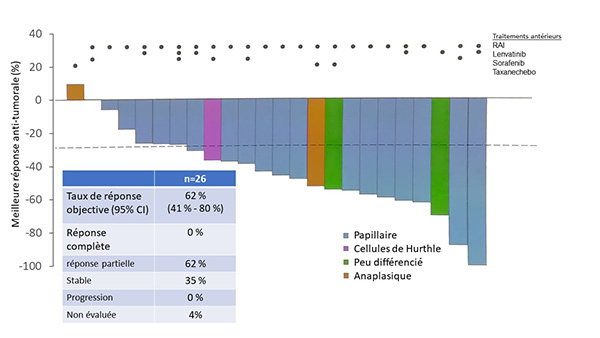
Les caractéristiques des 27 patients atteints de CDT présentant une fusion de RET étaient les suivantes : 52 % d’hommes ; 78 % de carcinomes papillaires ; 4 % à cellules de Hürthle ; 11 % peu différenciés et 7 % anaplasiques (n = 2). Les patients avaient été prétraités en moyenne par 3 thérapies systémiques (extrêmes : 1-7) ; 89 % par iode radioactif, 70 % par une autre thérapie et 48 % (n = 13) par lenvatinib ou sorafénib.
Sur le plan moléculaire, les tumeurs exprimaient 52 % de fusion de gène RET-CCDC6, 33 % de fusion de gène RET-NCOA4 et 15 % d’anomalies moléculaires autres variées.
Les résultats paraissent encourageants avec 62 % de réponse partielle et 35 % de stabilisation (figure 2). Aucun patient n’a progressé aux dernières nouvelles et 4 % n’étaient pas encore évaluables. Chez les 2 patients ayant un carcinome peu différencié, une réponse partielle était observée (-55 % et -73 %). Un patient atteint de cancer anaplasique a présenté une réponse partielle de -50 %, tandis que le 2e patient était stabilisé (+5 %). Le taux de réponse tumorale était évalué à 62 % au final. Néanmoins, la durée de suivi médiane n’était pas précisée (fin de recueil 17 juin 2019), ces données restent donc préliminaires.
Les données observées en termes de toxicité sont remarquables en raison du faible nombre de toxicité de grades 3 et 4 : HTA = 14 % (grade 3) ; cytolyse = 6 % (grade 3) et 1 % (grade 4). Les toxicités habituellement décrites étaient les suivantes : sècheresse buccale = 29 % (grade 1) ; diarrhée = 21 % (grade 1) et 8 % (grade 2) ; cytolyse hépatique = 17 % (grade 1) et 5 % (grade 2) ; asthénie = 15 % (grade 1) ; constipation = 19 % (grade 1) ; céphalées = 15 % (grade 1) ; œdèmes = 16 % (grade 1) et insuffisance rénale = 14 % (grade 1). Les toxicités de grade 2 étaient en général de 4 % environ. Seulement 1,7 % des patients ont dû arrêter le traitement en raison de la toxicité, ce qui représente un pourcentage plutôt bas pour une thérapie ciblée.
Les limites de cette étude sont : l’absence de données randomisées, le faible nombre de patients et la durée de suivi qui est réduite et imprécise (données préliminaires). Cette étude pose la question de la sélection des patients chez qui demander l’analyse moléculaire. Le coût de la molécule n’est pas précisé.
L’intérêt de l’étude est le taux de réponse tumorale qui est particulièrement élevé, la mise en évidence de l’excellente tolérance clinique et biologique ainsi que l’efficacité de la molécule en 2e ligne après échec d’une 1re ligne de traitement par vandétanib ou cabozantinib.
Lors de la discussion de ces premiers résultats, le Dr Enrique (Espagne) estime que cette molécule est particulièrement intéressante pour les cancers thyroïdiens liés à l’altération de RET, qu’il s’agisse de CMT ou de CDT. Ces données illustrent l’intérêt de rechercher systématiquement des anomalies moléculaires chez les patients atteints de cancer thyroïdien métastatique, progressif ou non progressif, mais avec un contingent histologique péjoratif (anaplasique ou peu différencié). Visiblement, les patients prétraités par vandétanib ou cabozantinib répondent aussi bien au LOXO-292 que ceux naïfs de tout traitement. La place de cet anti-RET, particulièrement attractif de par son efficacité antitumorale comparable aux molécules de référence (5, 6) et sa faible toxicité, reste à définir en 1re ou en 2e ligne et nécessite une validation en RCP Tuthyref (tumeurs thyroïdiennes réfractaires) car sa disponibilité est restreinte pour le moment (tableau).
Figure 1. Efficacité antitumorale du selpercatinib chez 55 patients ayant un carcinome médullaire thyroïdien muté RET.
Traitement |
Population de patients |
N |
% de patients pré-traités par ITK |
Taux de réponse objective |
Survie sans progression médiane (mois) |
% de réduction de dose pour toxicité |
|
|---|---|---|---|---|---|---|---|
MTC |
Vandetanib |
All Commers |
231 |
0 |
45 |
30,5 |
12 |
Cabozantinib |
All Commers |
219 |
20 |
28 |
11,2 |
16 |
|
Selpercatinib |
Mutant RET |
55 |
100 |
56 |
Pas atteinte après 11,1 |
1,7 |
|
Selpercatinib |
Mutant RET |
76 |
0 |
59 |
Pas atteinte après 5,7 |
1,7 |
|
BLU-667 |
Mutant RET |
32 |
100 |
56 |
Pas atteinte |
0 |
Des biais de comparaison liés à des essais de type cross-trials existent.
Références bibliographiques
1. Wirth L et al., Registrational Results of LOXO-292 in Patients with RET-Altered Thyroid Cancers, ESMO 2019, abstr. LBA93.
2. Kato S et al. RET Aberrations in Diverse Cancers: Next-Generation Sequencing of 4,871 Patients. Clin Cancer Res 2017;23(8):1988-97.
3. Wells SA Jr et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 2012;30(2):134-41.
4. Elisei R et al. Cabozantinib in progressive medullary thyroid cancer. J Clin Oncol 2013;31(29):3639-46.
5. Brose MS et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 2014;384(9940):319-28.
6. Schlumberger M et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 2015;372(7):621-30.
Clotilde Saïe, Camille Buffet
Unité fonctionnelle thyroïde, tumeurs endocrines, hôpital de la Pitié-Salpêtrière, Paris.
Des études montrent une augmentation des fausses couches et des naissances prématurées chez les femmes présentant des anticorps antithyroperoxydase positifs (anti-TPO+) (1). Cependant, les 3 essais randomisés concernant l’utilisation de la lévothyroxine chez ces femmes montraient des résultats discordants : 2 en faveur d’un bénéfice (2, 3) et 1 sans bénéfice retrouvé (4). Une nouvelle étude randomisée anglaise apporte de nouveaux éléments (5).
Dans 49 centres du Royaume-Uni, un dosage des anticorps anti-TPO et de la TSH était réalisé systématiquement chez des femmes âgées de 16 à 40 ans présentant des antécédents de fausses couches ou d’infertilité et ayant un désir de procréation. Les femmes en euthyroïdie (TSH : 0,44-3,68 mUi/L, T4 : 10-21 pmol/L) ayant des anticorps anti-TPO+ (selon les normes de chaque laboratoire) étaient ensuite randomisées selon un ratio 1:1 pour recevoir 50 µg de lévothyroxine ou le placebo avant la conception et pendant toute la durée de la grossesse. Le critère de jugement principal était la naissance d’un enfant vivant après 34 semaines de gestation (36 semaines d’aménorrhée).
Résultats
Le dépistage des anomalies thyroïdiennes a été réalisé chez 19 556 femmes entre décembre 2011 et janvier 2016. Les critères d’éligibilité étaient présents chez 1 420 d’entre elles et 952 ont accepté de participer à l’étude. Seulement 12 femmes (6 par groupe) ont été perdues de vue. Le taux d’enfants vivants nés après 34 semaines de gestation était de 37,4 % (176/470 femmes) dans le groupe sous traitement et de 37,9 % dans le groupe placebo (178/470 femmes), sans différence significative (risque relatif = 0,97 ; IC95 : 0,83-1,14 ; p = 0,74). En ne tenant compte que des femmes ayant obtenu une grossesse, ces taux étaient respectivement de 66,2 % (176/266 femmes) et 65 % (178/274). Il n’y avait pas de différence entre les sous-groupes, notamment chez les patientes ayant une TSH > 2,5 mUi/L ou celles présentant des taux d’anticorps très élevés. Concernant les critères de jugement secondaires, aucune différence entre les groupes n’a été retrouvée, en particulier pour le taux de fausses couches précoces ou tardives ainsi que pour les naissances avant terme.
En conclusion, chez des femmes euthyroïdiennes en période préconceptionnelle, ayant des antécédents de fausse couche et d’infertilité et des anti-TPO+, le traitement par lévothyroxine débuté avant la grossesse et poursuivi pendant toute la durée de la grossesse ne permettait pas d’augmenter le taux de naissances vivantes après 34 semaines de gestation.
Perspectives
Les dernières recommandations de l’American Thyroid Association (ATA) (6) ne statuaient pas sur l’intérêt d’un traitement par lévothyroxine chez les femmes enceintes ayant des anticorps anti-TPO+. Dans cette étude, publiée par le New England Journal of Medicine, le traitement par lévothyroxine était débuté avant la conception et poursuivi pendant toute la grossesse, sans bénéfice sur les paramètres analysés, ce qui ne semble pas en faveur d’une intervention thérapeutique (figure), dans cette situation. Toutefois, les auteurs n’ont pas analysé dans ce travail l’impact en termes de développement neurocognitif chez les nouveau-nés.
Figure. Indication de L-thyroxine pendant la grossesse d’après les recommandations 2017 de l’American Thyroid Association (6).
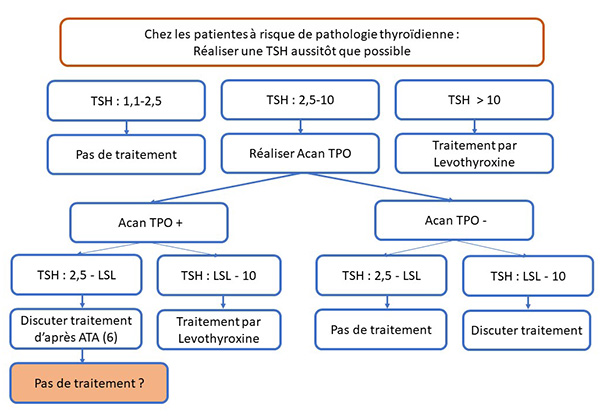
LSL : limite supérieure du laboratoire.
Références bibliographiques
1. Thangaratinam S et al. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence. BMJ 2011;342:d2616.
2. Negro R et al. Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications. J Clin Endocrinol Metab 2006;91(7):2587-91.
3. Negro R et al. Levothyroxine treatment in thyroid peroxidase antibody-positive women undergoing assisted reproduction technologies: a prospective study. Hum Reprod 2005;20(6):1529-33.
4. Wang H et al. Effect of Levothyroxine on Miscarriage Among Women With Normal Thyroid Function and Thyroid Autoimmunity Undergoing In Vitro Fertilization and Embryo Transfer: A Randomized Clinical Trial. JAMA 2017;318(22):2190-8.
5. Dhillon-Smith RK et al. Levothyroxine in Women with Thyroid Peroxidase Antibodies before Conception. N Engl J Med 2019;380(14):1316-25.
6. Alexander EK et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-89.
Les auteurs n'ont pas précisé leurs éventuels liens d’intérêts.
un marqueur prédictif de la thyroïdite du post-partum ?
Fritz-Line Velayoudom
Service d’endocrinologie-diabétologie, CHU de Guadeloupe, Pointe-à-Pitre.
La thyroïdite du post-partum (TPP) survient classiquement chez les femmes sans dysfonctionnement thyroïdien antérieur à la grossesse. C’est une pathologie auto-immune de novo qui apparaît dans l’année qui suit l’accouchement. Sa prévalence est de l’ordre de 5,1 %. Elle est augmentée chez les femmes qui ont d’autres pathologies auto-immunes comme le diabète de type 1 (1). Histologiquement, la TPP se caractérise par un infiltrat thyroïdien lymphocytaire. Biologiquement, elle se développe chez environ 30 à 50 % des femmes qui ont des anticorps antiperoxydase (Ac ATPO) et/ou antithyroglobuline (Ac ATG) pendant le premier trimestre de la grossesse. Le risque évolutif est celui de l’hypothyroïdie définitive qui est difficile à prédire et peut survenir dès la fin de la première année du post-partum (2).
L’identification des femmes à risque de TPP pourrait sans doute permettre de cibler aussi les femmes à risque d’hypothyroïdie définitive après l’accouchement.
Jusqu’ici, seul le dosage des Ac ATPO pendant le premier trimestre de la grossesse était l’outil de dépistage utilisé pour évaluer le risque de TPP et d’évolution vers l’hypothyroïdie définitive (1, 2). Cependant, les récentes recommandations américaines ne valident pas ce dosage en routine pour évaluer le risque de TPP (3). De même, l’hypoéchogénicité de la thyroïde avait été évoquée comme marqueur échographique prédictif du risque d’hypothyroïdie définitive, mais les résultats sont controversés.
Une équipe italienne a évalué la valeur prédictive des anticorps dirigés contre les hormones thyroïdiennes (AcHT) sur le risque de TPP (4). Dans les modèles expérimentaux de thyroïdite auto-immune, ces AcHT sont directement dirigés contre les épitopes iodés de la thyroglobuline et leur présence précède celle des anticorps ATPO et ATG. Chez les sujets souffrant d’hypothyroïdie, ces AcHT étaient détectés à des concentrations 10 fois plus élevées que chez les sujets sans hypothyroïdie, évoquant leur implication non seulement dans la survenue de thyroïdite auto-immune mais aussi des dysfonctionnements de la thyroïde (5). Parmi ces AcHT, les IgM anti-T3, les IgG anti-T3 et les IgM anti-T4 sont détectés au premier trimestre de la grossesse, alors que les IgG anti-T4 sont détectables en fin de grossesse.
Dans cette étude, l’objectif était d’évaluer la valeur prédictive des AcHT comparée à celle des ATPO et des ATG, et à l’hypoéchogénicité thyroïdienne concernant le risque de TPP.
Étaient incluses les femmes ayant une grossesse unique et sans antécédent de thyropathie. Les dosages de la TSH, des T4 et T3 libres étaient réalisés à l’entrée de l’étude (7-11 semaines de grossesse), aux deuxième et troisième trimestres de la grossesse, puis 4 fois en post-partum (à la 6e semaine, aux 3e, 6e et 12e mois), et en présence de symptômes de dysfonctionnement thyroïdien. Un dosage radio-immunologique était utilisé pour quantifier les AcHT.
Résultats
Les données de suivi de 412 femmes, d’âge moyen 31,6 ± 4,3 ans ont été analysées. Les AcHT étaient détectés initialement chez 21 femmes (5,1 %), et plus fréquemment retrouvés chez celles qui allaient développer une TPP comparées aux autres (19 versus 2,6 % ; p = 4,6 × 10−8).
Les AcHT étaient détectés chez 11,8 % des femmes qui avaient des ATPO ou des ATG positifs contre 3,5 % chez les autres (p = 0,0031). Chez les femmes ayant des AcHT positifs et des ATPO et/ou des ATG positifs, on notait l’apparition d’une TPP dans 100 % des cas. La fréquence des AcHT était de 8,3 % chez les femmes montrant des signes échographiques de thyroïdite contre 3,4 % chez les autres (p = 0,029).
Globalement, les AcHT étaient détectés chez 8,5 % des femmes ayant soit des signes échographiques de thyroïdite auto-immune, soit des ATPO ou des ATG positifs contre 3,1 % chez les femmes pour qui les 3 examens étaient négatifs (p = 0,016). Chez ces femmes ayant des AcHT, la TPP apparaissait chez 76,9 % des patientes qui avaient au moins 1 des 3 autres tests (Ac ATPO, Ac ATG ou hypoéchogénicité) positifs contre 12,5 % chez celles ayant des tests négatifs (p = 0,0075).
Discussion
C’est la première étude qui évalue les AcHT dans une cohorte de femmes en cours de grossesse, dès le premier trimestre, et leur valeur prédictive du risque de TPP. Environ 33 à 50 % des femmes qui ont ces AcHT développent une TPP, de façon similaire à ce qui est décrit dans la littérature avec les ATPO. De plus, la prédictivité de ces AcHT pour l’hypothyroïdie définitive est de 42,9 %, alors qu’elle est de 41,1 % pour les ATPO et de 37,9 % pour les ATG (6). Même si la positivité des AcHT est plus spécifique que celle des ATPO et des ATG, leur plus faible sensibilité exclut leur utilisation en tant que marqueur de la TPP.
Le dosage des AcHT pourrait être utile pour les femmes en cours de grossesse ayant des ATPO et/ou des ATG positifs (≥ 101 U/mL, pour une plage de référence de 0-100), ce qui correspond dans cette étude à 18,4 % de la cohorte. En effet, 100 % des femmes positives pour les 3 marqueurs (AcHT, ATPO, ATG) ont développé une TPP, et 90 % d’entre elles, une hypothyroïdie définitive.
Points forts de l’étude :
- première étude sur la valeur prédictive des AcHT sur le risque de TPP et son évolution vers l’hypothyroïdie définitive pendant la grossesse ;
- chez ces femmes qui ont un risque de TPP, le répertoire des AcHT est similaire à celui des femmes qui ne sont pas enceintes, mais qui ont un diagnostic d’hypothyroïdie ou de maladie de Basedow. Il n’est donc pas surprenant que les AcHT confèrent un risque d’hypothyroïdie définitive de 75 % chez les femmes avec TPP, plus élevé que chez les femmes sans AcHT.
Les limites de l’étude sont l’absence de dosage répété des AcHT à différentes périodes de la grossesse et du post-partum, le budget ne permettant qu’un nombre limité de prélèvements biologiques.
En conclusion, la positivité des AcHT pendant la grossesse augmente considérablement le risque de TPP observé en présence d’ATPO ou d’ATG. Cependant, la faible fréquence de détection des AcHT pendant la grossesse (5,1 %) et leur faible sensibilité (17,5 %) ne permettent pas leur utilisation comme marqueurs prédictifs de TPP.
Références bibliographiques
1. Stagnaro-Green A. Approach to the patient with postpartum thyroiditis. J Clin Endocrinol Metab 2012;97:334-42.
2. Nguyen CT, Mestman JH. Postpartum Thyroiditis. Clin Obstet Gynecol 2019;62:359-64.
3. Alexander EK et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-89.
4. Benvenga S et al. Assessment of serum thyroid hormone autoantibodies in the first trimester of gestation as predictors of postpartum thyroiditis. J Clin Transl Endocrinol 2019;18:100201.
5. Benvenga S, Trimarchi F. Thyroid hormone autoantibodies in Hashimoto's thyroiditis: often transient but also increasingly frequent. Thyroid 2003;13:995-6.
6. Benvenga S et al. Relatively high rate of postpartum thyroiditis in the Straits of Messina area. Predictivity of both postpartum thyroiditis and permanent hypothyroidism by performing, in the first trimester of gestation, thyroid ultrasonography and measurement of serum thyroperoxidase and thyroglobulin autoantibodies. J Clin Transl Endocrinol 2018;15:12-8.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Stéphanie Espiard
Service d’endocrinologie, diabétologie, métabolisme et nutrition, hôpital Huriez, CHRU de Lille.
Chez un sujet normal, la majorité de la T4 est sécrétée directement par la thyroïde, tandis que 20 % de la T3 est sécrété directement par la glande et 80 % provient de la conversion périphérique de la T4 en T3 par les désiodases.
Plusieurs équipes, notamment celle de M. Ito de l’hôpital Kuma à Kobe au Japon, se sont aussi posé la question des niveaux de T3L chez les sujets substitués par L-thyroxine après thyroïdectomie totale ou irathérapie. Dans leur série de 135 patients opérés pour un carcinome thyroïdien papillaire, ils ont montré que seuls les patients avec une TSH modérément freinée (0,03 < TSH ≤ 0,3 mUI/L) sous L-thyroxine avaient des concentrations de T3L similaires à celles en préopératoire, alors que les patients avec une TSH normale (0,3 < TSH ≤ 5) présentaient une T3L discrètement abaissée (1). Ces résultats ont été observés par d’autres équipes.
Récemment, M. Ito et al. ont montré qu’il en était de même chez les patients présentant une atrophie thyroïdienne après irathérapie pour maladie de Basedow (2). Dans une série de 313 patients présentant une atrophie thyroïdienne et nécessitant une substitution par L-thyroxine 1 an après un traitement par iode radioactif, les patients avec une TSH normale avaient une T3L significativement plus basse que ceux ayant une TSH modérément freinée, alors que le volume thyroïdien et la dose de L-thyroxine n’étaient pas différents entre les groupes. Les patients avec une TSH normale avaient une T3L significativement plus faible que des sujets contrôles appariés pour l’âge, le sexe et l’IMC, alors que ceux ayant une TSH modérément freinée avaient une T3L comparable aux sujets contrôles. Par ailleurs, les patients avec un volume thyroïdien résiduel < 10 mL avaient des niveaux de T3L inférieurs aux sujets contrôles, alors qu’ils étaient comparables pour les patients ayant un volume thyroïdien > 10 mL, suggérant que la perte de la sécrétion thyroïdienne de T3L contribue à la baisse de la T3L.
Si la concentration de T3L ne reflète pas forcément les concentrations intratissulaires en T3, de manière intéressante il avait été montré chez le rat thyroïdectomisé et substitué par T4L que les concentrations tissulaires de T3 ne se normalisaient pas dans les tissus périphériques (3). M. Ito et al. ont étudié les marqueurs d’imprégnation périphérique en hormone thyroïdienne dans leur série de patients opérés pour un carcinome thyroïdien papillaire. Seuls les patients ayant une TSH entre 0,03 et 0,3 ainsi qu’une T3L équivalente à celle en préopératoire avaient des marqueurs revenant à la normale (4).
Une substitution excessive en hormone thyroïdienne n’est néanmoins pas sans risque, comme l’ont montré les publications sur l'hyperthyroïdie infraclinique et le risque de fibrillation atriale d’une part et sur le traitement freinateur par L-thyroxine et le risque de perte osseuse d'autre part (5). À l’heure actuelle, la preuve d’un réel bénéfice à ramener la T3L à un niveau équivalent à des sujets non thyroïdectomisés ou sans atrophie thyroïdienne n’a pas encore été apportée. Ainsi, les sociétés savantes ne recommandent pas une cible de TSH dans les limites inférieures pour la substitution (6).
Références bibliographiques
1. Ito M et al. TSH-suppressive doses of levothyroxine are required to achieve preoperative native serum triiodothyronine levels in patients who have undergone total thyroidectomy. Eur J Endocrinol 2012;167(3):373-8.
2. Ito M et al. Serum Thyroid Hormone Balance in Levothyroxine Monotherapy-Treated Patients with Atrophic Thyroid After Radioiodine Treatment for Graves' Disease. Thyroid 2019;29(10):1364-70.
3. Escobar-Morreale HF et al. Replacement therapy for hypothyroidism with thyroxine alone does not ensure euthyroidism in all tissues, as studied in thyroidectomized rats. J Clin Invest 1995;96(6):2828-38.
4. Ito M et al. Biochemical Markers Reflecting Thyroid Function in Athyreotic Patients on Levothyroxine Monotherapy. Thyroid 2017;27(4):484-90.
5: Taylor PN et al. Clinical review: A review of the clinical consequences of variation in thyroid function within the reference range. J Clin Endocrinol Metab 2013;98(9):3562-71.
6. Jonklaas J et al. Guidelines for the treatment of hypothyroidism: prepared by the American thyroid association task force on thyroid hormone replacement. Thyroid 2014;24(12):1670-751.
L’auteur n’a pas précisé ses éventuels liens d’intérêts.
|
Anne Bachelot Service d’endocrinologie et médecine de la reproduction, IE3M, Centre de référence des maladies endocriniennes rares de la croissance et du développement, Centre de maladies gynécologiques rares, Institute of Cardiometabolism and Nutrition, ICAN, hôpital de la Pitié-Salpêtrière, Paris. |
Chers collègues,
Nous avons le plaisir de vous présenter cette nouvelle newsletter Reproduction qui prend donc le chemin d’un rendez-vous annuel, ce dont nous nous félicitons.
L’année 2019 a été riche en publications sur la reproduction, et nombre d’entre elles sont notamment parues dans des journaux très prestigieux. Nous vous proposons tout d’abord 2 articles qui témoignent d’avancées scientifiques qui pourraient avoir de grandes répercussions thérapeutiques pour nos patients. Le premier, à partir d’un travail publié dans la revue Science, apporte pour la première fois la preuve de concept de la réussite, tant sur le plan hormonal que fonctionnel, d’une autogreffe de tissu testiculaire immature cryopréservé chez le macaque, à l’origine d’une naissance vivante. Dans un tout autre registre, le deuxième article, à partir d’un texte publié dans la revue Nature Medicine, apporte la preuve de concept du traitement de la vaginose bactérienne par transplantation intravaginale de microbiote. Enfin, un troisième article, à partir d’une publication du New England Journal of Medicine, vient conclure le débat sur l’intérêt ou non d’un traitement par progestérone intravaginale en cas de saignement au premier trimestre de la grossesse.
Nous espérons que vous prendrez autant de plaisir à lire cette newsletter que nous en avons eu à l’écrire, nous vous souhaitons de belles fêtes de fin d’année et vous donnons rendez-vous l’année prochaine pour une nouvelle newsletter Reproduction !
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Virginie Grouthier
Service d’endocrinologie, hôpital Haut-Lévêque, CHU de Bordeaux, Pessac.
Le pronostic des cancers de l’enfant s’est nettement amélioré ces dernières années, affichant plus de 80 % de taux de survie chez ces patients. 30 % d’entre eux seront infertiles à l’âge adulte, conséquence des traitements anticancéreux. La préservation de la fertilité est devenue une bonne pratique médicale à proposer avant l’instauration de ces traitements. Or chez les jeunes garçons, la congélation de sperme n’est pas une option possible. Avant la puberté, il est donc proposé une congélation du tissu testiculaire. Cependant, à l’heure actuelle, aucune utilisation de tissu testiculaire humain congelé n’a encore été rapportée. En revanche, des résultats prometteurs de transplantation et maturation in vitro de cellules spermatogoniales souches ont été obtenus chez les animaux. En effet, des greffes de tissu testiculaire immature, contenant ces cellules souches de différentes espèces animales (souris, porcs, chèvres, lapins, hamsters, chiens, chats, chevaux, bovins, singes), sous la peau de souris immunodéficientes ont permis d’obtenir une spermatogenèse, voire une progéniture vivante (chez les souris, les porcs et les singes). Cependant, d’un point de vue éthique, cette technique de xénogreffe n’est pas possible chez l’homme. Seules 3 études de greffe autologue de tissu testiculaire immature chez des primates non humains sont rapportées dans la littérature, mais les résultats sont mitigés (récupération faible des greffons cryopréservés (5 %), spermatogenèse complète dans 13 à 17 % des cas uniquement). De plus, la capacité de fertilité de ces spermatozoïdes n’a pas été testée.
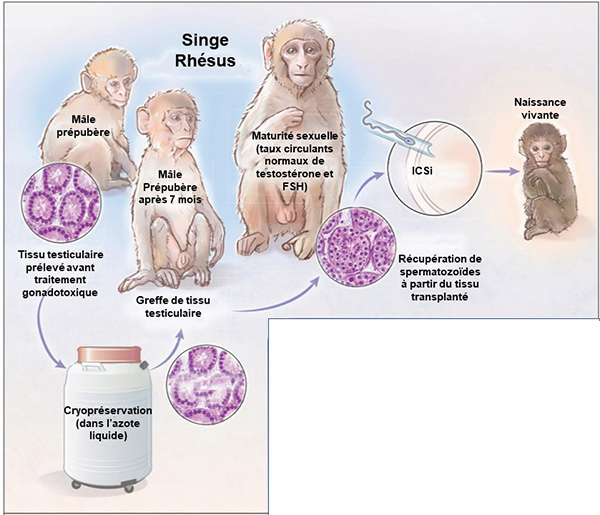
Une étude récente, publiée dans la revue Science, a apporté la preuve de concept que l’autogreffe de tissu testiculaire immature cryopréservé, chez le macaque rhésus, pouvait être réalisée et permettait à la fois une reprise de la fonction testiculaire endocrine et exocrine ainsi qu’une récupération de spermatozoïdes avec une capacité de fertilité conservée (1).
En effet, l’équipe de Pittsburgh de Kyle E. Orwig a réalisé l’étude suivante : 5 macaques rhésus prépubères ont subi une orchidectomie unilatérale (cryopréservation du tissu testiculaire prépubère), puis bilatérale 5 à 7 mois plus tard. Le tissu testiculaire a ensuite été greffé soit après décongélation soit directement en frais sous la peau au niveau dorsal ou scrotal de chaque animal. L’ensemble de ces tissus testiculaires était bien immature après vérification par analyse histologique et immunofluorescence, avec présence uniquement de cellules souches et spermatogonies B visualisées dans les tubes séminifères et absence de spermatides. Les premiers résultats ont été analysés après quelques mois.
Cliniquement, on note l’apparition de masses palpées au niveau du site du greffon à la fois au niveau dorsal et scrotal, sans différence sur leur taille selon qu’il s’agissait d’un greffon frais ou cryopréservé.
La fonction endocrine de ce tissu testiculaire greffé était évaluée par le taux de testostérone circulant qui a bien augmenté comme attendu, sans différence avec le taux des macaques adultes témoins. Le taux de FSH des macaques castrés puis greffés était également identique à celui des adultes sains, ce qui prouve le bon fonctionnement de l’axe hypothalamo-hypophyso-testiculaire.
Concernant la fonction exocrine, qui a particulièrement intéressé les auteurs, il a été mis en évidence :
- la multiplication par 5 du poids de chaque greffon, qu’il y ait eu ou non congélation tissulaire. En revanche, les greffons récupérés au niveau scrotal étaient plus gros que ceux au niveau dorsal. Quoi qu’il en soit, des tubes séminifères ont été observés dans tous les greffons ;
- une spermatogenèse complète dans tous les tubes séminifères sans distinction sur la localisation du greffon ni sur la cryopréservation ;
- une récupération de spermatozoïdes vivants dans la majorité des greffons (26/32), qu’ils soient cryopréservés ou non, au niveau dorsal ou scrotal. La numération des spermatozoïdes variait de de 21 à 60 millions de spermatozoïdes par greffe ;
- une bonne capacité de fertilité des spermatozoïdes récupérés après dissection. Des fécondations in vitro avec ICSI ont été réalisées, totalisant 138 œufs fécondés. 28 % d’entre eux (soit 39) ont atteint le stade 2 cellules, puis 41 % de ces embryons (soit 16) ont évolué jusqu’au stade blastocyste. Bien que le taux de clivage 2 cellules soit inférieur à celui attendu pour une FIV ICSI chez le macaque rhésus, le pourcentage d’embryons atteignant le stade blastocyste était finalement équivalent ;
- une naissance d’un bébé macaque rhésus bien portant (poids de naissance et score APGAR normaux) après le transfert de 11 blastocystes au total chez 6 macaques femelles. Le développement comportemental de ce bébé macaque était sans anomalie à 3 et 6 mois.
Ce travail complet sur les greffes autologues de tissu testiculaire immature est la preuve qu’une récupération fonctionnelle du tissu testiculaire cryopréservé est possible à la fois sur le plan endocrine, mais également exocrine. Évidemment, cette approche reste expérimentale, mais elle ouvre théoriquement le champ à une utilisation future possible de sperme à partir de tissus testiculaires prépubères humains cryoconservés (par exemple, pour les survivants de cancer infantile). Un des points forts de l’étude, en plus de la taille importante des greffons par rapport aux études précédentes (respectivement 9 à 20 mm3 versus 0,5 à 1 mm3) est l’utilisation de concentration de DMSO (diméthylsulfoxyde) identique à celle utilisée pour la FIV chez l’humain. En effet, les conditions de milieu de culture de cette étude sont proches de celles utilisées dans la pratique humaine. Cependant, il est important de rester prudent car, dans le cas de l’homme, les tissus testiculaires prélevés avant le traitement d’un cancer pourraient héberger des cellules malignes, en particulier dans le cadre d’une leucémie, d’un lymphome ou d’un cancer du testicule chez l'enfant. En revanche, la greffe de tissu testiculaire autologue pourrait être intéressante pour les jeunes patients bénéficiant d’une greffe de moelle osseuse pour des affections non malignes (par exemple, β-thalassémie, drépanocytose) ou atteints de tumeurs solides ne métastasant pas dans les testicules. Ces résultats encourageants doivent être modérés car les auteurs ont reconnu que les animaux utilisés étaient initialement prévus pour une autre étude utilisant une chimiothérapie (busulfan). Les auteurs se justifient néanmoins en précisant que la chimiothérapie n’a probablement pas affecté leurs résultats puisque les greffons des animaux greffés ont quand même produit des spermatozoïdes et un bébé macaque.
En conclusion, la preuve de concept de la récupération fonctionnelle complète du tissu testiculaire cryopréservé après autogreffe a donc été objectivée chez le primate non humain (figure). Des études complémentaires, en particulier chez l’homme, sont évidemment nécessaires pour améliorer cette procédure, mieux en comprendre sa portée et ses conséquences.
Figure. Stratégie pour la préservation de la fertilité masculine : autogreffe de tissu testiculaire immature cryopréservé chez le macaque rhésus permettant la récupération d’une fonction endocrine et exocrine testiculaire (d’après Ogawa T (2)).
Références bibliographiques
1. Fayomi AP et al. Autologous grafting of cryopreserved prepubertal rhesus testis produces sperm and offspring. Science 2019;363(6433):1314-19.
2. Ogawa T. Live Offspring after Testis Tissue Transplantation. N Engl J Med 2019;381(15):1477-79.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Nicolas Chevalier
Département d’endocrinologie et de diabétologie, médecine de la reproduction, hôpital de l’Archet, CHU de Nice.
Le microbiote a déjà été mis à toutes les “sauces”, ou presque. Il en manquait une : le vagin…
Les lactobacilles, qui colonisent de manière commensale le vagin, ont pour fonction de contrôler le pH local préservant ainsi la muqueuse vaginale et évitant le développement de bactéries ou de levures responsables d’infections. Lorsque leur nombre diminue, il survient une vaginose bactérienne dont les signes cliniques sont des leucorrhées, le plus souvent malodorantes, récidivantes, entraînant des complications parfois dramatiques au cours de la grossesse. En cas de récidive, le seul traitement proposé est une antibiothérapie sur le long terme, mais qui peut elle-même être à l’origine de mycoses récidivantes. Une alternative proposée consiste à apporter des probiotiques (lactobacilles), mais cela reste d’une efficacité très modérée.
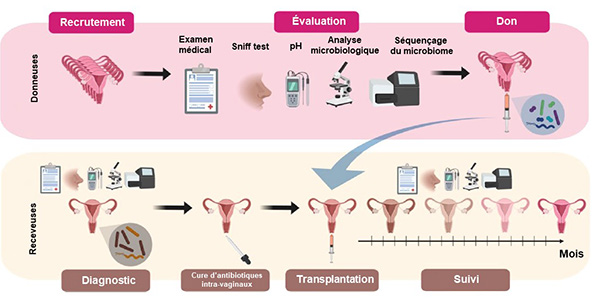
Partant du constat qu’une seule espèce de lactobacilles n’était pas suffisante, l’équipe d’A. Lev-Sagie a testé, chez des patientes ayant des vaginoses bactériennes récidivantes, un modèle de transplantation de microbiote à partir de donneuses en bonne santé (1). Après une cure d’antibiotiques administrés par voie intravaginale pendant une durée variable (5 à 7 jours), des sécrétions vaginales ont été recueillies quotidiennement pour servir de vecteur à la transplantation de microbiote vaginal prélevé chez une donneuse “saine” après séquençage de l’ADN ribosomal 16S. La transplantation était effectuée dans le cul-de-sac vaginal postérieur.
Les receveuses ont été suivies toutes les semaines pendant 1 mois, puis tous les mois, pour certaines jusqu’à 21 mois après la transplantation de microbiote (figure). Sur les 5 patientes traitées (27-47 ans), après 1 à 3 transplantations, 4 ont eu une amélioration totale de leur symptomatologie et durable sur le long terme. La cinquième patiente a récidivé lors de la prise d’antibiotiques pour un problème infectieux ORL. Elle a bénéficié d’une nouvelle transplantation au décours qui a permis d’amender la vaginose bactérienne. L’analyse des bactéries montre, après transplantation, une augmentation significative des lactobacilles et une diminution des bifidobactéries (dont Gardnerella).
Ces résultats, très limités, constituent cependant une avancée très importante dans la prise en charge des vaginoses bactériennes récidivantes. Néanmoins, la mise en place de la transplantation intravaginale de microbiote va se heurter à quelques problèmes, et non des moindres à contourner :
- la possible translocation de bactéries multirésistantes (car pas de culture préalable) ;
- mais surtout l’apport de spermatozoïdes depuis la donneuse, avec un risque de grossesse (contrôlable par une contraception), mais aussi de séroconversion virale non identifiable par les seules sérologies de la donneuse.
Figure. Modèle de transplantation intravaginale de microbiote (d'après Lev-Sagie A et al. (1)).
Référence bibliographique
1. Lev-Sagie A et al. Vaginal microbiome transplantation in women with intractable bacterial vaginosis. Nat Med 2019. doi: 10.1038/s41591-019-0600-6. [Epub ahead of print]
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Tiphaine Le Poulennec
Endocrinologie et médecine de la reproduction, hôpital de la Pitié-Salpêtrière, Paris.
Une grossesse sur 5 se termine par une fausse couche. Les fausses couches ont un fort impact psychologique et peuvent provoquer des saignements excessifs nécessitant des gestes chirurgicaux. Quel traitement pourrait améliorer cette issue ? La progestérone, produite par le corps jaune, sert à préparer l’endomètre à l’implantation. Elle supprime les contractions utérines et pourrait avoir un rôle dans la prévention du rejet de l’embryon. Il est suggéré que la sécrétion inadéquate de progestérone par le corps jaune pourrait être une cause de fausse couche. Le traitement par progestérone pourrait alors prévenir la perte de grossesse spontanée.
Dans le cas de femmes ayant des antécédents de fausses couches à répétition inexpliquées, l’équipe de Coomarasamy (1) a réalisé une étude incluant 836 patientes. Le bénéfice du traitement par progestérone par voie vaginale versus placebo au cours du premier trimestre de grossesse n’a pas été démontré en termes de naissances vivantes (65,8 % dans le groupe supplémenté par progestérone versus 63,3 % dans le groupe placebo, sans différence significative).
Une étude de la Cochrane de 2018 (2) a également évalué dans 11 essais la supplémentation par progestérone chez 2 359 femmes ayant fait des fausses couches inexpliquées à répétition. Elle montre que le traitement par progestérone diminuerait probablement le risque de fausse couche (RR = 0,69 ; IC95 : 0,51-0,92). L’étude en sous-groupes mettait en évidence un effet plus prononcé chez les femmes ayant eu 3 fausses couches ou plus, mais il existait une hétérogénéité dans les groupes.
Qu’en est-il des patientes présentant une menace de perte de grossesse spontanée ?
Une autre revue de la Cochrane de 2018 (3) a examiné l’intérêt de la supplémentation par progestérone chez ces femmes. Sept essais randomisés ont été analysés, incluant 696 patientes. Leur conclusion était qu’un traitement par progestérone réduirait probablement le risque de fausse couche par rapport au placebo (OR = 0,64 ; IC95 : 0,47-0,87). Cependant, il s’agissait d’essais comprenant de petits effectifs.
Au regard de ces résultats, l’ACOG (American College of Obstetricians and Gynecologists) conclut que l’usage de la progestérone dans les menaces de fausses couches est controversé, mais aurait un bénéfice au cours du premier trimestre de la grossesse chez les femmes ayant eu 3 fausses couches.
Coomarasamy et al. (4) ont publié en mai 2019 les résultats d’un essai multicentrique randomisé, en double aveugle, contrôlé versus placebo, s’intéressant au traitement par progestérone versus placebo et à l’incidence des naissances vivantes chez les femmes présentant des saignements en début de grossesse.
Les femmes, recrutées dans 48 hôpitaux du Royaume-Uni, étaient âgées de 16 à 39 ans, présentaient des saignements, étaient à moins de 12 semaines de grossesse et avaient un sac intra-utérin visible à l’échographie. Elles recevaient soit un traitement par progestérone micronisée qui était auto-administré par voie vaginale à la dose de 400 mg × 2/j soit le placebo, jusqu’à 16 semaines de grossesse.
L’étude a inclus 4 153 patientes entre mai 2015 et juillet 2017. Les données ont pu être évaluées pour 2 025 patientes du groupe progestérone et 2 013 sous placebo. Les caractéristiques des patientes étaient les suivantes : âge moyen 30,5 ans, IMC à 26,5 kg/m2, 55 % sans antécédent de fausse couche, 25 % nullipares et 7 % ayant eu 3 fausses couches.
En intention de traiter, l’incidence d’accouchement après 34 semaines de grossesse était de 75 % dans le groupe progestérone versus 72 % pour le placebo (RR = 1,08 ; IC95 : 1,00-1,07 ; p = 0,08).
L’étude en sous-groupes suggérait que les patientes ayant eu plus de 3 fausses couches auraient un taux de naissances vivantes de 72 % dans le groupe progestérone versus 57 % pour le placebo (p = 0,007).
Cette étude, incluant un nombre important de patientes, renforce l’idée qu’il n’y a pas de bénéfice à traiter les patientes par progestérone intravaginale en cas de saignement au premier trimestre de la grossesse.
Références bibliographiques
1. Coomarasamy A et al. A randomized trial of progesterone in women with recurrent miscarriages. N Engl J Med 2015;373(22):2141-8.
2. Haas DM et al. Progestogen for preventing miscarriage in women with recurrent miscarriage of unclear etiology. Cochrane Database Syst Rev 2018;10:CD003511-CD003511.
3. Wahabi HA et al. Progestogen for treating threatened miscarriage. Cochrane Database Syst Rev 2018;8:CD005943.
4. Coomarasamy A et al. A randomized trial of progesterone in women with bleeding in early pregnancy. N Engl J Med 2019;380(19):1815-24.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 Paris– Courriel : webmaster@sfendocrino.org


