
Accédez au site  |
Thyroïdologie : du crétinisme à l’excipient. Le poids de l’histoire
Jean-Louis Wémeau, Lille.
Dans cette treizième Lettre de la thyroïde, Jean-Louis Schlienger souligne que la fonction de la thyroïde a été reconnue tardivement, bien après sa découverte et la description du crétinisme, et que les médecins ont eu beaucoup à apprendre des chirurgiens. Oublier la traditionnelle scintigraphie thyroïdienne de nos pratiques est une erreur, ce que démontrent Hervé Monpeyssen, dans l’exploration des nodules cytologiquement indéterminés, et Edouard Ghanassia, en matière d’hyperthyroïdies basedowiennes prolongées et réfractaires, expliquant leur liaison avec le syndrome de Marine-Lenhart. Ceci n’est pas en contradiction avec la découverte de nouveaux acteurs de la tumorogenèse thyroïdienne, marqueurs diagnostiques, pronostiques et cibles thérapeutiques potentielles des cancers thyroïdiens, ce que suggère l’équipe de Lionel Groussin.
Récemment remise en cause par le rituximab (actif sur les lymphocytes CD20), la primauté du traitement glucocorticoïde de l’orbitopathie basedowienne est maintenant contestée aussi par le teprotumumab (un anticorps monoclonal inhibiteur de l’IGF1), qui constitue une alternative thérapeutique prometteuse des atteintes inflammatoires d’intensité modérée, comme l’indique Fritz-Line Velayoudom. À moins que l’avenir appartienne à des associations thérapeutiques, actives sur les différentes cibles impliquées dans la pathogénie complexe des orbitopathies ? Bousculant les dogmes, F.-L. Velayoudom, à partir d’un article du New England Journal of Medicine, remet aussi en question l’opportunité d’assurer un abaissement du taux de la TSH en-dessous de 2,5 mU/l dès le début et tout au long de la grossesse.
Voici qu’est critiquée aussi la validité des immunodosages. La simple interférence de la biotine (une vitamine !) peut réduire la TSH, accroître les valeurs mesurées des hormones thyroïdiennes libres et même des titres d’anticorps antirécepteurs de TSH, simulant en tout point la maladie de Basedow. Ces données sont précisées et explicitées par Michèle d’Herbomez et sa collaboratrice, qui n’écartent pas une interférence possible dans d’autres dosages. Cela conforte l’idée que les explorations ont pour intention première de confirmer un diagnostic évoqué cliniquement.
Le traitement par l’hormone thyroïdienne a permis l’éradication du crétinisme goitreux. L’actuel feuilleton médiatique ne doit pas conduire à désespérer ni à penser que maintenant, définitivement, son nouvel excipient rende crétin. Lisez, méditez plutôt, pour votre instruction, les excellentes narrations des rédacteurs de la treizième Lettre de la thyroïde, et retenez les vraies leçons de l’histoire en marche de la thyroïdologie.
L’auteur déclare avoir des liens d'intérêts avec HAC Pharma, Genévrier, Ipsen, Merck Serono, et Novartis.

L’émergence tardive de l’insuffisance thyroïdienne
Jean-Louis Schlienger, faculté de médecine de Strasbourg.
Décrite par Vésale en 1543, la thyroïde est restée sans emploi jusqu’à la fin du XIXe siècle. En 1829 encore, le grand Bichat affirmait que la “thyroïde est un des organes dont les usages nous sont absolument inconnus”. C’est à Sir William W. Gull (1816-1890), Londonien au moins aussi célèbre pour ses aphorismes que pour ses travaux cliniques, que l’on doit la première description de l’insuffisance thyroïdienne en 1873 : “Un état crétinoïde survenant chez les femmes à l’âge adulte […] avec un œdème dur siégeant surtout à la face et aux extrémités des membres et un état intellectuel rappelant celui du crétinisme (1).” En 1874, le Bernois Emile Kocher (1842-1917), grand maître ès thyroïdectomie, décrit chez une jeune fille connue pour son allant et sa gaieté l’installation quelques semaines après l’intervention d’une cachexia strumapriva associant une grande paresse et des modifications de l’état mental. L’observation initiale passa inaperçue, et ce n’est qu’une dizaine d’années après que le chirurgien genevois Jacques-Louis Reverdin rapporta sa propre expérience des complications tardives de la chirurgie thyroïdienne et incita Kocher à publier une série de 30 cas de cachexia strumapriva associant un myxœdème et un “crétinisme”. Le terme de myxœdème avait été créé en 1878 par William M. Ord (1834-1902), qui constata que l’œdème avait pour particularité de “rendre peu d’eau” et de contenir une substance chimique à type de mucine (2). Pour autant, son étiologie restait inconnue. En 1883, Sir Felix Semon (1849-1921) affirma que le syndrome post-opératoire de Kocher était la conséquence de l’absence de thyroïde, ce qui lui valut les sarcasmes de ses collègues (3). Cette approche fut confirmée peu après par la vénérable Clinical Society de Londres dont, il est vrai, Ord était alors le président.
Du côté français, il fallut attendre 1880 pour que Gilbert Ballet (1853-1912), interne dans le service de Jean-Martin Charcot (1825-1893) et futur aliéniste de renom, publie le premier cas de myxœdème (4), que son maître, alerté dès 1875 par les descriptions d’un médecin de la campagne bretonne, Auguste Morvan (1819-1897), désignait sous le terme de “cachexie pachydermique” (5).
La construction laborieuse de l’entité “insuffisance thyroïdienne” est le fruit de la rencontre des médecins qui interprétaient les signes – myxœdème et crétinisme – et des chirurgiens qui les reproduisaient à loisir. L’efficacité des injections d’extrait thyroïdien démontrée par le Gallois George R. Murray (1865-1939) [6] acheva de consolider cette nouvelle maladie en donnant enfin son rôle plein et entier à la thyroïde, que Gilbert Ballet résumait ainsi en 1895 : “Il se formerait dans l’organisme une substance toxique que neutraliserait la sécrétion thyroïdienne physiologique. L’extirpation ou la destruction du corps thyroïde permet l’accumulation dans le corps [d’une] substance qui cesse alors d’être neutralisée. Telle est la condition pathogénique du myxœdème.” Il ne restait plus qu’à découvrir les hormones thyroïdiennes (7).
Références bibliographiques
- Gull WW. On a cretinoid state supervening in adult life in women. Trans Clin Soc Lond 1873-1874;7:180-5.
- Ord WM. On Myxoedema, a term proposed to be applied to an essential condition in the “cretinoid” affection occasionally observed in middle-aged women. Med Chir Trans 1878;61:57-78.
- Semon F. Discussion of myxoedema. Br Med J 1883;2:1072-3.
- Ballet G. Cachexie pachydermique (myxœdème des auteurs anglais). Progres Med 1880;8:605-6.
- Morvan A. Contribution à l’étude du myxœdème en Basse Bretagne. Gazette hebdomadaire de médecine et de chirurgie. 1881;18(série2)(34):542-5.
- Murray GR. Note on the treatment of myxoedema by hypodermic injections of an extract of the thyroid gland of a sheep. Br Med J 1891;2:796-7.
- Schlienger JL. Le centenaire de la thyroxine. Lettre de la thyroïde 2015.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec l'article.

Haro sur le nodule !
Hervé Monpeyssen, Paris.
Madame M. a 44 ans et réside dans le Sud-Est asiatique. Des nodules thyroïdiens ont été décrits à l’âge de 25 ans (sa mère présente aussi des nodules). Elle décrit depuis peu une gêne épisodique à la déglutition. La fonction thyroïdienne est normale, les taux d’anticorps antithyroïdiens sont à des valeurs indétectables. Avec le temps, les nodules progressent en nombre et en volume, surtout l’un d’eux, localisé en basilobaire droit.
Échographie initiale : au sein d’une thyroïde mesurant 57 x 14 x 20 et 57 x 14 x 19 mm, normoéchogène et multimicronodulaire, ce nodule est décrit comme solide, avec composante kystique et calcifications (pas de score TIRADS ni Doppler). Mesures : 19 x 16 x 31 mm.
Conclusion : goitre multinodulaire avec de nombreux nodules : adénomes et kystes colloïdes. Un volumineux nodule calcifié en basilobaire droit.
Une cytoponction est préconisée. Elle est réalisée (aiguilles 23 gauges avec anesthésie locale 5 ml de xylocaïne). Le résultat est atypie de signification indéterminée (Bethesda 3).
Un chirurgien est consulté, qui recommande une thyroïdectomie, considérant le nodule suspect en échographie et cytologie.
Une nouvelle échographie est réalisée 4 mois plus tard. Le nodule mesure 28 x 18 x 16 mm. Pas de score TIRADS. Conclusion : pas de modification de volume.
Une nouvelle cytoponction est pratiquée (aiguilles 23 et 21 gauges). Résultat : Bethesda 1.
Une endocrinologue est consultée. Ses conclusions sont les suivantes : goitre multinodulaire avec frottis Bethesda 3. Les échographies successives montrent des zones échogènes dues à des microcalcifications ou à des kystes colloïdes. Pour déterminer l’activité des cellules, il est recommandé de pratiquer un TEP-FDG et décider ainsi d’une éventuelle thyroïdectomie.
Lors de notre rencontre :
- TSH : 1,46 ;
- T4L : 0,88 ng/ml ;
- T3L : 2,64 pg/ml ;
- aucune doléance cervicale.
On réalise une nouvelle échographie avec la caractérisation suivante :
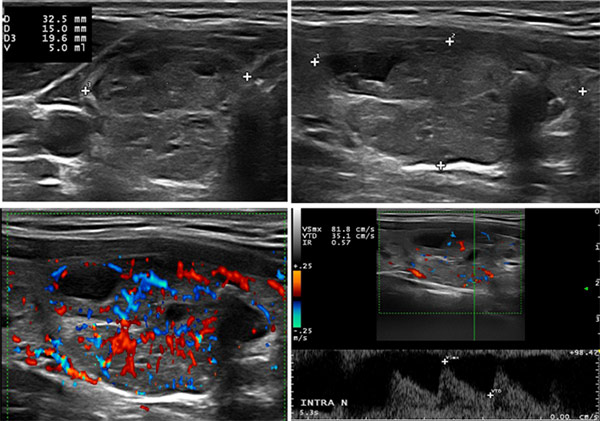 |
|---|
Mode B |
Ce nodule est scoré TIRADS 4 du fait de sa très discrète hypoéchogénicité. Sa riche vascularisation doit faire envisager une formation autonome même si la TSH est médiane de normalité, mais avec un taux prédominant de T3L.
Compte rendu de scintigraphie : image scintigraphique confirmant l’existence d’un nodule hyperfonctionnel autonome du pôle inférieur du lobe thyroïdien droit.
Commentaires
- Cette patiente n’a pas de goitre. Si l’on applique la formule du calcul du volume, il est strictement normal pour une Caucasienne (8,3 + 8,1 = 16,4 ml).
- On ne peut juger de l’évolution d’un volume qu’après l’avoir calculé avec la formule ad hoc.
- On ne doit pas utiliser de termes histologiques dans un compte rendu d’échographie.
- L’utilisation d’aiguilles de fort calibre va à l’encontre d’une cellularité satisfaisante. Pour la cytoponction thyroïdienne, il faut utiliser des aiguilles fines de 27 G.
- La cytologie thyroïdienne n’analyse pas des frottis, mais des étalements ou le produit de centrifugation de phases liquides.
- Les cytologies Bethesda 3 sont majoritairement bénignes (dans 85-95 % des cas).
- La réalisation d’un TEP FDG aurait sans doute montré une zone de fixation (aspect commun dans les nodules fonctionnels) et renforcé à tort la suspicion de malignité. Cet examen n’a sa place dans aucun consensus concernant les nodules thyroïdiens, car la méta-analyse des études publiées a indiqué sa faible valeur dans la reconnaissance ou l’exclusion de la malignité.
- Au sens propre, la scintigraphie a révélé un captage préférentiel de l’isotope au niveau du nodule, mais nullement son caractère hyperfonctionnel, ni autonome (ce qu’à ce stade pourrait, seule, affirmer l’absence de réduction de la fixation sous freinage hormonal : classique test de Werner, ce qui n’a strictement aucun intérêt pratique et ne doit pas être réalisé).
Conclusion : nodule captant dont la sécrétion ne dépasse pas les besoins de l’organisme (TSH normale). Pas d’indication à reponction ni de TEP FDG ni de chirurgie. Le risque évolutif est celui de l’apparition un jour ou l’autre d’une hyperthyroïdie (adénome toxique de Plummer).
On propose une surveillance biologique biannuelle (TSH +/- T3L), d’éviter les surcharges iodées, d’envisager un traitement radiométabolique lorsque la TSH viendra à décroître.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec l'article.
Le syndrome de Marine-Lenhart : au plus près de l'actualité 106 ans plus tard
Edouard Ghanassia, endocrinologue-échographiste, Sète.
Comment peut se présenter un syndrome de Marine-Lenhart ?
Une patiente de 60 ans consulte pour un état thyrotoxique sans orbitopathie, avec un goitre de volume modéré sans nodule palpable. La TSH est effondrée, T3L et T4L sont accrus, comme le titre des anticorps antirécepteurs de TSH à 5,2 (N < 1,5).
À l’échographie, elle présente un parenchyme typique de maladie de Basedow (images 1 et 2) ainsi qu’un nodule hypoéchogène dont les vélocités internes sont très élevées (image 3). La scintigraphie révèle une fixation diffuse de la thyroïde, se renforçant au niveau du nodule en faveur d’un syndrome de Marine-Lenhart. La nécessité d’un traitement radical du fait de la présence d’un adénome toxique est expliquée à la patiente. Elle fait la demande, atypique, d’un traitement différentiel des 2 composantes pour tenter de conserver sa fonction thyroïdienne. Elle opte pour une lobectomie emportant l’adénome toxique (d’histologie bénigne) avec poursuite du traitement médical de la maladie de Basedow, lequel sera interrompu après 6 mois. Avec un recul de 9 ans, elle apparaît actuellement en euthyroidie, sans traitement substitutif et satisfaite d’avoir pu bénéficier de la décision thérapeutique concertée.
En quoi son diagnostic présente-t-il un intérêt ?
Le syndrome de Marine-Lenhart (SML) est défini comme l’association, au sein du même parenchyme, d’une maladie de Basedow et d’un nodule autonome. Selon les études, 2 à 4 % des maladies de Basedow correspondraient à des SML. Deux points sont essentiels à comprendre :
- il s’agit d’une forme de maladie de Basedow qui ne guérira pas sans traitement radical si une part importante de la thyrotoxicose est due au nodule ;
- si un traitement radical est indiqué, un SML devra faire discuter de modalités particulières, tant dans le choix de la technique que dans la conduite pratique.
Un petit historique
Dans l’article princeps de 1911, 2 chirurgiens américains de Cleveland (Ohio), David Marine et Carl H. Lenhart, ont rapporté l’observation de nodules hautement concentrés en iode chez 8 patients opérés pour goitres exophtalmiques (1). Les descriptions ultérieures à partir des années 1940 et 1970 ont intégré des données morphologiques et fonctionnelles avec la description chez des sujets atteints de maladie de Basedow de nodules parfois considérés comme froids en scintigraphie, mais se révélant autonomes et hyperfonctionnels après traitement médical de la maladie, responsables d’une hyperthyroïdie persistante.
La fin des années 1960 a marqué un tournant dans l’existence du SML. En 1969, l’American Thyroid Association l’a reconnu comme une forme particulière de maladie de Basedow (2). En 1972, N. David Charkes a publié un article remarquable dans le Journal of Nuclear Medicine dans lequel, non content d’enrichir la sémiologie de ses très élégants travaux de scintigraphie quantifiée, il l’a baptisé officiellement, soixante ans plus tard, du nom de ses 2 inventeurs (3). La description s’est encore enrichie avec l’arrivée de l’échographie, reflétant la passionnante évolution des techniques diagnostiques et thérapeutiques en thyroïdologie (4-8).
Comment en faire le diagnostic ?
Il ne se conçoit qu’en présence d’un syndrome de thyrotoxicose.
La présentation clinico-biologique associe la sémiologie classique des 2 composantes à des degrés variables. Le risque est alors de méconnaître le nodule si l’on se fie à la seule palpation.
La présentation échographique, à l’instar de la clinique, associe la sémiologie des 2 composantes à des degrés variables (images 1 à 3). Au Doppler pulsé avec correction d’angle d’un Basedow, les vitesses systoliques atteignent et dépassent 1 m/s avec des débits au-delà de 150 ml/mn. Les nodules sont généralement bien visualisés, mais la sémiologie évocatrice de leur nature autonome est difficile à mettre en évidence du fait de l’interférence de la composante basedowienne.
La présentation scintigraphique (image 4) permet le diagnostic à condition que l’examen soit quantifié : l’intensité de fixation dépend du statut iodé, de l’activité des anticorps thyréostimulants pour la composante Basedow et de l’activité du récepteur de TSH muté pour la composante nodulaire. C’est tout l’intérêt de la scintigraphie quantifiée : le nodule peut apparaître isocontrasté, hypocontrasté ou hypercontrasté au sein d’un parenchyme hyperfixant. Il ne faut pas commettre l’erreur de considérer comme définitivement froid un nodule hypocontrasté. En cas de doute, la réévaluation doit se faire sous traitement par antithyroïdien de synthèse. Ces derniers ne modifient pas “per se” l’intensité de fixation mais entraînent souvent une baisse de l’activité auto-immune stimulante, révélant le caractère hypercontrasté du nodule (9).
Les recommandations actuelles permettent-elles de ne pas passer à côté du SML ?
La coexistence d’un nodule thyroïdien et d’une TSH basse pose l’indication de scintigraphie en première intention avant de discuter la cytoponction (consensus SFE 2012 des nodules thyroïdiens). Nous insistons sur le bien-fondé de cette recommandation qui permet, sous réserve de la quantification, d’évaluer l’ensemble du parenchyme.
Encore faut-il être au fait de la présence du nodule… Or, si l’on s’en tient à l’actuel consensus de la SFE tel qu’il est formulé pour les hyperthyroïdies, la triade femme jeune (< 40 ans) + goitre homogène à la palpation + orbitopathie suffit à porter le diagnostic de maladie de Basedow, et l’utilisation de l’échographie n’est pas clairement recommandée.
Ainsi, selon nous, l’échographie devrait être systématiquement recommandée dans la démarche initiale et la surveillance, du fait d’un quadruple intérêt :
- elle confirme le goitre en évaluant le volume thyroïdien avec précision ;
- elle permet le dépistage de nodules occultes : il ne s’agit pas de surdiagnostic puisque, selon sa nature, le nodule est susceptible de modifier le schéma diagnostique et thérapeutique ;
- chaque étiologie a une sémiologie échographique propre, permettant de se passer d’autres examens ;
- l’évolution des débits et des vitesses circulatoires représente, à côté du taux de TRAK, un paramètre fort pour évaluer, en fin de traitement médical, le risque de rechute.
Quelles sont les conséquences pratiques de sa méconnaissance ?
Le traitement médical seul, souvent indiqué en première intention, sera poursuivi durant 12 à 18 mois. Si les effets secondaires en sont rares, bien que parfois graves, il n’est pas de bonne pratique d’imposer au patient des contraintes et de nourrir un espoir de traitement conservateur en pure perte.
Si un traitement radical est requis, la thyroïdectomie totale traite les 2 composantes. En revanche, l’IRA-thérapie nécessite des doses plus importantes (jusqu’à 85 % de plus que pour chacune des 2 composantes) [9].
Enfin, cela empêche la décision éclairée du patient, qui peut vouloir choisir un traitement séparé des 2 composantes dans le but de maintenir l’autarcie de sa fonction thyroïdienne : traiter le nodule toxique par lobectomie et attendre la rémission de la composante Basedow ou opter dans un second temps pour une IRA-thérapie à dose curative.
Quelles leçons devons-nous en tirer ?
- Connaître cette entité et se souvenir qu’elle peut concerner jusqu’à 4 % des cas de maladie de Basedow.
- Recommander la pratique d’une échographie dans la démarche initiale.
- Recommander la pratique d’une scintigraphie quantifiée (en insistant sur une quantification de qualité) dès lors que coexistent nodule et TSH basse.
- Individualiser les traitements à partir d’un diagnostic thyroïdologique complet, précis et assuré, en fonction du choix des patients.
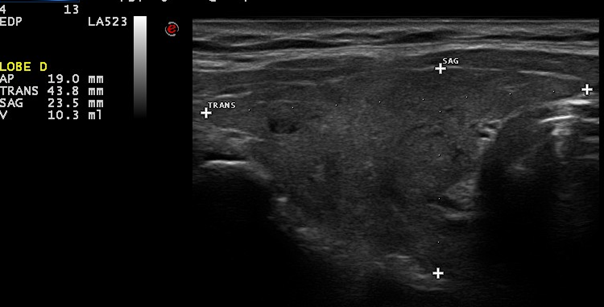
Image 1. Goitre modéré, hypoéchogène, homogène, finement réticulé.
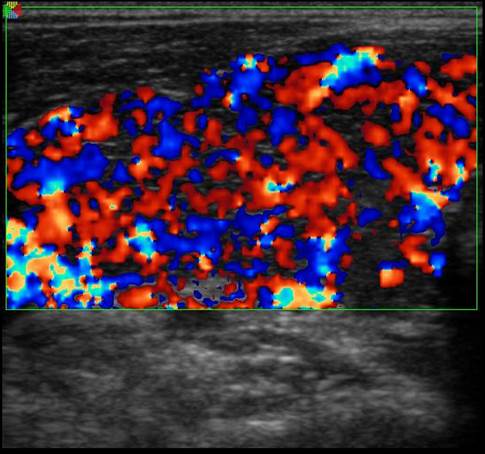
Image 2. Hypervascularisation diffuse de type IV (“thyroid inferno”).
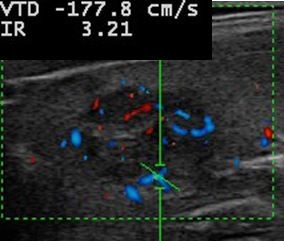
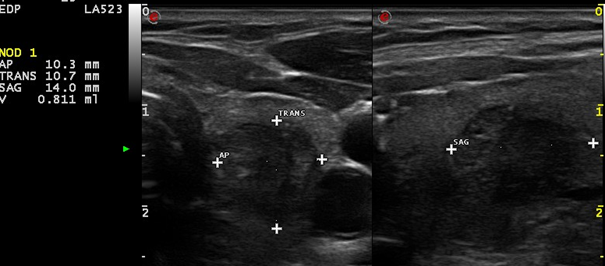
Image 3. Nodule du pôle supérieur du lobe gauche, vélocités intranodulaires élevées (1,8 m/s).
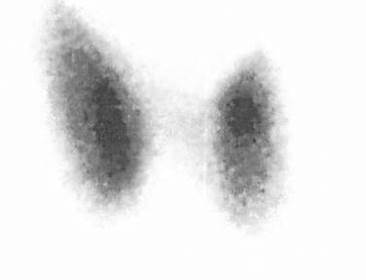
Image 4. Hyperfixation globale et diffuse avec hyperfixation localisée du pôle supérieur du lobe gauche correspondant au nodule N1. Dans ce contexte d’hyperthyroïdie à TRAK positifs, le tableau scintigraphique évoque un syndrome de Marine-Lenhart.
Références bibliographiques
- Marine D, Lenhart CH. Pathological anatomy of exophthalmic goitre. Arch Intern Med 1911;8(3):265-316.
- Werner SC. Classification of thyroid disease. Report of the Committee on Nomenclature. The American Thyroid Association. J Clin Endocrinol Metab 1969;29(6):860-2.
- Charkes ND. Graves’ disease with functioning nodules (Marine-Lenhart syndrome). J Nucl Med 1972;13(12):885-92.
- El-Kaissi S, Kotowicz MA, Goodear M, Wall JR. An unusual case of Marine-Lenhart syndrome. Thyroid 2003;13(10):993-4.
- Cakir M. Diagnosis of Marine-Lenhart syndrome. Thyroid 2004;14(7):555.
- Braga-Basaria M, Basaria S. Marine-Lenhart syndrome. Thyroid 2004;14(12):1107.
- Cakir M. Marine-Lenhart syndrome. J Natl Med Assoc 2005;97(7):1036-8.
- Joven MH, Anderson RJ. Marine-Lenhart syndrome. Endocrine 2015;49(2):570-1.
- Chatzopoulos D, Iakovou I, Moralidis E. Marine-Lenhart syndrome and radioiodine-131 treatment. Thyroid 2007;17(4):373-4.
L’auteur n'a pas précisé ses éventuels liens d'intérêts.

ATXN7, EIFAX1, MED12, RBM10, etc. : nouveaux acteurs de la tumorigenèse thyroïdienne
Anne-Cécile Paepegaey et Lionel Groussin, service d’endocrinologie et de maladies métaboliques de l’hôpital Cochin, Paris.
Dans la lignée du travail du Cancer Genome Atlas (TCGA) publié en 2014 (1), 2 articles récents mettent en avant de nouveaux acteurs de la cancérogenèse thyroïdienne.
Le travail de Montero-Conde et al. (2) a permis l’identification de nouveaux gènes de la tumorigenèse thyroïdienne en utilisant la méthode de “Sleeping Beauty transposon system” dans un modèle murin présentant une mutation activatrice de l’oncogène HRAS. Dans ce modèle, l’expression endogène du mutant de RAS n’est pas suffisante pour induire des tumeurs thyroïdiennes. Cette méthode permet d’inactiver de façon aléatoire différents gènes et d’identifier ainsi ceux qui coopèrent avec RAS pour induire un cancer. Dans leur étude, cette méthode a induit une augmentation significative de cancers thyroïdiens peu différenciés. Quarante-cinq gènes candidats ont ainsi été identifiés. Ces gènes sont pour la plupart ceux déjà retrouvés dans l’étude d’une large séries de cancers thyroïdiens peu différenciés ou anaplasiques (3). Une partie de ces gènes est en lien avec la voie de la PI3 kinase, avec notamment un nombre important de mutations de PTEN. De façon intéressante, l’autre partie des gènes a un rôle dans le remodelage de la chromatine. Les auteurs ont notamment identifié un nouveau gène : ATXN7, codant pour l’ataxin 7, une sous-unité très conservée du complexe de modification de la chromatine. Il module l’acétylation des histones et l’ubiquitination. Les mutations germinales de ce gène sont responsables du syndrome d’ataxie spinocérébelleuse de type 7 (avec rétinopathie pigmentaire). Il est intéressant de noter que les mutations somatiques observées dans les cancers thyroïdiens sont dans la même région que les mutations germinales responsables de l’ataxie spinocérébelleuse : un domaine polyglutamine. Ces mutations sont fréquemment associées aux mutations de RAS ou de NF1. Les études fonctionnelles de ces mutations montrent une majoration de la prolifération cellulaire.
Un second travail de séquençage apporte des données intéressantes sur les acteurs responsables de formes agressives (4). L’étude regroupait 57 cancers thyroïdiens ayant conduit au décès du patient : 22 tumeurs bien différenciées et 35 tumeurs peu différenciées. Le séquençage de ces tumeurs retrouve une très forte prévalence de mutations somatiques du promoteur TERT (60 % des cas). Pour rappel, ces mutations étaient retrouvées dans 73 % des cancers anaplasiques et dans 9 % des cancers papillaires dans la série du TCGA (4). Les autres mutations somatiques fréquentes étaient les mutations de BRAF V600E (40 %), les mutations de NRAS et HRAS (25 et 4 %) et les mutations d’EIFAX1. Ces dernières étaient présentes dans 12 % des cas, souvent associées à RAS, alors qu’elles ne sont présentes que dans 1 % de l’ensemble des cancers papillaires. Ces résultats montrent une similitude génétique entre ces cancers non anaplasiques, mais fatals, et les cancers thyroïdiens anaplasiques.
Par ailleurs, les auteurs identifient 2 nouveaux gènes qui n’avaient jusqu’à présent pas été décrits comme jouant un rôle dans la tumorigenèse thyroïdienne : MED12 et RBM10. Le gène MED12 est muté chez 14 % des patients et présente toujours la mutation G44C. Il est localisé sur le chromosome X et joue un rôle dans l’initiation de la transcription de l’ADN. Sa mutation a déjà été décrite dans les cancers de la prostate, les leucémies lymphoïdes chroniques et les léiomyosarcomes utérins. Dans l’étude, ces mutations étaient mutuellement exclusives avec TERT ou BRAF. Le gène RBM10 est muté chez 11 % des patients. Il participe à l’épissage des préARNm. Sa mutation a déjà été décrite dans les tumeurs hématologiques malignes. Dans cette cohorte, la mutation de RBM10 est liée à un moins bon pronostic.
Cette étude a également permis d’identifier 2 nouveaux gènes de fusion : DLG5-RET et OSBPL1A-BRAF.
Enfin, de nombreuses altérations épigénétiques ont été retrouvées sur les gènes du remodelage de la chromatine ou sur des histones méthyl-transférases. Cette importance des gènes du remodelage de la chromatine est concordante avec ce qui est décrit dans l’étude sur le modèle murin muté pour HRAS.
Ces nouvelles données permettent de mieux comprendre la tumorigenèse thyroïdienne et d’envisager de nouveaux marqueurs pronostiques et de nouvelles thérapies ciblées.
Références bibliographiques
- Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014;159(3):676-90.
- Montero-Conde C, Leandro-Garcia LJ, Chen X et al. Transposon mutagenesis identifies chromatin modifiers cooperating with Ras in thyroid tumorigenesis and detects ATXN7 as a cancer gene. Proc Natl Acad Sci USA 2017;114(25):E4951-60.
- Landa I, Ibrahimpasic T, Boucai L et al. Genomic and transcriptomic hallmarks of poorly differentiated and anaplastic thyroid cancers. J Clin Invest 2016;126(3):1052-66.
- Ibrahimpasic T, Xu B, Landa I et al. Genomic alterations in fatal forms of non-anaplastic thyroid cancer: identification of MED12 and RBM10 as novel thyroid cancer genes associated with tumor virulence. Clin Cancer Res 2017.
Anne-Cécile Paepegaey et Lionel Groussin déclarent ne pas avoir de liens d’intérêts en relation avec l'article.

Le teprotumumab comme traitement de l’orbitopathie basedowienne
Fritz-Line Velayoudom, CEPHISE (service d’endocrinologie, diabète et maladies métaboliques), CHU de Pointe-à-Pitre, Guadeloupe.
Les mécanismes physiopathologiques impliqués dans la survenue de l’orbitopathie basedowienne (OB) ne sont pas encore complètement identifiés. Peu d’études prospectives randomisées contre placebo ont pu confirmer l’efficacité et l’innocuité des traitements médicaux actuellement disponibles. Parmi ceux-ci, la corticothérapie à forte dose, seule ou associée à la radiothérapie, est la plus utilisée (1-3). Elle est efficace sur la réduction des signes inflammatoires de l’OB active mais n’agit que partiellement sur l’exophtalmie avec des effets indésirables non négligeables. Des alternatives thérapeutiques devraient y remédier. En dehors de l’inflammation, des mécanismes auto-immuns sont décrits dans la survenue de l’OB. Les anticorps antirécepteurs de la TSH sont exprimés au niveau du tissu orbitaire mais ne sont pas observés chez tous les sujets avec OB, ce qui suggère leur implication dans l’OB mais aussi le rôle d’autres antigènes. Des immunoglobulines qui activent le récepteur de l’Insuline Like Growth Factor I (IGF-IR) ont été mises en évidence chez les sujets avec maladie de Basedow (MB). L’IGF-IR est un récepteur membranaire d’activité tyrosine kinase qui intervient dans le développement et le métabolisme des cellules, en particulier dans la régulation auto-immune. Il est exprimé par les fibroblastes orbitaires et les lymphocytes T et B des sujets avec MB (4-6). Dans des études in vitro sur des fibroblastes orbitaires, l’inhibition de IGF-IR atténuait l’action de l’IGF-I, de la TSH et des immunoglobulines stimulant la thyroïde. Ces résultats ont conduit à l’utilisation du teprotumumab, un anticorps monoclonal humain anti IGF-IR (R1507) chez les sujets avec une OB active modérée ou sévère.
L’objectif de l’étude de T.J. Smith et al. était de déterminer l’efficacité et la sécurité du teprotumumab chez les sujets avec une OB active modérée à sévère (score d’activité clinique [SAC] ≥ 4) [7].
Méthode
L’étude était multicentrique (15 centres), randomisée et contrôlée en double aveugle (ratio de randomisation 1/1). N’étaient pas exclus les sujets traités par corticothérapie orale (dose cumulée ≤ 1 g de méthylprednisolone), après une période de “wash-out” de 6 semaines. Le suivi était réalisé toutes les 3 semaines pendant 24 semaines, avec une évaluation de l’efficacité à 6, 12, 18 et 24 semaines. La première perfusion était de 10 mg/kg, puis les autres de 20 mg/kg. Le critère de jugement principal était la réduction ≥ 2 points du SAC et une réduction ≥ 2 mm de l’exophtalmie à 24 semaines validant la réponse clinique. Les critères secondaires incluaient les mesures de l’exophtalmie, du score d’activité clinique, le questionnaire de qualité de vie spécifique à l’OB (GO-QOL) et les effets indésirables.
Résultats
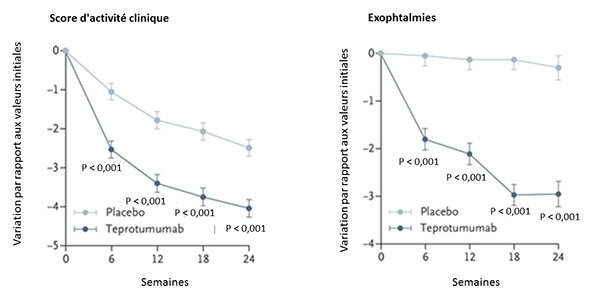
Quatre-vingt-sept sujets étaient randomisés pour recevoir le teprotumumab (T) ou le placebo (P) administré en i.v. toutes les 3 semaines pour un total de 8 séances. La réponse clinique était observée chez 69 % des sujets traités par le T (29/42) et chez 20 % des sujets sous P (9/45), p < 0,001. L’effet thérapeutique était rapide : 43 % des sujets sous T versus 4 % sous P après 6 semaines (p < 0,001). Cette différence augmentait avec le temps (cf. courbes ci-dessous). Après 24 semaines, 40 % des sujets traités pas T avaient une réduction ≥ 4 mm de l’exophtalmie versus 0 % sous P. La qualité de vie semblait s’améliorer avec une augmentation du score de satisfaction après T de 12,8 à 15,6 points. Le T ne modifiait pas les concentrations sériques des interleukines 6, 16 et de RANTES (Regulated on Activation, Normal T cell Expressed and Secreted). En revanche, les anticorps stimulant la thyroïde et les inhibiteurs de la thyrotropine diminuaient dans les 2 groupes (de 15 à 30 %). Le seul effet indésirable du traitement était l’hyperglycémie chez les sujets diabétiques, contrôlable après adaptation du traitement antidiabétique. Des effets indésirables graves étaient notés dans 12 % des cas sous T (diarrhée et confusion) versus 2 % sous P.
Discussion
L’étude rapporte une réduction significative de l’exophtalmie et de l’inflammation chez les sujets avec OB active traités par T, soulignant le rôle possible de cette molécule sur les mécanismes inflammatoires et immunitaires impliqués dans l’OB. L’effet sur l’exophtalmie est proche de celui de la chirurgie et évoque le rôle possible du T sur la graisse et les muscles orbitaires. Les mécanismes précis devront être étudiés. Cette molécule semble plus efficace que la corticothérapie ou le rituximab (8) sur le SAC et l’exophtalmie. Cependant, elle nécessite une surveillance de la glycémie chez le sujet diabétique. L’inclusion uniquement de forme active d’OB avec SAC ≥ 4 est une des limites de l’étude, il n’y a pas d’évaluation des sujets avec une OB moins active ou stable. De plus, l’évaluation à 6 mois est courte et un suivi à 1 an est nécessaire. Une autre limite est l’absence d’imagerie orbitaire, ne permettant pas d’évaluer les modifications du tissu orbitaire sous T.
Conclusion
Chez les sujets avec OB active, le tetropubumab est plus efficace que le placebo en termes de réduction de l’exophtalmie et du score d’activité clinique avec peu d’effets indésirables. Il semble une alternative possible au traitement utilisé classiquement.
Références bibliographiques
- Bartalena L, Krassas GE, Wiersinga W et al. Efficacy and safety of three different cumulative doses of intravenous methylprednisolone for moderate to severe and active Graves’ orbitopathy. J Clin Endocrinol Metab 2012;97(12):4454-63.
- Tanda ML, Bartalena L. Efficacy and safety of orbital radiotherapy for Graves’ orbitopathy. J Clin Endocrinol Metab 2012;97(11):3857-65.7.
- Marcocci C, Bartalena L, Tanda ML et al. Comparison of the effectiveness and tolerability of intravenous or oral glucocorticoids associated with orbital radiotherapy in the management of severe Graves’ ophthalmopathy: results of a prospective, single-blind, randomized study. J Clin Endocrinol Metab 2001;86(8):3562-7.
- Smith TJ. Insulin-like growth factor-I regulation of immune function: a potential therapeutic target in autoimmune diseases? Pharmacol Rev 2010;62(2):199-236.
- Tsui S, Naik V, Hoa N et al. Evidence for an association between thyroid-stimulating hormone and insulin-like growth factor 1 receptors: a tale of two antigens implicated in Graves’ disease. J Immunol 2008;181(6):4397-405.
- Douglas RS, Gianoukakis AG, Kamat S, Smith TJ. Aberrant expression of the insulin-like growth factor-1 receptor by T cells from patients with Graves’ disease may carry functional consequences for disease pathogenesis. J Immunol 2007;178(5):3281-7.
- Terry J. Smith, George J. Kahaly, Daniel G. Ezra et al. Teprotumumab for Thyroid-Associated Ophthalmopathy. N Engl J Med 2017(18);376:1748-61.
- Stan MN, Garrity JA, Carranza Leon BG, Prabin T, Bradley EA, Bahn RS. Randomized controlled trial of rituximab in patients with Graves’ orbitopathy. J Clin Endocrinol Metab 2015;100(2):432-41.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec l'article.

Traitement de l’hypothyroïdie subclinique et de l’hypothyroxinémie de la grossesse : une remise en cause des recommandations ?
Fritz-Line Velayoudom, CEPHISE (service d’endocrinologie, diabète et maladies métaboliques), CHU de Pointe-à-Pitre, Guadeloupe.
L’association entre l’hypothyroïdie subclinique ou l’hypothyroxinémie en cours de grossesse et certains effets indésirables a été rapportée par des études essentiellement observationnelles : fausses couches, prématurité, petit poids de naissance, troubles du développement psychomoteur chez les enfants de quelques mois, ou quotient intellectuel (QI) plus bas que la normale chez les enfants plus âgés. Ainsi, les sociétés savantes américaines (Collège d’obstétrique et de gynécologie, Endocrine Society, American Thyroid Association) ont rédigé des recommandations pour la prise en charge de ces anomalies thyroïdiennes en cours de grossesse. Jusqu’ici, le traitement par lévothyroxine en cas d’hypothyroïdie subclinique (HSC) en cours de grossesse est recommandé.
L’objectif primaire de l’étude de B.M. Casey et al. était d’évaluer l’effet du traitement par lévothyroxine prescrit chez les mères présentant soit une HSC, soit une hypothyroxinémie (H), sur le QI de leurs enfants à l’âge de 5 ans (1).
Méthode
Deux essais multicentriques randomisés contrôlés versus placebo étaient menés en parallèle dans 15 centres américains. Un dépistage des anomalies thyroïdiennes (dosage de TSH et de T4) était réalisé chez les femmes qui se présentaient pour leur visite prénatale avant 20 semaines de gestation (SG). Le diagnostic d’HSC était retenu lorsque la TSH était ≥ 4 mU/l avec une T4 normale (0,86-1,90 ng/dl ou 11-24 pmol/l) : groupe 1. Le diagnostic d’HT était retenu lorsque la TSH était normale, associée à une T4 < 0,86 ng/dl : groupe 2. Dans chaque groupe, les femmes recevaient quotidiennement soit la lévothyroxine (100 μg dans le groupe 1, 50 μg dans le groupe 2), soit le placebo. Le suivi de la grossesse était mensuel, avec un dosage de TSH et de T4 envoyé dans un laboratoire centralisateur. La posologie était ajustée avec comme objectif : 1/ une TSH entre 0,1 et 2,5 mU/l dans le groupe 1 (dose maximale de 200 μg de lévothyroxine) ; 2/ une T4 entre 0,86 et 1,9 ng/dl dans le groupe 2. À la naissance, le suivi des enfants était annuel pendant 5 ans, avec des tests évaluant leur fonction cognitive : Wechsler Preschool and Primary Scale of Intelligence III (WPPSI-III) à l’âge de 5 ans, ou DAS-II (Differential Ability Scales-II) à l’âge de 3 ans si le premier n’était pas disponible ou en cas de décès avant 3 ans. La corrélation entre les 2 scores avait été confirmée. Le critère de jugement principal était le QI des enfants évalué par ces scores, les critères de jugement secondaire incluaient d’autres scores évaluant le développement psychomoteur, le langage, la mémorisation, l’attention et le comportement social. Étaient aussi colligés le devenir de la grossesse et les complications obstétricales et néonatales.
Résultats
Entre octobre 2006 et octobre 2009, 97 228 femmes ont bénéficié de ce dépistage. 3 057 femmes avaient une HSC, mais seules 677 (groupe 1) ont pu être randomisées. 2 805 femmes avaient une HT et 632 étaient éligibles (groupe 2). Quel que soit le groupe et qu’elles aient bénéficié de la lévothyroxine ou non, les caractéristiques des femmes n’étaient pas différentes (âge, ethnie, IMC, parité, TSH et T4, statut iodé, semaines de gestation à la randomisation). Toutes les femmes avaient un statut iodé suffisant (iodurie ≥ 150 µg/l). Dans le groupe 1, la moyenne d’âge gestationnel (AG) était de 17 SG et celle des 93 % de femmes traitées par lévothyroxine, de 21 SG. Dans le groupe 2, la moyenne d’AG était de 18 SG et celle des 83 % de femmes traitées, de 23 SG. Il n’y avait pas de différence en termes d’évolution de la grossesse (terme, prématurité, HTA gravidique, rupture placentaire, diabète gestationnel) ni de complications néonatales (décès, manœuvres réanimatrices, petits poids de naissance, pathologie en lien avec une prématurité, durée d’hospitalisation), que les femmes aient été traitées ou non dans chaque groupe. Les scores d’évaluation cognitifs et du développement des enfants n’étaient pas différents dans les 2 groupes (323 enfants suivis et nés du groupe 1 traités versus 326 placebo et 254 enfants suivis et nés du groupe 2 traités versus 253 placebo), ni annuellement, ni à l’âge de 3 ou 5 ans. Aucun état d’hyperactivité chez les enfants dont les mères avaient été traitées par lévothyroxine n’était constaté.
Table 3. Developmental and Behavioral Outcomes in Offspring of Mothers with Subclinical Hypothyroidism.* |
||||||
Outcome |
Levothyroxine |
Placebo |
Difference (95% CI)† |
P Value |
||
No. of Children |
Median Value (95% CI) |
No. of Children |
Median Value (95% CI) |
|||
| Primary outcome‡ | 323 |
97 (94 to 99) |
326 |
94 (92 to 96) |
0 (−3 to 2) |
0,71 |
| Bayley-III score§ | ||||||
| At 12 mo | ||||||
| Cognitive | 311 |
100 (95 to 100) |
315 |
100 (95 to 100) |
0 (0 to 0) |
0,63 |
| Motor | 312 |
97 (97 to 97) |
314 |
97 (97 to 97) |
0 (0 to 3) |
0,83 |
| Language | 309 |
94 (94 to 97) |
312 |
94 (94 to 97) |
0 (0 to 3) |
0,48 |
| At 24 mo | ||||||
| Cognitive | 308 |
90 (90 to 90) |
302 |
90 (90 to 90) |
0 (0 to 0) |
0,59 |
| Motor | 304 |
97 (97 to 97) |
300 |
97 (97 to 100) |
0 (0 to 3) |
0,31 |
| Language | 300 |
89 (89 to 91) |
296 |
91 (89 to 94) |
0 (0 to 3) |
0,30 |
| Differential Ability Scales–II scores | ||||||
| Overall at 36 mo | 304 |
90 (88 to 93) |
308 |
90 (87 to 93) |
0 (−2 to 3) |
0,90 |
| Recall of digits forward at 48 mo | 298 |
84 (76 to 91) |
299 |
84 (76 to 91) |
0 (−5 to 7) |
0,60 |
| Recognition of pictures at 48 mo | 298 |
74 (74 to 80) |
302 |
74 (74 to 80) |
0 (−6 to 0) |
0,52 |
| Child Behavior Checklist T score | ||||||
| At 36 mo | 306 |
46 (45 to 48) |
309 |
46 (45 to 48) |
0 (−2 to 2) |
0,99 |
| At 60 mo | 314 |
44 (43 to 46) |
313 |
44 (42 to 46) |
0 (−2 to 2) |
0,96 |
| Conners’ Rating Scales–Revised ADHD | 314 |
48 (47 to 49) |
303 |
49 (47 to 51) |
0 (−1 to 2) |
0,37 |
| score at 48 mo | ||||||
| WPPSI-III at 60 mo | 311 |
97 (95 to 99) |
314 |
95 (93 to 97) |
0 (−3 to 2) |
89,00 |
| Table 4. Developmental and Behavioral Outcomes in Offspring of Mothers with Hypothyroxinemia.* | ||||||
Outcome |
Levothyroxine |
Placebo |
Difference (95% CI)† |
P Value |
||
No. of Children |
Median Value (95% CI) |
No. of Children |
Median Value (95% CI) |
|||
| Primary outcome | 254 |
94 (91 to 95) |
253 |
91 (89 to 93) |
−1 (−4 to 1) |
0,30 |
| Bayley-III score | ||||||
| At 12 mo | ||||||
| Cognitive | 247 |
100 (100 to 100) |
238 |
100 (100 to 100) |
0 (0 to 0) |
0,89 |
| Motor | 246 |
97 (94 to 97) |
236 |
97 (94 to 97) |
0 (0 to 3) |
0,54 |
| Language | 246 |
94 (91 to 94) |
237 |
94 (91 to 97) |
0 (−3 to 3) |
0,92 |
| At 24 mo | ||||||
| Cognitive | 235 |
90 (85 to 90) |
235 |
90 (85 to 90) |
0 (0 to 0) |
0,70 |
| Motor | 233 |
97 (94 to 100) |
232 |
97 (94 to 97) |
0 (−3 to 0) |
0,20 |
| Language | 232 |
89 (89 to 94) |
229 |
89 (89 to 91) |
0 (−3 to 2) |
0,71 |
| Differential Ability Scales–II scores | ||||||
| Overall at 36 mo | 244 |
90 (87 to 92) |
235 |
89 (87 to 91) |
−1 (−3 to 2) |
0,64 |
| Recall of digits forward at 48 mo | 236 |
91 (84 to 99) |
224 |
84 (84 to 91) |
0 (−8 to 0) |
0,22 |
| Recognition of pictures at 48 mo | 234 |
74 (74 to 80) |
226 |
74 (74 to 80) |
0 (−4 to 0) |
0,91 |
| Child Behavior Checklist T score | ||||||
| At 36 mo | 244 |
48 (46 to 50) |
237 |
48 (45 to 49) |
0 (−2 to 2) |
0,65 |
| At 60 mo | 244 |
45 (43 to 46) |
243 |
43 (42 to 45) |
−1 (−3 to 1) |
0,44 |
| Conner’s Rating Scales–Revised ADHD score at 48 mo |
238 |
50 (49 to 51) |
228 |
49 (48 to 51) |
0 (−2 to 2) |
0,98 |
| WPPSI-III score at 60 mo | 243 |
94 (91 to 95) |
243 |
92 (90 to 95) |
−1 (−3 to 2) |
0,48 |
Discussion
Ces 2 essais parallèles randomisés impliquant des femmes avec HSC ou HT en première moitié de grossesse n’a pas mis en évidence d’effet bénéfique de la lévothyroxine sur les fonctions cognitives ni sur le développement neuropsychomoteur des enfants pendant les 5 premières années de vie. Cette étude ne confirme pas les données de l’étude de Haddow et al., déjà ancienne (1999), qui rapportait un risque d’altération des fonctions cognitives en cas d’HSC chez la mère. Dans cette dernière, il faut noter que les femmes incluses avaient une TSH > 10 mU/l (2). De plus, les études ayant validé un lien entre l’HT et un score mental diminué chez les enfants avaient été réalisées chez les femmes avant 12 SG. L’étude présentée ici rapporte des données similaires à celles de l’étude CATS (Controlled Antenatal Thyroid Screening), qui avait évalué des femmes à un stade plus précoce de leur grossesse (13 SG), avec un pourcentage non négligeable de perdues de vus (24 %) [3]. La limite de l’étude ici est l’âge gestationnel tardif des femmes incluses.
Conclusion
Le développement neurocognitif des enfants nés de mères avec HSC ou HT recevant de la lévothyroxine en cours de 2e trimestre de grossesse n’est pas meilleur que celui des enfants nés de femmes non traitées.
Références bibliographiques
-
Casey BM, Thom EA, >Peaceman AM et al. Treatment of subclinical hypothyroidism or hypothyroxinemia in pregnancy. N Engl J Med 2017;376(9):815-25.
-
Haddow JE, Palomaki GE, Allan WC et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999;341(8):549-55.
- Lazarus JH, Bestwick JP, Channon S et al. Antenatal thyroid screening and childhood cognitive function. N Engl J Med 2012;366(6):493-501.
L’éditorial de D. Cooper et E. Pearce est à souligner (3). Il résume l’état des connaissances avant cette étude, avec d’abord un rappel sur le passage transplacentaire de la thyroxine maternelle, qui est essentiel au développement fœtal, particulièrement lors de la première moitié de la grossesse. Les essais randomisés évaluant l’intérêt de la lévothyroxine dans cette situation sont encore rares. Seule l’étude CATS avait évalué le devenir cognitif des enfants nés de mère avec HT et n’avait pas rapporté de bénéfice du traitement. Suite à ce travail, les recommandations cliniques du Collège américain de gynécologie et d’obstétrique ont changé par rapport à celles de l’ATA, qui recommandait le traitement systématique de l’HSC ou de l’HT en cours de grossesse, particulièrement en présence d’une auto-immunité et selon les seuils de TSH. L’étude de Casey et al. a donc des similitudes avec l’étude CATS, avec l’avantage d’évaluer les enfants plus tardivement, à l’âge de 5 ans, sans interaction avec la présence d’ATPO ni déficience iodée chez les mères. Cooper rappelle que l’initiation de la lévothyroxine avant le 2e trimestre (femmes non incluses ici) est pertinente car la thyroïde fœtale est fonctionnelle entre 16 et 20 SG. De plus, aux États-Unis, > 75 % des femmes ont un dépistage de l’hypothyroïdie avant 12 SG, ce qui justifie l’application des recommandations de l’ATA, car une initiation précoce de faible dose de lévothyroxine serait bénéfique pour les mères avec HSC ou HT, peu coûteuse et sans danger.
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec l'article.

Biotine à fortes doses et immunodosages
Michèle d’Herbomez, Caroline Dussart, centre de biologie-pathologie-génétique du CHRU de Lille.
La biotine
La biotine ou vitamine B8 est un cofacteur de 5 carboxylases intervenant dans la synthèse d’acides gras et dans la production d’énergie. Cette vitamine est présente dans l’alimentation normale à des doses quotidiennes recommandées de 30 à 100 µg.
La biotine est prescrite comme traitement de la sclérose en plaques à des doses journalières de 100-300 mg (1 000 fois les concentrations physiologiques), comme traitement d’alopécies (15 mg), de maladies métaboliques (5 - 10 mg/j). Elle existe dans certains compléments alimentaires prescrits aux femmes enceintes (250 µg).
Les immunodosages
Depuis une cinquantaine d’années, les techniques d’immuno-analyse ont permis les évaluations de nombreuses hormones sériques, en particulier celles de l’exploration biologique thyroïdienne et celles des axes phosphocalcique, somatotrope, gonadotrope, du diabète et des marqueurs de cancers. Deux types de dosages sont utilisés (compétitifs et immunométriques), majoritairement automatisés. La plate-forme d’immunodosages la plus commune en France utilise un système de détection des anticorps fondé sur l’affinité très forte entre la biotine et la streptavidine. De nombreuses causes d’interférences dans les immunodosages ont été identifiées, mais apparaissent rarement si l'on considère le nombre d’actes réalisés. L’interférence par la biotine pourrait en augmenter significativement la fréquence.
Cas cliniques d’interférences dans le bilan thyroïdien
Le premier cas d’interférence de la biotine dans les dosages de TSH et de T4L a été décrit en 1996 chez un nouveau-né (1), puis oublié… Ce n’est que depuis 5 ans que les cas publiés se multiplient (1-5). La majorité des observations décrivent le même profil d’interférence dans les paramètres thyroïdiens : abaissement de la TSH et augmentation des formes libres de T3 et de T4, soit un profil biologique cohérent d’hyperthyroïdie patente, parfois même avec antirécepteur de la TSH ! En dépit de l’euthyroïdie clinique, des traitements inappropriés ont parfois été induits (4).
Explications et parades
La biotine à fortes doses entre en compétition dans les dosages sur les sites de streptavidine. Elle crée ainsi une diminution du signal mesuré. Ceci se traduit pour un dosage immunométrique (TSH, thyroglobuline, calcitonine) par une diminution de la concentration de l’analyte et, pour les dosages compétitifs, par une augmentation (formes libres de T3 et T4, Ac antiRTSH), créant ainsi un profil biologique trompeur. Les perturbations biologiques sont maximales 2 heures après la prise et persistent jusqu’à 24 heures pour la FT4, avec une amplitude d’élévation pouvant aller jusqu’à 7 fois la norme (6).
Les parades sont de changer de plate-forme de dosage (tous les dosages de TSH n’utilisent pas le système streptavidine-biotine), d’arrêter (lorsque cela est possible) la prise de biotine, ou enfin de neutraliser la biotine des sérums avant dosage (7).
Potentiellement beaucoup d’immunodosages peuvent être impactés
Des interférences de même type ont été décrites dans l’exploration phosphocalcique (PTH basse, vitamine D élevée), dans l’axe corticotrope (cortisol haut, ACTH diminuée), l’axe gonadotrope (testostérone/estradiol élevés, LH/FSH diminuées) [1, 7]. N’ont pas encore été publiées, mais sont possibles, des interférences dans l’exploration de l’axe somatotrope, du diabète, dans l’infection (en liaison avec la procalcitonine), dans la ferritine, dans les marqueurs de cancers, etc.
Conclusion
La prise de biotine à fortes doses peut impacter les immunodosages de tous types en créant des profils biologiques cohérents mais faux. La majorité des observations rapportées l’ont été pour des hyperthyroïdies biologiques patentes chez des sujets en euthyroïdie. D’autres interférences pourraient exister si les explorations étaient réalisées.
Il est donc primordial, dans ce contexte, d’instaurer un dialogue clinicobiologique efficace, en particulier, pour le clinicien, de signaler systématiquement la prise de biotine et, pour les biologistes, de faire savoir si les méthodes de dosage utilisées sont sensibles ou pas à la biotine.
Références bibliographiques
- Elston MS, Sehgal S, Du Toit S, Yarndley T, Canaglen JV. Factitious Grave’s disease due to biotin immunoassay interference - a case and review of the litterature. J Clin Endocrinol Metab 2016;101(9):3251-5.
- Barbesino G. Misdiagnosis of Graves’ disease with apparent severe hyperthyroidism in a patient taking biotin megadoses. Thyroid 2016;26(6):860-3.
- Kummer S, Hermsen D, Distelmaier F. Biotin treatment mimicking Graves’ disease. N Engl J med 2016;375(7):704-6.
- Al-Salameh A. Une maladie de Basedow très bizarre… ou les bienfaits des vacances du médecin. MCED, octobre 2016.
- Piketty ML, Polak M, Flechtner I, Gonzales-Briceño L, Souberbielle JC. False biochemical disgnosis of hyperthyroidism in streptavidin-biotin-based immunoassays: the problem of biotin intake and related interferences. Clin Chem Lab Med 2017;55(6):780-8.
- Wijeratne NG, Doery JC, Lu ZX. Positive and negative interference in immunoassays following biotin ingestion: a pharmacokinetic study. Pathology 2012;44(7):674-5.
- Piketty ML, Prie D, Sedel F, Bernard D, Hercend D, Chanson P and Souberbielle JC. High-dose biotin therapy leading to false biochemical endocrine profiles: validation of a simple method to overcome biotin interference. Clin Chem Lab Med 2017;55(6):817-25.
Les auteurs n'ont pas précisé leurs éventuels liens d'intérêts.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 – Courriel : webmaster@sfendocrino.org

