Diabète de type 2
I Épidémiologie
Le diabète de type 2 représente 80 à 90 % des diabètes.
En 2017, la prévalence du diabète traité pharmacologiquement en France était de 5 %, soit plus de 3 millions de sujets traités pour un diabète. La prévalence du diabète a augmenté de 2 % par an sur la période 2010–2015. Cette augmentation de prévalence du diabète en France concerne très majoritairement le diabète de type 2. Elle est en grande partie la conséquence d’une augmentation de l’espérance de vie des sujets diabétiques mais aussi d’une augmentation de l’incidence du diabète. À structure d’âge identique, la prévalence du diabète est plus élevée chez les hommes que chez les femmes, avec un sex-ratio de 1,5. La prévalence augmente avec l’âge pour atteindre un pic entre 80 et 84 ans chez les femmes et entre 70 et 79 ans chez les hommes. Entre 70 à 84 ans, plus de 1 homme sur 5 était diabétique en France en 2015.
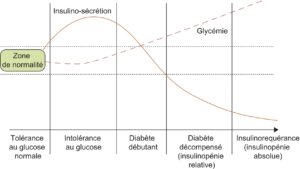
Les personnes à risque sont les personnes obèses, sédentaires, présentant une anomalie du métabolisme glucidique (hyperglycémie modérée à jeun ou intolérance au glucose, fig. 1, antécédent de diabète gestationnel pour les femmes), ayant des antécédents familiaux de diabète de type 2. Certaines ethnies sont plus touchées, en particulier les sujets originaires de certaines régions d’Afrique (incluant le Maghreb), du Moyen-Orient, d’Inde. En France, les populations des DOM (Antilles et Réunion) sont particulièrement concernées.
________________________________________________________________________________
Fig. 1.
Histoire naturelle du diabète de type 2.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
II Physiopathologie
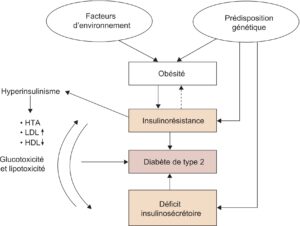
La physiopathologie de la forme commune du diabète de type 2 est représentée dans la figure 2. On retient deux mécanismes majeurs : altération des capacités d’insulinosécrétion et insulinorésistance. Le premier est plutôt de déterminisme génétique, mais auto-aggravé par l’hyperglycémie elle-même (glucotoxicité) ; le second est plutôt expliqué par l’environnement (sédentarité, alimentation excessive et de mauvaise qualité nutritionnelle).
________________________________________________________________________________
Fig. 2.
Physiopathologie de la forme commune du diabète de type 2 (80 % des cas).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
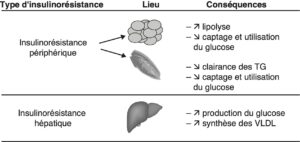
L’insulinorésistance se caractérise par la nécessité d’une plus forte concentration d’insuline pour obtenir une réponse au niveau de ses organes cibles :
- muscles (diminution de la capture, de l’utilisation et du stockage du glucose) ;
- foie (perte de l’inhibition de la production hépatique de glucose, à l’origine de l’hyperglycémie à jeun) ;
- adipocytes (lipolyse excessive avec élévation des acides gras libres circulants).
Il n’y a cependant pas d’hyperglycémie sans anomalie de la sécrétion d’insuline : tous les diabètes sont dus à l’incapacité de produire assez d’insuline pour subvenir aux besoins de l’organisme, que ceux-ci soient normaux (comme dans le diabète de type 1) ou élevés (chez les sujets résistants à l’action de l’insuline). La sensibilité à l’insuline diminue progressivement avec l’âge et peut favoriser la survenue d’un diabète si la production d’insuline n’arrive pas à compenser l’augmentation des besoins. La résistance à l’action de l’insuline n’est cependant pas un paramètre fixe : elle peut être améliorée par l’obtention d’un amaigrissement, par augmentation de l’activité physique, mais également par la réduction de différents types de stress physiques (par exemple le traitement de pathologies intercurrentes) ou psychiques.
A Facteurs génétiques
Le diabète de type 2 est fortement héréditaire (transmission familiale, tableau 1), mais la composante génétique est moins importante que dans le diabète de type 1. L’hérédité comprend en effet une grande part liée aux comportements favorisant le diabète de type 2 (alimentation et mode de vie font partie de la culture partiellement transmise d’une génération à l’autre).
________________________________________________________________________________
Tableau 1.
Fréquence estimée du diabète de type 2 chez les apparentés de sujets diabétiques de type 2. (Source : CEEDMM, 2021.)
| Population générale française | 5 % |
| Vrais jumeaux | 90 à 100 % |
| Deux parents diabétiques | 30 à 60 % |
| Un apparenté au premier degré | 10 à 30 % |
________________________________________________________________________________
B Glucotoxicité
L’hyperglycémie elle-même peut aggraver la résistance à l’action de l’insuline et les anomalies de sa sécrétion : c’est la glucotoxicité (cf. infra).Cette aggravation des mécanismes physiopathologiques du diabète de type 2 est en partie réversible par un contrôle glycémique strict prolongé.
C Lipotoxicité
L’insulinopénie et l’insulinorésistance au niveau des adipocytes favorisent la lipolyse, ce qui entraîne une augmentation des acides gras libres circulants. Cette augmentation de la concentration plasmatique en acides gras libres aggrave les anomalies de l’insulinosécrétion, stimule la production hépatique de glucose et inhibe la captation de glucose par les muscles. Ce phénomène physiopathologique est connu sous le terme de lipotoxicité.
________________________________________________________________________________
Ce que le patient doit savoir
Physiopathologie du diabète de type 2
Définie comme une réponse diminuée à l’administration d’insuline exogène, l’insulinorésistance (fig. 3) est favorisée par l’obésité androïde, l’âge et la sédentarité.
________________________________________________________________________________
________________________________________________________________________________
Dans le cas du syndrome métabolique, l’obésité androïde et l’insulinorésistance s’accompagnent d’au moins deux des anomalies suivantes :
- une hypertriglycéridémie ;
- un taux bas de HDL-cholestérol ;
- une hypertension artérielle (HTA) ;
- une hyperglycémie à jeun ou un diabète.
Au-delà de l’hyperglycémie définissant le diabète, ces anomalies associées à l’insulinorésistance (HTA, dyslipidémie, etc.) contribuent à majorer le risque cardiovasculaire des sujets diabétiques de type 2.
La présence d’une inflammation chronique de bas grade est aujourd’hui considérée comme une autre composante de la physiopathologie du diabète de type 2. Elle est caractérisée par l’infiltration de cellules inflammatoires dans plusieurs tissus, en particulier le tissu adipeux. Les cytokines inflammatoires sécrétées par les macrophages et autres cellules inflammatoires et les adipokines sécrétées par les adipocytes sont des médiateurs des désordres métaboliques, y compris à distance, et pourraient participer aux défauts de sécrétion d’insuline. Au niveau du foie, la présence d’une stéatose est quasi constante, plus fréquemment associée à des lésions inflammatoires (stéato-hépatite) dans le diabète de type 2, contribuant directement à l’insulinorésistance hépatique. Les îlots de Langerhans pourraient aussi être le siège d’une inflammation de bas grade.
________________________________________________________________________________
Fig. 3.
Insulinorésistance hépatique et périphérique (musculaire et adipocytaire).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
III Signes cliniques et dépistage
A Signes cliniques
Les signes cliniques sont principalement secondaires à l’hyperglycémie. Cependant, le diabète de type 2 passe souvent inaperçu car l’hyperglycémie se développe graduellement et peut rester longtemps asymptomatique (la glucosurie, responsable de la polyurie et de la polydipsie, ne survient que lorsque la glycémie dépasse le seuil de réabsorption rénale, de l’ordre de 1,80 g/l). L’absence de signe clinique peut entraîner un retard diagnostique chez des sujets exposés au risque de développer des complications micro- et macrovasculaires.
La découverte du diabète sur un mode de décompensation sévère peut s’expliquer par un simple retard diagnostique, une pathologie intercurrente ou la prescription d’un traitement hyperglycémiant (corticothérapie), et peut se révéler par les symptômes suivants :
- polyurie ;
- polydipsie (soif) ;
- amaigrissement ;
- prurit vulvaire chez la femme et balanite chez l’homme (mycoses génitales) ;
- infections récidivantes ou traînantes.
Une complication de l’hyperglycémie chronique peut également révéler la maladie : neuropathie douloureuse, mal perforant plantaire et autres lésions du pied, rétinopathie ou atteintes cardiovasculaires.
B Dépistage par la glycémie veineuse à jeun
Quand doit-il être réalisé ?
La situation de dépistage (sujet asymptomatique) doit bien être distinguée de la situation de suspicion diagnostique (sujet avec symptôme). Une recommandation ANAES de 2003 reste active pour fixer le cadre du dépistage par la seule glycémie à jeun chez les sujets concernés :
- tous les sujets présentant des signes cliniques évocateurs de diabète ;
- tous les sujets âgés de plus de 45 ans : à répéter tous les 3 ans en l’absence de facteur de risque de diabète, plus précocement en cas d’apparition d’un facteur de risque, le risque de développer un diabète de type 2 augmentant avec l’âge ;
- les patients qui présentent un ou plusieurs facteurs de risque (à répéter tous les ans en cas de bilan normal).
Le dépistage est proposé dans les cas suivants :
- origine non caucasienne et/ou migrant ;
- situation de précarité ;
- marqueurs du syndrome métabolique :
- excès pondéral mesuré à partir de l’IMC, défini comme > 28 kg/m2 ;
- hypertension artérielle(PAS ≥ 140 mmHg et/ou PAD ≥ 90 mmHg et/ou hypertension artérielle traitée) ;
- HDL-cholestérol< 0,35 g/l [0,9 mmol/l] et/ou triglycérides > 2 g/l [2,3 mmol/l] et/ou dyslipidémie traitée ;
- antécédents de :
- diabète familial (du premier degré) ;
- diabète gestationnel ou enfant de poids de naissance de plus de 4 kg ;
- diabète temporairement induit ;
- maladie vasculaire ou rénale.
C Diagnostics différentiels (+++)
On rappellera ici les notions déjà développées dans la partie sur le diabète de type 1.
1 Diabète de type 1 lent (LADA)
Ce diabète est généralement caractérisé par l’absence de surpoids, l’absence d’antécédents familiaux de diabète de type 2 et par la présence d’autoanticorps anti-IA2 et/ou anti-GAD.
2 Diabètes génétiques
Il s’agit de diabètes associant un contexte évocateur de transmission familiale monogénique et de présentation clinique atypique :
- MODY 2 (Maturity Onset Diabetes of the Young) : diabète modéré du sujet jeune ;
- autres MODY, notamment de type 3 : diabète sévère du sujet jeune ou rapidement insulinorequérant (pseudo-type 1) ;
- MIDD (Maternaly Inherited Diabetes and Deafness) : diabète mitochondrial à transmission maternelle (signes évocateurs : dystrophie maculaire réticulée au fond œil, surdité).
Les autres anomalies génétiques sont rarement confondues avec les diabètes de type 2.
3 Diabètes secondaires
Il s’agit des diabètes secondaires à des pancréatopathies (pancréatite chronique calcifiante notamment), à l’hémochromatose et à la mucoviscidose, aux causes médicamenteuses et aux endocrinopathies.
IV Évolution
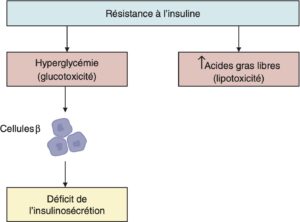
L’insulinopénie tend à s’aggraver avec le temps, pouvant justifier le recours à un traitement par insuline. Cette dégradation est souvent accentuée par les mécanismes de glucotoxicité et lipotoxicité (comme décrit dans la figure 4).
________________________________________________________________________________
Fig. 4.
Déclin aggravé de la fonction des cellules β lorsque le diabète est mal contrôlé.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Le pronostic de la maladie dépend de la survenue de complications, elles-mêmes favorisées par un équilibre glycémique insuffisant, mais également par l’existence de facteurs de risque cardiovasculaire non contrôlés (HTA, dyslipidémie). Les différentes complications font l’objet d’une section spécifique (cf. infra).
V Traitement
A Principes généraux (+++)
Les objectifs du traitement sont :
- le contrôle glycémique optimal impliquant de fixer unobjectif d’HbA1c individualisé (personnalisation des objectifs glycémiques) ;
- l’amélioration de la sensibilité à l’insuline en limitant en particulier la glucotoxicité et la lipotoxicité ;
- la prise en charge globale des facteurs de risque cardiovasculaire (tabac, HTA, dyslipidémie).
Les moyens de traitement sont :
- l’activité physique ;
- l’équilibre nutritionnel : limiter les sucres d’absorption rapide et les aliments à index glycémique élevé, contrôler les apports lipidiques et la consommation de boissons alcoolisées ;
- la réduction des apports caloriques en cas de surcharge pondérale ;
- les traitements oraux (tableau 2 et figure 5);
- les agonistes du récepteur du GLP-1 (Glucagon-Like Peptide-1) (tableau 3) ;
- l’insuline.
________________________________________________________________________________
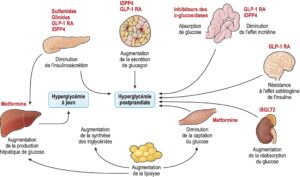
Fig. 5.
Différents sites d’action des antidiabétiques oraux.
L’effet incrétine est une augmentation de la sécrétion d’insuline secondaire à l’administration orale de glucose ; cet effet a été mis en évidence par la comparaison de l’administration à des rats d’une dose de glucose par voie orale pour un groupe et par voie intraveineuse pour un autre : dans le groupe ayant eu le glucose par voie orale, les taux d’insuline post-charge étaient environ deux fois supérieurs à ceux observés dans le groupe ayant eu le glucose par voie parentérale.
iDPP4 : inhibiteurs de la dipeptidyl peptidase-4 ; GLP-1 RA : agoniste des récepteurs du GLP-1 ; iSGLT2 : inhibiteurs des cotransporteurs sodium-glucose de type 2.
(Source : illustration de Carle Fumat.)
________________________________________________________________________________
________________________________________________________________________________
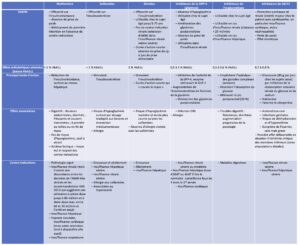
Tableau 2.
Caractéristiques, intérêt et effet métaboliques des antidiabétiques oraux. (Source : CEEDMM, 2021.)
>>>> Lien pour télécharger le tableau en pdf…
________________________________________________________________________________
________________________________________________________________________________
Tableau 3.
Agonistes du récepteur du GLP-1 (ou analogues du GLP-1). (Source : CEEDMM, 2021.)
| Administration | – Par voie sous-cutanée (excepté forme orale du sémaglutide non commercialisée) |
| Mode d’action | – Augmentation de la sécrétion d’insuline liée à l’hyperglycémie
– Réduction de la sécrétion de glucagon – Ralentissement de la vidange gastrique (variable en fonction des molécules) – Renforcement de la satiété, diminution des prises alimentaires (variable en fonction des molécules) |
| Intérêt | – Amélioration des glycémies pré- et postprandiales
– Absence d’hypoglycémie – Perte de poids – Amélioration des dyslipidémies, de l’HTA et de la stéatose – Sécurité cardiovasculaire démontrée, bénéfice cardiovasculaire associé à certaines molécules |
| Effets secondaires | – Digestifs : nausées, vomissements, diarrhées
– Hypoglycémies en cas d’association aux insulinosécréteurs – Rares cas d’insuffisance rénale |
| Contre-indications | – Gastroparésie
– Antécédents de pancréatopathie – Absence d’expérience chez l’enfant |
| Effets métaboliques attendus | – Diminution de 1 à 1,5 % de l’HbA1c |
________________________________________________________________________________
On notera aussi la publication en 2014 du document HAS intitulé Guide Parcours de soins – Diabète de type 2 de l’adulte, qui fixe les situations suivantes :
- le repérage, le diagnostic et la prise en charge initiale ;
- la prescription et les conseils d’une activité physique adaptée ;
- la prescription et les conseils diététiques adaptés ;
- l’initiation d’un traitement par insuline ;
- la découverte d’une complication ;
- le dépistage et la prise en charge du diabète gestationnel.
B Surveillance glycémique
1 Surveillance de l’HbA1c
Elle est essentielle à la surveillance du traitement et à l’évaluation du risque de complications.
Un objectif personnalisé doit être défini et expliqué au patient. Les recommandations indiquent que le dosage doit être réalisé tous les 3 mois.
Cependant, certaines recommandations (Grande-Bretagne) proposent que, si le patient est à l’objectif glycémique et en l’absence de changement de traitement, la surveillance peut être espacée à une fois tous les 6 mois.
Les objectifs d’HbA1c seront modulés selon le profil clinique du patient qui tiendra en particulier compte de l’âge (et du niveau de fragilité), la durée du diabète, les événements cardiovasculaires et le degré de fonction rénale (tableau 4 ; HAS, 2013).
________________________________________________________________________________
Tableau 4.
Personnalisation de l’objectif d’HbA1c des sujets diabétiques de type 2 (HAS, 2013 ; révision attendue en 2021.)
1 . Sous réserve d’être atteint par la mise en œuvre ou le renforcement des mesures hygiéno-diététiques puis, en cas d’échec, par une monothérapie orale (metformine, voire inhibiteurs des α-glucosidases). Selon le consensus d’experts de la SFD 2019, cet objectif peut être maintenu s’il est possible de l’atteindre avec une monothérapie ou une bithérapie n’exposant pas au risque d’hypoglycémie.
2 . Stade 3A : DFG entre 45 et 59 ml/min/1,73 m2, stade 3B : DFG entre 30 et 44 ml/min/1,73 m2, stade 4 : entre 15 et 29 ml/min/1,73 m2 et stade 5 : < 15 ml/min/1,73 m2.
Nous remercions la Haute Autorité de santé de nous avoir autorisés à reproduire ces extraits. Il est également consultable sur le site www.has-sante.fr rubrique Toutes nos publications
| Profil du patient | HbA1c cible | |
| Cas général
|
– La plupart des patients avec diabète de type 2 | ≤ 7 % |
| – Diabète de type 2 nouvellement diagnostiqué, dont l’espérance de vie est > 15 ans et sans antécédent cardiovasculaire | ≤ 6,5 % 1 | |
| – Diabète de type 2 :
• avec comorbidité grave avérée et/ou une espérance de vie limitée (< 5 ans) • ou avec des complications macrovasculaires évoluées • ou ayant une longue durée d’évolution du diabète (> 10 ans) et pour lesquels la cible de 7 % s’avère difficile à atteindre car l’intensification médicamenteuse provoque des hypoglycémies sévères |
≤ 8 % | |
| Personnes âgées
|
– Dites « vigoureuses » dont l’espérance de vie est jugée satisfaisante | ≤ 7 % |
| – Dites « fragiles », à l’état de santé intermédiaire et à risque de basculer dans la catégorie des malades | ≤ 8 % | |
| – Dites « malades », dépendantes, en mauvais état de santé en raison d’une polypathologie chronique évoluée génératrice de handicaps et d’un isolement social | < 9 % et/ou glycémies capillaires préprandiales entre 1 et 2 g/l | |
| Patients avec antécédents cardiovasculaires
|
– Patients avec antécédents de complication macrovasculaire considérée comme non évoluée | ≤ 7 % |
| – Patients avec antécédents de complication macrovasculaire considérée comme évoluée :
• infarctus du myocarde avec insuffisance cardiaque • atteinte coronarienne sévère (tronc commun ou atteinte tritronculaire ou atteinte de l’interventriculaire antérieur proximale) • atteinte polyartérielle (au moins deux territoires artériels symptomatiques) • artériopathie oblitérante des membres inférieurs (AOMI) symptomatique • accident vasculaire cérébral récent (< 6 mois) |
≤ 8 % | |
| Patients avec insuffisance rénale chronique
|
– IRC modérée (stades 3A et 3B)1 | ≤ 7 % |
| – IRC sévère ou terminale (stades 4 et 5) 2 | ≤ 8 % | |
| Patientes enceintes ou envisageant de l’être
|
– Avant d’envisager la grossesse | ≤ 6,5 % |
| – Durant la grossesse | ≤ 6,5 % et glycémies < 0,95 g/l à jeun et < 1,20 g/l en postprandial à 2 heures | |
________________________________________________________________________________
2 Autosurveillance glycémique
Traitement oral
L’autosurveillance glycémique n’est pas systématique : elle est nécessaire en cas de pathologie déséquilibrant le diabète ou de modification du traitement du diabète.
L’assurance maladie a introduit la notion de 200 bandelettes réactives remboursées par an pour les sujets diabétiques qui ne reçoivent pas d’insuline, avec une possibilité de dépasser ce nombre pour les sujets recevant des traitements susceptibles de provoquer des hypoglycémies.
L’autosurveillance glycémique est un outil précieux d’éducation :
- pour sensibiliser le patient à l’intérêt de la diététique et de l’exercice physique régulier ;
- pour déterminer la posologie d’un sulfamide hypoglycémiant au début ou lors d’un changement d’hypoglycémiant, ou après ajout d’un traitement pouvant modifier l’insulinosécrétion ou l’insulinosensibilité (inhibiteur de l’enzyme de conversion, par exemple) ;
- lors d’une maladie intercurrente ou de la prescription d’un médicament diabétogène.
Le protocole d’autosurveillance glycémique est le plus souvent d’une à trois glycémies hebdomadaires selon un rythme qui pourrait être, par exemple, à jeun au réveil, à 12 h avant le déjeuner et à 17 h, en cas de traitement par sulfamides hypoglycémiants.
Diabète insulino-traité
L’autosurveillance glycémique est nécessaire pour l’adaptation des doses d’insuline. Il faut au minimum autant de contrôles capillaires que d’injections. L’utilisation d’un dispositif de mesure continue du glucose est réservée aux patients nécessitant une insulinothérapie intensifiée (multi-injections ou pompe à insuline).
________________________________________________________________________________
Ce que le patient doit savoir
La surveillance glycémique
- HbA1c : fraction de l’hémoglobine susceptible de se glyquer de façon stable ; elle permet d’estimer l’équilibre glycémique des 2 à 3 mois précédant le prélèvement.
- Dosage à faire tous les 3 à 4 mois.
- Objectif d’HbA1c défini pour chaque patient : objectif dont le patient doit être informé.
- L’absence d’hypoglycémie est également un critère d’équilibre du diabète.
________________________________________________________________________________
C Prise en charge thérapeutique (+++)
Première étape – Règles hygiénodiététiques
Activité physique
Elle peut nécessiter au préalable une évaluation cardiologique et podologique. Un référentiel de la SFD (Société francophone du diabète) publié en 2013 fait le point sur cette question de façon exhaustive.
Intérêt de l’exercice physique régulier
Les intérêts sont nombreux :
- diminution de l’incidence du diabète de type 2 dans une population à risque ;
- amélioration de la sensibilité à l’insuline et des paramètres métaboliques (durée d’action brève, de 24 à 30 heures) ;
- amélioration des chiffres tensionnels à l’effort ;
- augmentation de la masse maigre et diminution de la masse grasse, sans modification pondérale notable en l’absence de contrôle alimentaire associé.
Type d’exercice physique
On conseille de combiner des exercices d’endurance (marche, vélo ou natation) et des exercices de résistance (renforcement musculaire).
Les exercices d’endurance sont assez simples à mettre en œuvre. Leur intensité doit être adaptée :
- exercice d’intensité modérée (40 à 60 % VO2maxou 3 à 6 MET) et longue durée (≥ 30 minutes) ;
- exercice intense (> 60 % VO2max ou > 6 MET, le patient transpire et a une accélération franche de la fréquence respiratoire). Ces séances peuvent être ajoutées à l’exercice modéré avec des durées plus courtes (3 sessions de 20 minutes à forte intensité au lieu de 5 sessions de 30 minutes d’intensité modérée).
Un début progressif pourra bénéficier de l’aide de professionnels de sport et santé.
Il est important de profiter des actes de la vie courante, incluant les périodes de loisirs et d’activité professionnelle, pour majorer le niveau global d’activité physique.
L’intensité est progressive et adaptée au contexte personnel de sédentarité, sans dépasser 50 à 70 % de la FMT (fréquence cardiaque maximale théorique), qui se calcule selon la formule : FMT = 220 – Âge. Par exemple, pour un sujet de 50 ans, la FMT est de 170 et la fréquence cardiaque à l’effort ne doit pas dépasser (170 × 70 %) 119 battements/min.
Durée de l’exercice physique
Au moins 30 minutes par jour, par tranches d’au moins 10 minutes. Insister sur la lutte contre les comportements sédentaires et favoriser les déplacements à pied ou à vélo ; la montée des escaliers peut constituer une activité physique urbaine.
L’objectif est d’obtenir au minimum 150 minutes par semaine (3 à 5 sessions) et au moins 3 séances par semaine et pas plus de 2 jours sans activité physique.
Contre-indications
Les contre-indications sont les suivantes :
- insuffisance coronarienne non stabilisée ;
- rétinopathie diabétique proliférante non stabilisée ; une rétinopathie stable ne doit pas conduire à l’éviction de l’activité.
Surveillance
En cas de risque d’hypoglycémie iatrogène, l’autosurveillance glycémique doit être instaurée ou renforcée, avec des mesures avant et après l’activité consignées sur un carnet de surveillance, en particulier dans la période de reprise d’activité ou à l’occasion de séances d’intensité ou de durée inhabituelles. Le bénéfice glycémique de l’activité, notamment d’endurance, est marqué notamment en période postprandiale.
Il faut également surveiller l’état des pieds, avant et après exercice, et s’assurer que l’équipement est adapté (notamment le chaussage).
La prescription de l’exercice physique est un acte médical nécessitant une évaluation des risques du patient et de ses capacités.
________________________________________________________________________________
Ce que le patient doit connaître
Activité physique
- L’effet bénéfique de l’exercice physique.
- L’amélioration de la masse musculaire.
- L’intérêt des activités quotidiennes : ménage, bricolage, jardinage, économiser sa voiture, monter les escaliers à pied, etc.
- La progression de la durée et de l’intensité des séances d’activité physique qui doivent être adaptées aux caractéristiques de chaque individu, selon l’avis médical.
________________________________________________________________________________
Alimentation
On rappellera ici les éléments issus du référentiel 2014 de la SFD consacré à la nutrition : régime diabétique hypocalorique (si excès pondéral), équilibré, sans sucres d’absorption rapide. Les objectifs sont la perte de 5 à 10 % du poids au diagnostic de la maladie en cas de surcharge pondérale, et la correction, avant tout, des désordres nutritionnels et des troubles du comportement alimentaire (grignotages).
Prescription diététique
La prescription diététique doit tenir compte :
- du poids du sujet ;
- de son activité physique ;
- de ses habitudes alimentaires ;
- de ses interdits éventuels (+) ;
- de ses coutumes ethniques (+) ;
- de ses contraintes professionnelles (+).
Principes généraux
Apport calorique adapté au poids et au niveau d’activité physique.
La répartition est la suivante, à raison de trois repas journaliers :
- glucides : 50 à 55 % (moins en cas d’hypertriglycéridémie ou d’obésité morbide) ;
- lipides : 30 à 35 % ;
- protides : 15 à 20 %, représentant 1 g/kg de poids corporel par jour.
Particularités des glucides
Il s’agit de limiter les sucres purs, mais sans les « diaboliser » : sucre, bonbons, miel, confiture, boissons sucrées.
Les glucides doivent être pris au sein d’un repas mixte (la consommation de légumes et de féculents permet une meilleure absorption des glucides et abaisse le pic glycémique postprandial) et les aliments à index glycémique bas seront privilégiés (pâtes, légumes secs, céréales, pain complet…).
________________________________________________________________________________
À titre d’exemple, 100 g de féculents cuits (soit 20 g de glucides) sont l’équivalent de :
- 100 g de pommes de terre, pâtes, riz, semoule cuits ;
- 60 g de légumes secs (lentilles, haricots blancs) ;
- 40 g de pain ;
- 30 g de farine ou de céréales.
Autre exemple, un fruit de 150 g (soit 15 g de glucides) correspond à :
- 1 pomme, orange, poire, pêche ou brugnon ;
- ½ pamplemousse ;
- 2 clémentines ;
- 3 abricots ;
- 4 prunes ;
- ½ banane ;
- 250 g de fraises, framboises ou groseilles ;
- 100 g de raisins ;
- 12 cerises.
________________________________________________________________________________
Deuxième étape – Règles hygiénodiététiques associées au traitement médicamenteux
Antidiabétiques oraux
Leurs principales caractéristiques sont regroupées dans le tableau 2. Leurs spécificités et leur positionnement dans la stratégie de prise en charge médicamenteuse du diabète de type 2 sont abordés de façon plus détaillée dans la prise de position de la SFD (2019), dont on reprend ici les points essentiels, en attente de la révision attendue en 2021 ou 2022 des recommandations de la HAS.
________________________________________________________________________________
La recommandation proposée par la HAS en 2013 a principalement mis en avant un guide de personnalisation des objectifs glycémiques et une priorisation des moyens de traitement, fondée notamment sur des arguments économiques liés au prix des médicaments. La révision de cette recommandation qui n’a pas intégré les résultats des grandes études d’intervention publiées récemment, est attendue pour 2021. Il existe donc certaines discordances entre cette recommandation et les indications des médicaments telles que notées dans leurs AMM, d’une part, et les consensus d’experts dont celui de la SFD (Société francophone du diabète, publication en 2017 avec actualisation tous les 2 ans, www.sfdiabete.org), d’autre part.
________________________________________________________________________________
Lorsque l’HbA1c est > 10 % au diagnostic, si les arguments cliniques sont en faveur d’un diabète de type 2 (en particulier absence de cétose), une insulinothérapie peut être proposée d’emblée, éventuellement transitoire.
Lorsque l’objectif d’HbA1c n’est pas atteint malgré les modifications du mode de vie, on proposera en première intention un traitement par metformine, à doses progressives jusqu’à la dose maximale tolérée (idéalement entre 2 et 3 g par jour), fractionnée en deux ou trois prises.
Lorsque l’objectif d’HbA1c n’est pas atteint sous metformine chez un patient diabétique de type 2 indemne de pathologie cardiovasculaire ou rénale, l’association metformine + inhibiteur de DPP4 (iDPP4) constitue l’option présentant le meilleur compromis entre efficacité anti-hyperglycémiante et minimisation du risque hypoglycémique (fig. 6).
________________________________________________________________________________
Fig. 6.
Algorithme de stratégie thérapeutique dans le diabète de type 2 selon la SFD, prise de position 2019 (dans l’attente de la révision HAS, attendue en 2021).
iDPP4 : inhibiteurs de la dipeptidyl peptidase-4 ; GLP-1 RA : agoniste des récepteurs du GLP-1 ; iSGLT2 : inhibiteurs des cotransporteurs sodium-glucose de type 2.
(Source : CEEDMM, 2021, d’après le consensus SFD 2019.)

________________________________________________________________________________
L’association metformine + sulfamide hypoglycémiant expose à un risque d’hypoglycémie et de prise de poids. Elle est moins onéreuse que la bithérapie metformine + iDPP4, mais elle nécessite, au moins chez certains patients plus à risque, une autosurveillance glycémique. Elle peut être proposée à des patients à faible risque hypoglycémique. Le choix d’un iSGLT2 ou d’un GLP-1 RA peut être envisagé lorsque l’objectif d’HbA1c n’est pas atteint sous metformine chez le patient obèse (IMC ≥ 30 kg/m2) en tenant compte d’un profil de tolérance moins bon que celui des iDPP4 et d’un coût supérieur à celui des sulfamides hypoglycémiants. Ce choix s’impose chez les patients présentant une maladie cardiovasculaire avérée, une insuffisance cardiaque et/ou une maladie rénale chronique, en choisissant alors une molécule ayant fait la preuve de son bénéfice.
Le choix thérapeutique au-delà de la bithérapie relève d’une discussion avec le spécialiste. Il peut être fait appel à l’un des médicaments non prescrits en bithérapie ou à un traitement par insuline, alors généralement débuté sans arrêt des antidiabétiques oraux sous la forme d’une injection quotidienne unique.
L’utilisation des inhibiteurs de l’α-glucosidase ne fait pas partie des options habituelles et recommandées de traitement du diabète de type 2 en 2021.
Insulinothérapie
Quand ?
Plusieurs éléments entrent en jeu pour déterminer la mise en place d’une insulinothérapie :
- signes de carence en insuline (amaigrissement, asthénie, amyotrophie, cétose éventuelle) qui s’associent généralement au syndrome polyuro-polydipsique ;
- après avoir vérifié l’observance thérapeutique du patient ;
- lorsque l’HbA1c reste supérieure aux objectifs fixés avec le patient, notamment sous antidiabétiques oraux (ce qui définit en général l’échec du traitement oral), mais également sous antidiabétiques oraux associés à un agoniste du récepteur du GLP-1 (cf. fig. 6) ;
- contre-indications ou intolérance aux antidiabétiques oraux ou aux agonistes du récepteur du GLP-1 ;
- dans certaines situations transitoires telles que des affections intercurrentes (plaie de pied, chirurgie, après un accident coronarien, grossesse, etc.).
Comment ?
Insulinothérapie combinée à des hypoglycémiants oraux
Initialement, elle consiste le plus souvent en une injection d’insuline intermédiaire ou lente combinée à des hypoglycémiants oraux. Ce schéma d’insulinothérapie est en général proposé lorsque l’insulinopénie n’est encore que partielle.
La metformine doit être systématiquement maintenue, la poursuite des autres antidiabétiques oraux n’étant pas obligatoire et donc discutée en fonction du profil clinique.
La procédure est la suivante :
- commencer par une injection d’insuline intermédiaire (NPH)ou d’analogue lent (insulines glargine, détémir, dégludec), le plus souvent au coucher (schéma dit « bed time ») ; on notera que, bien que les analogues lents de l’insuline permettent de réduire le risque d’hypoglycémie nocturne, la HAS (2013) met en avant l’insuline NPH, plus économique, en première intention ;
- possibilité de faire l’injection à d’autres moments que le coucher en cas d’utilisation d’un analogue lent ;
- débuter par 0,2 U/kg de poids par jour, en adaptant progressivement la dose selon la glycémie capillaire à jeun (dose moyenne de 40 U par jour ou 0,45 U/kg et objectif glycémique habituel au réveil < 1,10 g/l, à adapter au profil du patient).
Les intérêts d’une insulinothérapie basale combinée à un traitement oral sont les suivants :
- simplicité de l’adaptation de la dose d’insuline sur la glycémie du matin au réveil ;
- nécessité d’une insulinosécrétion résiduelle (ne convient bien sûr pas au diabète de type 1, par exemple).
Insulinothérapie exclusive
Elle consiste habituellement en 2 à 4 injections d’insuline. Avec le déclin progressif de la sécrétion d’insuline au cours du diabète de type 2, l’insulinothérapie peut avec le temps nécessiter 3 voire 4 injections quotidiennes pour atteindre les objectifs fixés. À ce stade, il est recommandé de prendre l’avis d’un spécialiste en diabétologie (Guide Parcours de soins, HAS 2014).
Différents schémas et différentes insulines peuvent être prescrits : insuline basale associée à 1 à 3 injections d’analogue rapide, 1 à 3 injections d’insuline prémix. Dans ces situations, une autosurveillance glycémique pluriquotidienne est nécessaire et la gestion de l’insulinothérapie rejoint celle du diabète de type 1.
Chirurgie bariatrique
Un patient présentant un diabète de type 2 dans un contexte d’obésité peut être éligible à la chirurgie bariatrique si son IMC est > 35 kg/m2 (HAS, 2009).
Bien que ces procédures chirurgicales comportent plus de risques chez les diabétiques, la réduction pondérale — et, au-delà de celle-ci, probablement des mécanismes additionnels liés à des modifications des sécrétions endocrines du tube digestif et du microbiote intestinal — s’accompagne souvent d’une amélioration rapide voire d’une rémission du diabète de type 2, mais la réapparition du diabète est fréquente à distance de la chirurgie. D’autres facteurs de risque cardiovasculaire peuvent aussi s’améliorer comme la dyslipidémie et l’hypertension, ainsi que le syndrome d’apnées du sommeil. Cependant le rapport bénéfice/risque à long terme est toujours en cours d’évaluation. Plus encore qu’en l’absence de diabète, cette option thérapeutique doit faire l’objet d’une évaluation préopératoire multidisciplinaire rigoureuse et d’un suivi prolongé.
________________________________________________________________________________
Ce que le patient doit connaître
Traitement du diabète de type 2
La prise en charge est multifactorielle.
Le patient doit connaître ses objectifs thérapeutiques personnalisés :
- pondéral ;
- glycémiques (HbA1c) ;
- lipidiques ;
- tensionnels.
Il doit connaître les moyens utilisés :
- sevrage tabagique ;
- activité physique ;
- intervention nutritionnelle ;
- traitement médicamenteux ;
- nécessité d’une bonne observance thérapeutique.
Il peut être informé de la nécessité éventuelle d’utiliser de l’insuline au cours de l’évolution naturelle de la maladie, en fonction de l’évolution progressive de l’insulinopénie.
________________________________________________________________________________
________________________________________________________________________________
Points-clés
- Le diabète de type 2 représente la cause la plus fréquente d’hyperglycémie chronique.
- La physiopathologie associe des anomalies de l’insulinosécrétion et de l’insulinosensibilité.
- Les objectifs thérapeutiques concernent le contrôle glycémique (HbA1c < 6,5 % au début de la maladie puis 7 %, à personnaliser) mais également le contrôle tensionnel, lipidique et pondéral (objectifs individualisés à communiquer au patient) ; le diabète de type 2 nécessite une prise en charge globale de la pathologie et de ses complications.
- À long terme, l’objectif est de limiter la survenue et la progression des complications qui représentent l’enjeu de cette pathologie chronique.
- Le traitement repose sur un trépied thérapeutique : changements alimentaires, activité physique régulière et intervention médicamenteuse (antidiabétiques oraux, agonistes du récepteur du GLP-1 et/ou insuline).
- L’évolution naturelle de la maladie peut se faire vers une insulinopénie marquée, qui nécessitera à moyen ou long terme le recours à une insulinothérapie.
________________________________________________________________________________
© CEEDMM – Septembre 2022.
