Item 128 – Ostéopathies fragilisantes
________________________________________________________________________
Situations de départ
- 200 Dyscalcémie.
- 306 Dépistage et prévention ostéoporose.
- 352 Expliquer un traitement au patient (adulte, enfant, adolescent).
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé | Descriptif |
| A | Définition | Connaître la définition de l’ostéoporose (densitométrique et fractures) | Définition OMS |
| B | Prévalence, épidémiologie | Connaître l’épidémiologie des fractures ostéoporotiques | Connaître le sex-ratio |
| B | Éléments physiopathologiques | Connaître la physiopathologie de l’ostéoporose primitive | Carence œstrogénique, héritabilité et activités en charge DMO, vieillissement et antécédent de fractures, hyperparathyroïdie secondaire |
| A | Étiologie | Connaître les causes d’ostéoporose primitive et secondaire | |
| A | Diagnostic positif | Connaître les indications de l’ostéodensitométrie et des autres examens d’imagerie | |
| A | Diagnostic positif | Connaître le bilan biologique de 1re intention | |
| A | Prise en charge | Connaître les différentes mesures hygiéno-diététiques | |
| B | Prise en charge | Connaître les principes du traitement médicamenteux d’une ostéoporose | |
| B | Examens complémentaires | Connaître la sémiologie en radio d’une fracture ostéoporotique | |
| A | Contenu multimédia | Exemple d’ostéoporose avec fracture vertébrale sur une radiographie | |
| B | Contenu multimédia | Exemple d’ostéoporose avec fracture vertébrale sur une IRM | |
| A | Définition | Définition de l’ostéomalacie | |
| A | Diagnostic positif | Connaître les signes cliniques et biologiques devant faire évoquer le diagnostic d’ostéomalacie
|
|
________________________________________________________________________________
Ostéopathies fragilisantes
- Définition
- Classification
- Étiologie
- Caractéristiques des ostéoporoses chez l’homme
I Définition
L’ostéoporose est définie comme une fragilité excessive du squelette liée à une diminution du contenu minéral osseux et/ou à des altérations de la microarchitecture osseuse qui augmentent le risque de fracture.
La relation établie entre la baisse de la densité minérale osseuse (DMO) et l’augmentation du risque de fracture a conduit, en 1994, à une définition « densitométrique » de l’ostéoporose, sur la base d’un T-score inférieur à – 2,5 écarts types de la valeur moyenne de l’adulte jeune. Il faut remarquer que cette définition n’est valable que pour les femmes et pour une mesure de densité osseuse réalisée par absorptiométrie biphotonique à rayons X, ou DXA (Dual energy X-ray Absorptiometry), sur les sites osseux axiaux (vertèbres, extrémité supérieure du fémur, col du fémur) (fig. 1 et 2).
________________________________________________________________________________
Fig. 1
Quatre modèles de densitomètres.
(Source : General Electric et HOLOGIC.)

________________________________________________________________________________
________________________________________________________________________________
Fig. 2
Densitométrie chez une patiente ménopausée sans traitement.
Déminéralisation osseuse prédominant au rachis (T-score au niveau L1–L4 : – 2,9).
(Source : CEEDMM, 2021.)

________________________________________________________________________________
II Classification
L’ostéoporose est une pathologie à prépondérance féminine, mais n’épargne pas les hommes, chez lesquels elle représente un problème relativement commun. Les ostéoporoses sont divisées en deux catégories. On distingue l’ostéoporose primitive « commune », dite ostéoporose post-ménopausique, qui est la forme la plus commune, des ostéoporoses dites secondaires. Ces dernières peuvent relever d’étiologies multiples (tableau 1). Les principales endocrinopathies entraînant un risque accru d’ostéoporose sont d’abord celles qui exposent à une diminution de la production des stéroïdes sexuels (hypogonadisme). D’autres hormones sont impliquées dans la régulation du remodelage osseux ou, de façon plus globale, dans l’homéostasie du calcium. Des anomalies de leur production peuvent favoriser le développement d’une ostéoporose. C’est le cas des hyperthyroïdies, de l’hypercortisolisme, de l’hyperparathyroïdie, qui constituent les causes endocriniennes les plus fréquentes des ostéoporoses secondaires. Des données récentes objectivent une augmentation du risque fracturaire chez les patients atteints d’un diabète de type 1, de même que chez ceux porteurs d’un diabète de type 2.
________________________________________________________________________________
Tableau 1
Ostéoporoses secondaires. (Source : CEEDMM, 2021.)
⁎ Chez l’homme.
| Pathologies endocrines | Hypogonadisme
Syndrome de Cushing Hyperthyroïdie Hyperparathyroïdie Diabète de type 1 et de type 2 |
| Pathologies digestives | Malabsorption (maladie cœliaque)
Entérocolopathie inflammatoire chronique Cirrhose biliaire primitive Chirurgie bariatrique |
| Pathologies générales | Arthrite rhumatoïde
Polyarthrite ankylosante Lupus érythémateux disséminé Myélome multiple Mastocytose Insuffisance rénale, hémodialyse chronique |
| Causes génétiques | Ostéogenèse imparfaite
Mutations du récepteur aux œstrogènes⁎ Mutations du gène de l’aromatase⁎ Homocystinurie |
| Causes médicamenteuses | Corticothérapie
Hormones thyroïdiennes (doses freinatrices) Agonistes de la GnRH Inhibiteurs de l’aromatase Anticonvulsivants Anticalcineurines (ciclosporine A, tacrolimus) Chimiothérapie Héparines non fractionnées Antirétroviraux |
| Autres causes | Alcoolisme, tabagisme
Tubulopathie rénale avec hypercalciurie Immobilisation VIH |
________________________________________________________________________________
III Étiologie
A Hypogonadismes
La carence œstrogénique provoque une augmentation de l’ostéoclastogenèse et l’activation des ostéoclastes, qui augmentent la résorption osseuse et donc la perte osseuse.
La gravité de l’atteinte osseuse dépend de l’intensité et de la durée de l’hypogonadisme.
1 Anorexie mentale
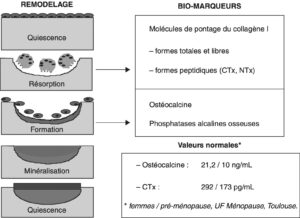
Il s’agit d’une ostéoporose à bas niveau de remodelage. Les marqueurs biochimiques de la formation osseuse (isoenzyme des phosphatases alcalines, ostéocalcine, P1NP) sont le plus souvent diminués. Les marqueurs de la résorption (CTx, NTx) ne sont pas informatifs dans cette indication (fig. 3).
________________________________________________________________________________
Fig. 3
Biomarqueurs osseux.
Ces valeurs sont données à titre indicatif et ne peuvent pas être généralisées à l’ensemble de la population.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
L’origine de l’ostéoporose est multifactorielle même si la carence œstrogénique reste le principal facteur de perte osseuse, en particulier sur le site vertébral.
Les troubles nutritionnels à l’origine d’une diminution de l’IGF-1, de carences calciques et d’une hypoprotidémie jouent un rôle aggravant. Un hypercortisolisme est également souvent retrouvé, malgré l’absence d’apparence cushingoïde en l’absence de substrat graisseux disponible (fig. 4).
________________________________________________________________________________
Fig. 4
Densitométrie chez une patiente atteinte d’une anorexie mentale restrictive avec aménorrhée primaire.
Déminéralisation osseuse prédominant au rachis (T-score au niveau L1–L4 : – 3,9).
(Source : CEEDMM, 2021.)

________________________________________________________________________________
Le traitement repose sur la prise en charge multidisciplinaire de l’anorexie mentale proprement dite. La substitution œstrogénique doit être la règle, le plus rapidement possible et lorsque le diagnostic est établi. Elle repose le plus souvent sur l’utilisation d’une pilule œstroprogestative bien que les données les plus récentes témoignent d’un bénéfice osseux plus marqué avec l’œstradiol administré par voie cutanée. Elle n’a qu’un effet limité sur la DMO mais permet de limiter la perte osseuse, en particulier chez les jeunes filles les plus maigres. Le gain pondéral n’est associé à une amélioration de la DMO que s’il permet un retour des cycles menstruels spontanés.
2 Activité physique intensive
Les femmes sportives soumises à une activité physique trop intense peuvent développer une hypo-œstrogénie d’origine hypothalamique (cf. Item 40 – Aménorrhée).
Les facteurs conditionnant l’atteinte osseuse sont :
- le type et l’importance de l’activité sportive : marathon, danse classique (jusqu’à 60 % d’aménorrhée), demi-fond, triathlon, gymnastique, cyclisme ;
- l’importance et la fréquence des troubles du cycle menstruel ;
- des apports alimentaires réduits ou insuffisants.
L’atteinte osseuse est de répartition inégale. Les contraintes mécaniques stimulent l’ostéoformation sur des sites porteurs ; à l’inverse, l’hypo-œstrogénie est responsable d’une résorption osseuse généralisée, bien qu’à prédominance rachidienne. Il existe également une plus grande fréquence des fractures de fatigue, qui sont favorisées par la diminution de la DMO. L’ostéoporose est réversible avec le retour à la reprise spontanée des cycles menstruels, souvent lors de la réduction de l’activité physique.
En l’absence de possibilité de diminution de l’activité physique, la mise en route d’un traitement hormonal substitutif représente une solution de choix.
3 Pathologies hypophysaires
Toute lésion hypophysaire (tumorale, infiltrante, iatrogène, traumatique, etc.) provoquant une atteinte (réversible ou irréversible) de la fonction gonadotrope peut avoir des conséquences osseuses.
En dehors de leur impact sur l’axe gonadotrope, les atteintes hypophysaires n’ont pas d’impact propre sur le remodelage osseux, à l’exception des adénomes corticotropes dont l’impact osseux est secondaire à l’hypercortisolisme.
4 Hypogonadismes iatrogènes
Tous les traitements diminuant la production des œstrogènes (ou des androgènes chez l’homme) constituent des facteurs potentiels d’augmentation du risque fracturaire. C’est le cas des agonistes de la GnRH, utilisés dans le cadre de pathologies utérines (endométriose, fibromes) ou prostatiques, et des inhibiteurs de l’aromatase dans le cancer du sein. Une mesure de la DMO est préconisée avant ces traitements, la perte osseuse pouvant être rapide, pour permettre une prévention adaptée en fonction du niveau de risque.
À l’arrêt du traitement par les agonistes de la GnRH, on observe une réversibilité de la perte osseuse d’autant plus complète qu’il s’agit de femmes jeunes et présentant initialement une DMO normale.
5 Dysgénésies gonadiques
Le syndrome de Turner est la dysgénésie gonadique féminine la plus fréquente (cf. Item 40 – Aménorrhée).
Une diminution de la DMO est fréquente dans le syndrome de Turner, bien qu’elle puisse être liée en partie à la petite taille des pièces osseuses.
Au cours de l’adolescence, le déficit osseux apparaît s’accentuer du fait de l’hypogonadisme, avec une augmentation du remodelage osseux secondaire à la carence œstrogénique. Chez l’adulte non traité, l’insuffisance ovarienne accentue la perte osseuse et il existe une augmentation du risque de fracture.
Le traitement est avant tout fondé sur la correction de l’hypogonadisme ; l’œstrogénisation est proposée dès que le diagnostic est posé, actuellement le plus souvent en association avec un traitement à l’hormone de croissance de manière à améliorer le pronostic statural. À l’âge adulte, la poursuite d’un traitement œstroprogestatif permet la prévention de la perte osseuse. La DMO vertébrale chez ces patientes bien traitées n’apparaît pas significativement différente de celle des sujets contrôles après ajustement pour la taille staturale.
B Hyperthyroïdies et traitements par hormones thyroïdiennes
L’hyperthyroïdie constitue une cause classique d’ostéoporose secondaire même si la prise en charge actuelle fait que les signes osseux sont exceptionnellement révélateurs ou au premier plan. Ceci justifie le dosage systématique de la TSH dans la recherche étiologique d’une ostéoporose secondaire.
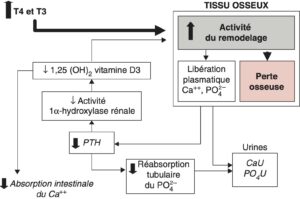
Les hormones thyroïdiennes augmentent le remodelage osseux (fig. 5) du fait d’une augmentation du recrutement des unités élémentaires de remodelage et de leur fréquence d’activation. Il existe une balance négative entre résorption et formation osseuse qui prédomine sur l’os cortical.
________________________________________________________________________________
Fig. 5
Effets des hormones thyroïdiennes sur le tissu osseux et le métabolisme phosphocalcique (Ca++).
CaU, calciurie ; PO4U, phosphaturie.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Une diminution de la DMO de 10 à 20 % par rapport à des sujets de même âge et de même sexe a été rapportée dans beaucoup d’études chez les sujets hyperthyroïdiens. La prévalence des fractures attribuables à l’hyperthyroïdie reste mal appréciée, bien qu’un antécédent d’hyperthyroïdie soit un facteur de risque classique de la fracture du col du fémur chez le sujet âgé.
En l’absence d’hyperthyroïdie biologique, le risque osseux du traitement par hormones thyroïdiennes chez le patient hypothyroïdien n’a jamais été prouvé. L’administration de doses élevées d’hormones thyroïdiennes, telle qu’est est réalisée dans le traitement du cancer thyroïdien différencié hormonodépendant, est en revanche susceptible d’augmenter le risque d’ostéoporose et doit conduire à une évaluation régulière.
C Hypercortisolisme et corticothérapie
L’ostéoporose vertébrale est une des complications classiques d’un excès de corticoïdes, surtout chez la femme. Elle est souvent silencieuse, avant l’apparition de tassements vertébraux « en salve », et doit faire l’objet d’une prévention systématique.
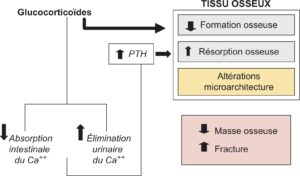
Les effets osseux des glucocorticoïdes sont complexes, résultant d’effets directs sur le tissu osseux et d’effets indirects sur l’homéostasie calcique et la production des stéroïdes sexuels (fig. 6). Au niveau du tissu osseux, les corticoïdes inhibent la fonction ostéoblastique et favorisent leur apoptose comme celle des ostéocytes, qui ont un rôle important dans la qualité de l’os. Ils favorisent par ailleurs l’activité ostéoclastique et donc la résorption osseuse par différents mécanismes, tels qu’une augmentation de la production du RANKL (facteur de l’ostéoclastogenèse) et une diminution de l’ostéoprotégérine (OPGR), inhibiteur de l’ostéoclastogenèse. La réduction de l’absorption intestinale du calcium et l’augmentation des pertes urinaires de calcium induites par l’excès de glucocorticoïdes favorisent par ailleurs un hyperparathyroïdisme secondaire, dont les conséquences osseuses sont encore amplifiées par l’augmentation de la sensibilité des cellules osseuses à la PTH. Enfin, un taux excessif de glucocorticoïdes favorise un hypogonadisme et peut, dans certaines causes, diminuer également la production des androgènes surrénaliens.
________________________________________________________________________________
Fig. 6
Effets des glucocorticoïdes sur le tissu osseux et le métabolisme phosphocalcique (Ca++).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
L’ostéoporose induite par l’hypercortisolisme est essentiellement une ostéoporose à bas niveau de remodelage mais avec tendance à l’hyperrésorption.
La diminution du volume osseux s’accompagne d’altérations de la microarchitecture trabéculaire, qui joue un rôle majeur dans la fragilité osseuse. On peut ainsi observer des fractures à DMO normale.
La diminution de la masse osseuse intéresse surtout les sites trabéculaires (corps vertébraux, côtes, radius) et apparaît de façon rapide, dans la première année de l’exposition aux corticoïdes. L’intensité de la perte osseuse reste difficile à prévoir au plan individuel. Les fractures vertébrales sont fréquentes chez les sujets exposés à un excès de glucocorticoïdes et sont présentes chez 20 % à près de 80 % des sujets atteints d’un syndrome de Cushing, quelle que soit sa cause (fig. 7 à 9).
________________________________________________________________________________
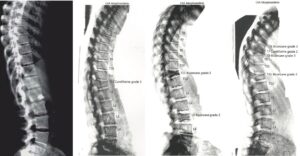
Fig. 7
Plusieurs images de fractures vertébrales (tassements vertébraux) sur la morphométrie vertébrale (comparativement à la première image de gauche, normale).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
________________________________________________________________________________
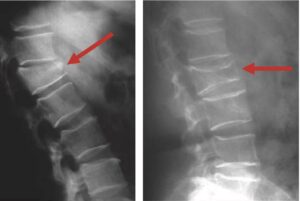
Fig. 8
Images radiologiques de tassements vertébraux (flèches rouges).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
________________________________________________________________________________
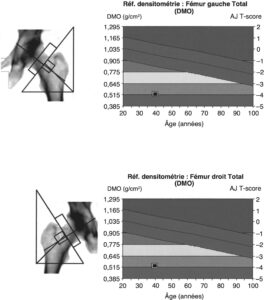
Fig. 9
Densitométrie fémorale chez un patient atteint d’une maladie de Cushing compliquée d’une ostéoporose fracturaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Plusieurs études cas-témoins ont permis d’objectiver une augmentation du risque de fractures, surtout vertébrales mais aussi non vertébrales, chez les sujets ayant reçu une corticothérapie à partir de dose supérieure à 7,5 mg de prednisolone par jour. La réversibilité de l’atteinte osseuse, après correction de l’hypercortisolisme ou arrêt de la corticothérapie, reste encore un sujet débattu en l’absence de données longitudinales suffisantes.
Chez les sujets devant débuter une corticothérapie, la prévention de l’ostéoporose justifie, avant le traitement, une évaluation précise du statut osseux (mesure de la DMO vertébrale et fémorale par DXA) et une recherche de tous les facteurs de risque (statut nutritionnel et vitaminocalcique, activité physique, tabagisme, hypogonadisme, etc.) pouvant être corrigés. La dose de corticoïdes sera la plus faible possible, en donnant la préférence, chaque fois que possible, aux voies non orales et aux molécules à durée de vie courte.
Il faut proposer systématiquement une supplémentation vitaminocalcique. Les doses de calcium prescrites dépendent des apports alimentaires et, dans le syndrome de Cushing, de la calciurie, souvent élevée.
Les bisphosphonates tout comme le tériparatide ont une AMM pour le traitement de l’ostéoporose cortico-induite.
Un traitement de l’ostéoporose est préconisé en cas de corticothérapie de plus de 3 mois avec des doses d’équivalent prednisone supérieure à 7,5 mg par jour si T-score ≤ – 1,5 sur au moins un site.
D Hyperparathyroïdie primitive
(Cf. Item 266 – Hypercalcémie.)
L’hyperparathyroïdie est responsable d’ostéoporose, même lorsqu’elle est asymptomatique, et serait présente, en fonction du site osseux mesuré, chez 12 à 52 % des patients.
La production continue de PTH stimule l’ostéoclastogenèse et donc la résorption osseuse, en augmentant d’une part la différenciation des ostéoclastes à partir de leurs précurseurs hématopoïétiques et, d’autre part, l’activité des ostéoclastes matures. Cet effet est indirect et passe par l’ostéoblaste, qui joue un rôle pivot tant dans les actions cataboliques que dans les actions anaboliques de la PTH sur l’os. Cette action prédomine au niveau de l’os cortical (tiers proximal du radius, fémur), l’os trabéculaire (vertèbres) étant en principe conservé. Une atteinte vertébrale est néanmoins souvent présente, notamment chez la femme en début de ménopause car l’hyperparathyroïdie primitive est l’endocrinopathie la plus fréquente de la femme ménopausée (prévalence de l’ordre de 1 %) (fig. 10).
________________________________________________________________________________
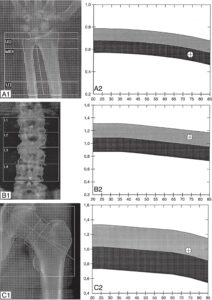
Fig. 10
Densitométrie chez un patient atteint d’une hyperparathyroïdie primaire.
A. Ostéoporose radiale (T-score au tiers proximal du radius : – 2,6). B. Masse osseuse normale au rachis (T-score : + 0,1). C. Masse osseuse normale au fémur total (T-score : – 0,7).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
La diminution de la masse osseuse reste souvent limitée, de l’ordre de 10 % par rapport aux valeurs normales pour l’âge, avec une évolution au plan individuel qui reste difficile à prédire. L’évolution de la masse osseuse après traitement est le plus souvent favorable, et son importance est fonction du type d’os (plus importante au niveau vertébral que périphérique), de la gravité de l’hyperparathyroïdie (taux de PTH et des phosphatases alcalines) et du niveau d’atteinte initiale.
L’augmentation du risque fracturaire chez les patients ayant une hyperparathyroïdie primitive reste un sujet débattu en l’absence de données concluantes. Les fractures intéressent le plus souvent les vertèbres et l’extrémité inférieure du radius, les métacarpes, mais rarement le col du fémur.
L’atteinte osseuse constitue un des éléments essentiels de décision de la conduite à tenir lorsque l’hyperparathyroïdie primitive est asymptomatique : la constatation d’un T-score inférieur à – 2,5 est considérée comme une indication au traitement chirurgical.
Lorsque le traitement chirurgical n’est pas possible (pour différentes raisons), l’utilisation d’un agent antiostéoclastique (œstrogènes, raloxifène, bisphosphonates) ou de calcimimétique (cinacalcet) pourra être discutée en fonction de la situation clinique, si le risque de fracture est avéré ou s’il existe déjà des fractures. En cas de non-indication du traitement chirurgical, une simple surveillance de l’état osseux et une réévaluation périodique (1 ou 2 ans) du risque fracturaire sont conseillées.
IV Caractéristiques des ostéoporoses chez l’homme
A Au niveau de la définition
Il n’existe pas de valeur de T-score reconnue pour définir l’ostéoporose masculine. Des données transversales suggèrent que des valeurs absolues de la DMO seraient associées au même niveau de risque fracturaire dans les deux sexes. Par assimilation, la définition de l’ostéoporose chez l’homme correspond à un T-score inférieur ou égal à – 2,5.
B Au niveau épidémiologique
Parmi les fractures de l’extrémité supérieure du fémur, 25 à 30 % surviennent chez l’homme, et la prévalence des fractures vertébrales découvertes radiologiquement est similaire dans les deux sexes, affectant 10 à 12 % des individus. En revanche, la fracture du radius distal (de type Pouteau-Colles) est beaucoup plus rare chez l’homme que chez la femme, ce qui s’explique avant tout par une taille des pièces osseuses plus importante chez les hommes que chez les femmes.
C Au niveau étiologique
Les ostéoporoses secondaires sont en revanche plus fréquentes chez l’homme que chez la femme (30 à 70 % des cas). Les causes principales sont :
- l’hypercortisolisme ;
- l’hypogonadisme (congénital ou acquis dont iatrogène avec, en particulier, le traitement du cancer de la prostate par castration chimique par analogue de la GnRH ou chirurgicale) ;
- l’alcoolisme.
D Au niveau thérapeutique
Les bisphosphonates et le tériparatide disposent d’une AMM dans le traitement de l’ostéoporose masculine.
________________________________________________________________________________
Points-clés
- Les pathologies endocriniennes représentent l’étiologie principale des ostéoporoses secondaires de la femme.
- Toutes les situations entraînant un hypogonadisme prolongé exposent à un risque accru d’ostéoporose.
- La carence œstrogénique provoque une augmentation du remodelage osseux au bénéfice de la résorption osseuse.
- Un traitement par hormones thyroïdiennes à doses suppressives de la sécrétion de la TSH augmente la perte osseuse corticale et accroît le risque d’ostéoporose fémorale.
- Les traitements par hormones thyroïdiennes à doses substitutives n’augmentent pas le risque d’ostéoporose.
- L’atteinte osseuse de l’hypercortisolisme est précoce et prédomine sur l’os trabéculaire (tassements vertébraux).
- L’évaluation du risque fracturaire est nécessaire chez tout sujet atteint de syndrome de Cushing ou d’hypercortisolisme.
- Dans une hyperparathyroïdie primitive asymptomatique, l’existence d’une ostéoporose (T-score < – 2,5) fait partie des critères de l’indication chirurgicale.
- L’ostéoporose doit être recherchée systématiquement chez l’homme, au même titre que chez la femme, en cas d’hypogonadisme ou d’hypercortisolisme.
________________________________________________________________________________
© CEEDMM – Août 2022.
