Item 219 – Pathologie du fer chez l’adulte et l’enfant : hémochromatose
________________________________________________________________________
Situations de départ
- 21 Asthénie.
- 24 Bouffées de chaleur.
- 41 Gynécomastie.
- 63 Troubles sexuels et troubles de l’érection.
- 164 Anomalie de l’examen clinique mammaire.
- 207 Ferritine : baisse ou augmentation.
- 208 Hyperglycémie.
- 279 Consultation de suivi d’une pathologie chronique.
- 281 Prescription médicamenteuse, consultation de suivi et éducation d’un patient diabétique de type 2 ou ayant un diabète secondaire.
- 306 Dépistage et prévention ostéoporose.
- 328 Annonce d’une maladie chronique.
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé |
| A | Définition | Définition de la carence martiale |
| A | Définition | Définition d’une surcharge en fer |
| B | Éléments physiopathologiques | Principes généraux du métabolisme du fer |
| B | Éléments physiopathologiques | Connaître les deux principaux sites anatomiques en cause dans une carence d’absorption du fer (estomac, grêle proximal) |
| A | Diagnostic positif | Connaître les signes cliniques de la carence martiale |
| B | Diagnostic positif | Connaître les signes cliniques d’une surcharge en fer |
| A | Diagnostic positif | Connaître les situations devant faire évoquer une carence martiale chez l’enfant |
| B | Contenu multimédia | Photographies d’anomalies des ongles liées à la carence en fer |
| B | Contenu multimédia | Photographies d’un exemple typique de mélanodermie |
| A | Diagnostic positif | Connaître les paramètres biologiques permettant d’affirmer une carence martiale |
| A | Diagnostic positif | Connaître les paramètres biologiques permettant d’affirmer une surcharge en fer |
| B | Diagnostic positif | Connaître les diagnostics différentiels d’une anémie par carence martiale |
| A | Étiologie | Connaître les causes principales d’une carence martiale chez l’adulte et chez l’enfant |
| B | Étiologie | Connaître les causes principales d’une surcharge en fer chez l’adulte et chez l’enfant |
| A | Examens complémentaires | Connaître le bilan de première intention d’une carence martiale |
| B | Examens complémentaires | Connaître le bilan de première intention d’une surcharge en fer et les indications de la biopsie hépatique et de l’IRM hépatique |
| A | Examens complémentaires | Connaître les examens à réaliser en première intention devant une carence martiale chez l’enfant |
| A | Prise en charge | Connaître les principes du traitement de la carence martiale chez l’adulte et l’enfant |
| B | Prise en charge | Connaître les principes du traitement de la surcharge en fer |
________________________________________________________________________________
Pathologie du fer chez l’adulte et l’enfant: hémochromatose
- Définition
- Physiopathologie
- Manifestations cliniques
- Diagnostic de l’hémochromatose
- Stades de l’hémochromatose primitive
- Prise en charge thérapeutique
I Définition
L’hémochromatose primitive ou héréditaire est une maladie génétique conduisant à une surcharge en fer. Il s’agit de la maladie génétique la plus fréquente dans la population blanche. Sa prévalence est de 3 à 5 pour 1 000 personnes, mais la pénétrance de la mutation principale touchant le gène HFE (C282Y) est faible et variable.
Non traitée, elle s’accompagne fréquemment d’une atteinte endocrinienne, notamment d’un diabète, liée à la cytotoxicité du fer stocké en excès. La morbidité de la mutation n’est pas réellement évaluée au plan épidémiologique, mais les formes sévères peuvent conduire à une cirrhose et à une augmentation de la mortalité.
L’hémochromatose primitive doit être distinguée des nombreuses autres causes de surcharge en fer (tableau 1).
________________________________________________________________________________
Tableau 8.1.
Causes de surcharge en fer. (Source : CEEDMM, 2021.)
| Hémochromatoses génétiques ou primitives | Mutations de HFE (> 95 %)
Mutations d’autres gènes (plus rares) |
| Surcharges en fer secondaires | Transfusionnelles :
• thalassémie • anémie sidéroblastique Surcharge alimentaire Maladie hépatique chronique : • hépatite B ou C • hépatopathie alcoolique • porphyrie cutanée tardive • stéatose hépatique |
| Causes diverses | Hémosidérose africaine (alimentaire)
Acéruléoplasminémie Atransferrinémie congénitale |
________________________________________________________________________________
II Physiopathologie
A Rappel sur le métabolisme du fer
Du fait de sa capacité à échanger des électrons en situation aérobie, le fer est indispensable au fonctionnement cellulaire, notamment à la synthèse de l’ADN, à la respiration cellulaire et au transport de l’oxygène. L’excès de fer conduit, cependant, à des dommages tissulaires en catalysant la conversion du peroxyde d’hydrogène en radicaux libres susceptibles d’attaquer les membranes cellulaires, les protéines et l’ADN.
Le stock normal de fer est de 35 à 45 mg/kg chez l’homme, un peu inférieur chez la femme avant la ménopause (environ 35 mg/kg). La majorité du fer est incorporée dans l’hémoglobine (60 %), tandis que 10 à 15 % sont retrouvés dans la myoglobine musculaire et les cytochromes (10 %). Le fer circulant, lié à la transferrine, ne représente qu’une faible proportion (1 %). Le foie (1 000 mg) et les macrophages du tissu réticulo-endothélial constituent les principaux sites de stockage du fer.
1 Dans les conditions physiologiques
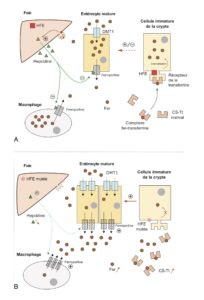
De 1 à 2 mg de fer sont éliminés chaque jour par la transpiration et la desquamation des cellules cutanées et intestinales ou, chez la femme, pendant les règles. Cette perte est compensée par l’apport alimentaire. L’absorption intestinale du fer s’effectue au niveau du duodénum. Le fer alimentaire, réduit à l’état ferreux, est capté au pôle apical de l’entérocyte puis internalisé grâce au transporteur membranaire DMT1 (Divalent Metal Transporter 1). Il peut alors être stocké dans l’entérocyte sous forme de ferritine ou être relargué dans la circulation au pôle basolatéral grâce à la ferroportine (fig. 1A). Dans le sang, le fer circule lié à la transferrine. Le complexe est capté par les cellules utilisatrices, en particulier l’hépatocyte, grâce aux récepteurs de la transferrine (TfR1 et TfR2)et s’accumule dans les cellules sous forme de ferritine. Les macrophages récupèrent le fer ferrique des érythrocytes vieillissants et le refixent sur la transferrine pour une distribution aux tissus.
________________________________________________________________________________
Fig. 1.
Métabolisme du fer chez l’adulte.
- Dans les conditions normales, l’appréciation des besoins en fer de l’organisme par les cellules immatures de la crypte dépend de la concentration intracellulaire du fer, capté par l’intermédiaire du récepteur de la transferrine qui interagit avec la protéine HFE. Les cellules immatures de la crypte, programmées par cette information, se transforment en entérocytes matures. L’activité des transporteurs DMT1 et ferroportine basolatérale permet d’absorber une quantité de fer équivalente aux pertes journalières. L’hepcidine réduit l’absorption du fer par les entérocytes et les macrophages ; sa concentration augmente quand le fer sérique est trop élevé.
- Les mécanismes conduisant à la surcharge en fer au cours de l’hémochromatose primitive ne sont pas totalement élucidés. L’une des hypothèses est que le produit du gène muté HFE ne peut interagir correctement avec le récepteur de la transferrine, ce qui limiterait la captation du fer circulant lié à la ferritine par les cellules immatures de la crypte, conduisant à une déplétion relative de leur contenu en fer. De ce fait, les entérocytes matures exprimeraient les transporteurs DMT1 et ferroportine de manière inappropriée pour compenser le déficit présumé en fer, et cela conduirait à une absorption exagérée du fer. De nombreux travaux suggèrent le rôle central de l’hepcidine dans la genèse de la surcharge ferrique. Au niveau des hépatocytes, son expression est normalement activée par l’augmentation en fer sérique, notamment via la protéine HFE : elle est effondrée au cours de l’hémochromatose, d’où une libération inadaptée du fer par les entérocytes et les macrophages.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Il n’y a pas de régulation de l’élimination du fer : c’est donc son absorption intestinale qui conditionne le stockage du fer dans l’organisme et explique qu’une dysrégulation de l’absorption puisse conduire à une surcharge en fer.
L’expression des transporteurs (DMT1 et ferroportine) dépend donc des stocks de fer intracellulaire.
L’hepcidine, peptide de 25 acides aminés synthétisé par le foie, est l’hormone de régulation de l’absorption du fer. Elle agit sur la ferroportine pour inhiber le transport du fer, entraînant une diminution de son absorption et une augmentation de sa rétention dans les macrophages et les cellules de Kupffer (macrophages résidents du foie). La synthèse de l’hepcidine diminue lorsque les besoins en fer augmentent.
2 Dans l’hémochromatose primitive
L’expression des transporteurs DMT1 et ferroportine est augmentée de manière inappropriée, ce qui conduit à une absorption de fer supérieure aux pertes journalières et à son accumulation progressive dans l’organisme (fig. 1B).
L’hepcidine est effondrée, d’où une majoration du transport en fer ; le mécanisme par lequel les protéines impliquées dans la survenue d’une hémochromatose régulent l’expression de l’hepcidine est mal connu.
En cas d’inflammation, la synthèse de l’hepcidine est augmentée. De ce fait, dans les anémies inflammatoires, il existe une diminution de l’absorption du fer et une rétention élevée dans le système macrophagique.
B Aspects génétiques
L’hémochromatose primitive, représentant plus de 95 % des cas, est liée au gène HFE. Il code une protéine du complexe majeur d’histocompatibilité de classe I, HLA3. Deux mutations ponctuelles, C282Y et H63D, ont été identifiées.
La mutation C282Y (Cys 282 Tyr : remplacement, en position 282, d’une cystéine par une tyrosine) est la plus fortement associée à l’hémochromatose. En France, 90 % des patients porteurs d’une hémochromatose sont homozygotes pour la mutation C282Y (hémochromatose de type 1). La transmission s’effectue sur un mode autosomique récessif mais la pénétrance est incomplète et l’expressivité variable. L’hétérozygotie simplex C282Y n’a pas d’expression clinique.
La seconde mutation H63D du gène HFE (His 63 Asp : remplacement, en position 63, d’une histidine par un acide aspartique) n’est impliquée qu’en cas d’association à la précédente chez des patients hétérozygotes composites C282Y/H63D.
D’autres mutations touchant d’autres gènes ont également été identifiées (hepcidine, ferroportine, hémojuvénile, récepteur de la transferrine) ; elles sont exceptionnelles.
III Manifestations cliniques
Le fer s’accumule progressivement dans le foie, le cœur et les tissus endocrines. Les premiers symptômes sont observés entre 40 et 50 ans chez l’homme. Chez la femme, l’accumulation du fer est retardée par les menstruations et la maladie ne devient généralement patente qu’après la ménopause. Les facteurs de variabilité de l’expression de la maladie sont, outre le sexe, les facteurs génétiques, qui conditionnent le degré de surcharge en fer, et les facteurs d’environnement (rôle aggravant d’une hépatopathie préexistante ou d’un alcoolisme chronique associé). La pénétrance clinique de l’homozygotie C282Y étant très faible, un pourcentage élevé de patients n’aura aucune expression phénotypique de la maladie. En pratique, il est impossible de prédire quels sujets homozygotes pour la mutation C282Y évolueront vers une hémochromatose symptomatique.
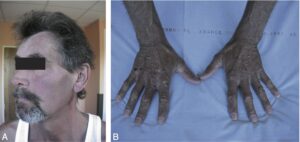
Dans sa forme historique, symptomatique, le tableau clinique de l’hémochromatose associe une mélanodermie diffuse (fig. 2), un diabète sucré, une hépatomégalie (ou « cirrhose bronzée » avec diabète), une cardiomyopathie, des arthralgies et d’autres endocrinopathies (tableau 2).
________________________________________________________________________________
Tableau 2.
Fréquence des signes et symptômes lors du diagnostic d’une hémochromatose symptomatique. (Source : CEEDMM, 2021.)
| Anomalies fonctionnelles hépatiques | 75 % |
| Asthénie, adynamie | 74 % |
| Mélanodermie | 70 % |
| Diabète | 48 % |
| Impuissance | 45 % (hommes) |
| Arthralgies | 44 % |
| Anomalies ECG | 31 % |
________________________________________________________________________________
________________________________________________________________________________
Fig. 2.
Hémochromatose associée à une mélanodermie.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
À l’heure actuelle, le diagnostic est le plus souvent effectué à un stade plus précoce voire présymptomatique ; l’enjeu est alors de prévenir la survenue des complications. En effet, en l’absence de cirrhose ou de diabète, la maladie n’entraîne pas de réduction significative de l’espérance de vie. La fréquence respective des signes et symptômes présents au moment du diagnostic clinique est donnée dans le tableau 2. L’association d’une asthénie inexpliquée, d’arthralgies et d’une élévation des aminotransférases ALAT est considérée comme évocatrice — c’est la règle des trois « A ».
A Atteinte hépatique
Une élévation modérée des enzymes hépatiques, prédominant sur les ALAT, et/ou une hépatomégalie sont observées chez 95 % des patients symptomatiques. L’évolution vers une cirrhose et ses complications explique 90 % des décès dus à l’hémochromatose. Les patients cirrhotiques porteurs d’une hémochromatose ont un risque de carcinome hépatocellulaire de 5 % par an.
B Atteinte cardiaque
L’hémochromatose s’accompagne d’un risque de cardiopathie dilatée.
Elle peut également provoquer des troubles du rythme à type notamment de fibrillation auriculaire. La sévérité de l’atteinte myocardique n’est pas corrélée à celle des autres organes. L’atteinte cardiaque peut être responsable d’une mort subite.
C Atteinte endocrinienne
1 Diabète (+++)
L’hémochromatose peut être responsable d’un diabète. Le risque de diabète est d’autant plus important que le patient a déjà une atteinte hépatique. Le mécanisme principal est une accumulation pancréatique du fer, conduisant à des phénomènes oxydatifs et favorisant la survenue d’une apoptose des cellules β des îlots de Langerhans, les cellules α responsables de la sécrétion de glucagon restant normales, comme la sécrétion exocrine. Il s’agit donc essentiellement d’un diabète lié à une insulinopénie ; mais la surcharge en fer pourrait également être responsable d’une insulinorésistance. Une fois déclaré, le diabète évolue en effet pour son propre compte ; il n’y a généralement pas de régression avec la déplétion martiale.
2 Hypogonadisme hypogonadotrope (+++)
C’est la cause la plus fréquente d’endocrinopathie au cours de l’hémochromatose, en dehors du diabète. L’hypogonadisme peut se révéler par une impuissance chez l’homme, une aménorrhée chez la femme, une perte de la libido ou une ostéoporose. Il s’agit d’une insuffisance gonadotrope liée à une accumulation de fer dans l’hypophyse touchant préférentiellement les cellules gonadotropes. Les saignées ne permettent pas d’obtenir une récupération.
D Atteinte articulaire
L’arthropathie est fréquente, survenant chez un tiers à deux tiers des patients. L’atteinte la plus caractéristique est une arthrite chronique touchant les deuxième et troisième métacarpophalangiennes, responsable d’une « poignée de main douloureuse ». Les interphalangiennes proximales, les poignets, les genoux, les chevilles, les épaules et les hanches peuvent aussi être affectés. Le mécanisme en est mal connu.
L’hémochromatose est une cause importante de chondrocalcinose (+++).
E Atteinte cutanée
La mélanodermie (cf. fig. 2) survient tardivement au cours de l’évolution, conduisant à une coloration grisâtre ou brune des téguments, parfois limitée aux zones découvertes (visage, cou, dos des mains, avant-bras, partie inférieure des jambes) et aux parties génitales. Elle est souvent visible sur la muqueuse buccale.
IV Diagnostic de l’hémochromatose
La découverte du gène HFE a profondément modifié la stratégie diagnostique. Il faut cependant se rappeler que la mutation C282Y à l’état homozygote n’est pas suffisante pour produire la maladie. On doit différencier deux situations :
- la suspicion d’hémochromatose devant des manifestations cliniques ou paracliniques ;
- le dépistage familial chez un patient asymptomatique apparenté au premier degré à un sujet génétiquement atteint.
A Suspicion d’hémochromatose
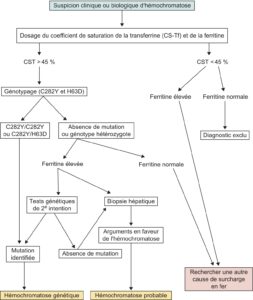
La stratégie diagnostique est schématisée sur la figure 3.
________________________________________________________________________________
Fig. 3.
Diagnostic d’une hémochromatose génétique : arbre décisionnel.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
1 Première étape
La première étape consiste à affirmer biochimiquement l’anomalie du métabolisme du fer. Il faut mesurer le coefficient de saturation de la transferrine (CS-Tf), qui constitue le marqueur le plus sensible et spécifique de la maladie (+++) pour un seuil fixé à 45 %.
Le dosage de la concentration plasmatique de la ferritine permet d’estimer les réserves en fer de l’organisme. Une valeur supérieure à 300 μg/l chez l’homme et à 200 μg/l chez la femme est en faveur d’une surcharge en fer, mais de fausses augmentations sont observées au cours des pathologies inflammatoires. Par ailleurs, au cours de l’hémochromatose, la ferritinémie n’augmente que tardivement lorsque survient la surcharge hépatique en fer. Son dosage permet d’apprécier le stade évolutif de la maladie (+++).
CS-Tf supérieur à 45 %
À cette condition, la suspicion d’hémochromatose primitive est forte. L’élévation de la ferritinémie renforce cette présomption mais sa normalité n’élimine pas le diagnostic (+++).
CS-Tf inférieur à 45 %
À cette condition, l’hémochromatose primitive peut être éliminée. La constatation fréquente d’une ferritinémie élevée associée à un CS-Tf bas doit faire évoquer une autre cause de surcharge en fer (cf. tableau 1), en particulier l’hépatosidérose dysmétabolique, ou NASH (Non Alcoholic Steatosis Hepatitis), observée au cours des syndromes d’insulinorésistance, associant une élévation des ALAT, des γGT et de la ferritinémie à un foie stéatosique à l’échographie : il s’agit d’une cause fréquente de surcharge en fer, susceptible d’évolution vers la fibrose et la cirrhose hépatiques.
Les autres causes sont exceptionnelles, représentées par l’acéruléoplasminémie héréditaire, associant diabète, surcharge hépatique en fer et signes neurologiques (syndrome extrapyramidal, ataxie, démence).
2 Deuxième étape
La deuxième étape consiste à rechercher une mutation C282Y ou H63D du gène HFE, par analyse génétique, après consentement écrit du patient.
Patient homozygote C282Y ou hétérozygote composite
Si le patient est homozygote C282Y +/+ ou hétérozygote composite C282Y/H63D, le diagnostic d’hémochromatose est acquis (HFE1). La ferritinémie permet d’estimer la surcharge ferrique et d’orienter la prise en charge (tableau 3).
________________________________________________________________________________
Tableau 3.
Bilan complémentaire à pratiquer après confirmation du diagnostic d’hémochromatose.⁎ Cf. infra, tableau 5. (Source : CEEDMM, 2021.)
| Évaluation initiale | Interrogatoire
Examen clinique Bilan martial : CS-Tf et ferritine |
|||
| Résultats du bilan martial | CS-Tf < 45 %
Ferritine normale (stade 0)* |
CS-Tf > 45 %
Ferritine normale (stade 1)* |
CS-Tf > 45 %
Ferritine élevée Pas de symptômes (stade 2)* |
CS-Tf > 45 %
Ferritine élevée Symptômes (stades 3 et 4)* |
| Bilan à pratiquer | Pas d’examens complémentaires | Rechercher une atteinte :
• pancréatique (glycémie à jeun) • hépatique (transaminases, échographie) • cardiaque (échographie pour les stades 3–4) • gonadique (dosage de testostérone chez l’homme) • osseuse (ostéodensitométrie si cofacteurs d’ostéoporose) |
||
| Orienter vers un spécialiste en fonction de la clinique et des résultats du bilan
(en particulier si ferritinémie > 1 000 μg/l) |
||||
________________________________________________________________________________
Lorsque la ferritinémie est élevée, il existe un risque de retentissement viscéral et métabolique.
Il est indispensable de pratiquer des examens complémentaires : glycémie à jeun, dosage des transaminases, échographie abdominale, ECG et, en fonction du contexte clinique, radiographies articulaires, échographie cardiaque, bilan hormonal avec dosage de testostérone chez l’homme, ostéodensitométrie osseuse s’il existe des cofacteurs d’ostéoporose.
En fonction des résultats, il sera nécessaire de confier le patient à un spécialiste. Le recours au spécialiste est systématique si la ferritine est supérieure à 1 000 μg/l, pour discuter la réalisation d’examens complémentaires (mesure de la surcharge hépatique en fer par IRM quantitative). La ponction-biopsie hépatique (cf. encadré) n’est pratiquée qu’en cas de suspicion de fibrose et pour rechercher des signes de gravité (cirrhose, carcinome hépatocellulaire).
Patient hétérozygote simplex ou absence de mutation
Si la recherche de mutation est négative ou si le patient est hétérozygote simplex pour C282Y ou H63D, il faut être très critique vis-à-vis du diagnostic d’hémochromatose.
Il faut se souvenir qu’une élévation du CS-Tf n’est pas totalement spécifique de l’hémochromatose (tableau 4). Il faut donc toujours confronter les données clinicobiologiques.
________________________________________________________________________________
Tableau 4.
Causes d’élévation du coefficient de saturation de la transferrine (CS-Tf). (Source : CEEDMM, 2021.)
| – Hémochromatoses génétiques ou primitives
– Supplémentations martiales excessives – Anémies hémolytiques – Dysérythropoïèses – Cytolyses majeures (hépatite C) – Insuffisances hépatocellulaires – Surcharges en fer secondaires |
________________________________________________________________________________
Si le contexte est très évocateur et qu’il existe une élévation persistante de la ferritinémie, on évoquera une autre forme d’hémochromatose héréditaire (hémochromatose juvénile, mutation du gène du récepteur de la transferrine, tableau 2), à rechercher par des tests génétiques de seconde intention. En pareil cas, on proposera le plus souvent une ponction-biopsie hépatique qui pourra donner des arguments en faveur d’une probable hémochromatose héréditaire (index de surcharge ferrique, distribution hépatocytaire du fer).
________________________________________________________________________________
Place de la biopsie hépatique
La biopsie hépatique, autrefois couramment utilisée pour le diagnostic, n’est donc utilisée actuellement que :
- soit à visée diagnostique, en cas d’anomalie ferrique avec enquête génétique négative ;
- soit à visée pronostique, en cas de suspicion d’atteinte hépatique sévère.
________________________________________________________________________________
B Dépistage familial
Le dépistage est proposé de manière systématique chez les apparentés du premier degré. Compte tenu du caractère généralement tardif des manifestations cliniques, il est réalisé chez le jeune adulte. Un bilan martial perturbé conduit d’emblée à la réalisation d’un test génétique pour confirmer le diagnostic. La normalité du bilan martial n’exclut pas le diagnostic. On peut proposer :
- une surveillance régulière du bilan martial ;
- un conseil et un dépistage génétiques qui, dans le cadre de la loi sur le dépistage des apparentés sains des patients porteurs de maladie génétique, seront réalisés avec l’aide du patient, chargé d’informer les apparentés et après accord de ces derniers, par un généticien ou un spécialiste œuvrant dans le cadre d’un réseau spécialisé (cf. tableau 3).
V Stades de l’hémochromatose primitive
On identifie cinq stades (+++) (tableau 5) :
- les stades 0 à 2 correspondent aux phases présymptomatiques de la maladie ;
- les stades 3 et 4 sont des stades symptomatiques avec retentissement métabolique ou viscéral.
________________________________________________________________________________
Tableau 5.
Différents stades de l’hémochromatose primitive. (Source : CEEDMM, 2021.)
| Stade 0 | Hémochromatose asymptomatique
Absence de toute expression phénotypique (CS-Tf < 45 % et ferritinémie normale) |
| Stade 1 | Augmentation du CS-Tf (> 45 %) sans élévation de la ferritinémie |
| Stade 2 | Augmentation du CS-Tf > 45 % et du taux de ferritinémie sans expression clinique ou biologique d’atteinte viscérale ou métabolique |
| Stade 3 | Augmentation du CS-Tf > 45 % et du taux de ferritinémie avec expression clinique pouvant compromettre la qualité de vie (asthénie, impuissance, arthropathie, diabète, hépatopathie non cirrhotique, troubles du rythme cardiaque, mélanodermie) |
| Stade 4 | Augmentation du CS-Tf > 45 % et du taux de ferritinémie avec expression clinique pouvant compromettre le pronostic vital (cirrhose, carcinome hépatocellulaire, diabète requérant de l’insuline, insuffisance cardiaque) |
________________________________________________________________________________
VI Prise en charge thérapeutique
La prise en charge est conditionnée par le stade de la maladie (cf.tableau 8.5) et ses objectifs sont à la fois d’éliminer l’excès de fer (traitement d’induction ou d’attaque) et d’éviter la reconstitution des stocks de fer (traitement d’entretien) (tableau 6).
________________________________________________________________________________
Tableau 6.
Prise en charge thérapeutique de l’hémochromatose. CHC, carcinome hépatocellulaire. (Source : CEEDMM, 2021.)
| Stade 0 | Stade 1 | Stade 2 | Stades 3 et 4 | |
| Traitement
|
Pas de traitement | Traitement déplétif par saignées (sans dépasser 550 ml) :
– phase d’induction hebdomadaire : objectif → ferritine < 50 μg/l – phase d’entretien par saignées tous les 2 à 4 mois pour maintenir une ferritinémie < 50 μg/l
|
||
| Traitement des complications en fonction de la clinique | ||||
| Suivi
|
Tous les 3 ans :
– interrogatoire – examen clinique – ferritinémie et CS-Tf
|
Tous les ans :
– interrogatoire – examen clinique – ferritinémie et CS-Tf
|
– En phase d’induction : contrôle mensuel de la ferritinémie jusqu’au seuil de 300 μg/l chez l’homme et 200 μg/l chez la femme
– En dessous : contrôle toutes les deux saignées – En phase d’entretien : contrôle de la ferritine toutes les deux saignées, contrôle de l’hémoglobinémie 1 semaine avant la saignée
|
|
| Suivi des complications en fonction de la clinique (dépistage du CHC, bilan de diabète, etc.) | ||||
________________________________________________________________________________
A Moyens thérapeutiques
1 Saignées
Les saignées constituent le traitement de référence. Elles ont démontré leur efficacité sur la survie des patients et la régression d’un certain nombre de complications liées à la surcharge martiale (tableau 7). De plus, elles permettent d’éviter l’installation de complications irréversibles, si l’observance est satisfaisante.
________________________________________________________________________________
Tableau 7.
Bénéfices attendus des saignées. (Source : CEEDMM, 2021.)
| Asthénie | Amélioration importante |
| Mélanodermie | Disparition |
| Perturbations du bilan hépatique | Normalisation |
| Hépatomégalie | Résolution habituelle |
| Hépatalgies | Disparition sauf pathologie hépatobiliaire |
| Cirrhose | Irréversible |
| Cardiomyopathie | Amélioration partielle, non certaine |
| Arthralgies | Amélioration partielle |
| Hypogonadisme | Peu réversible |
| Diabète | En général irréversible |
________________________________________________________________________________
Les contre-indications permanentes à la réalisation des saignées sont l’anémie sidéroblastique, la thalassémie majeure et les cardiopathies sévères non liées à l’hémochromatose.
Les contre-indications temporaires sont :
- l’hypotension artérielle (PAS < 100 mmHg) ;
- une concentration d’hémoglobine < 11 g/dl ;
- la grossesse ;
- une artériopathie sévère des membres inférieurs ;
- une fréquence cardiaque < 50/min ou > 100/min.
Dans ces situations ou lorsque le réseau veineux insuffisant ne permet pas la réalisation des saignées, on pourra avoir recours à l’érythraphérèse ou au traitement chélateur.
2 Autres traitements
Érythraphérèse
L’érythraphérèse permet, à l’aide d’un séparateur de cellules, de soustraire en une seule fois un volume plus important d’hématies que les saignées.
Traitement par chélation du fer
Le traitement par chélation du fer constitue une alternative de seconde intention dans les cas de contre-indication permanente ou temporaire ou de non-faisabilité des saignées. La déféroxamine (Desféral®) dispose d’une autorisation de mise sur le marché pour le traitement de l’hémochromatose primitive. Compte tenu de son coût, de ses effets indésirables potentiels (réactions érythémateuses au point d’injection, manifestations allergiques locales ou générales), du mode d’administration (voie parentérale), elle est réservée aux formes non curables par saignées.
3 Mesures associées
L’approche thérapeutique doit également comporter :
- des conseils diététiques visant à supprimer les boissons alcoolisées, notamment tant que la désaturation n’est pas obtenue, et à éviter l’apport en vitamine C qui favorise l’absorption du fer ; en revanche, un régime pauvre en fer n’est pas indiqué ;
- le traitement symptomatique des complications viscérales et métaboliques, lorsqu’elles sont présentes. Leur prise en charge n’est pas différente de celle des mêmes pathologies survenant chez des patients ne présentant pas d’hémochromatose.
En cas de diabète, la surveillance sur le taux de l’hémoglobine glyquée est faussée du fait des saignées (+++).
B Stratégie thérapeutique
La relation entre intensité de la surcharge martiale, risque de survenue des complications (notamment diabète, cirrhose) et surrisque de mortalité est bien démontrée. De ce fait, il est recommandé d’entreprendre les saignées dès que la ferritinémie est supérieure à 300 μg/l chez l’homme et 200 μg/l chez la femme, c’est-à-dire pour les stades 2, 3 et 4 (cf.tableaux 3 et 5).
Les stades 3 et 4 imposent aussi la prévention et le traitement éventuel des atteintes viscérales et métaboliques.
Les stades 0 et 1 ne requièrent aucun traitement.
1 Traitement d’induction
Au cours du traitement d’induction, le rythme des saignées est hebdomadaire ; il peut être adapté au niveau de la ferritinémie et à la tolérance du patient. Le traitement d’induction doit être poursuivi jusqu’à ce que la ferritinémie soit < 50 μg/l. Le volume de sang prélevé varie avec le poids du sujet et ne doit pas dépasser 550 ml. La surveillance régulière vise surtout à contrôler l’évolution de la réduction de la surcharge martiale et à éviter la survenue d’une anémie.
2 Traitement d’entretien
Lorsque la ferritinémie est inférieure à 50 μg/l, on passe au traitement d’entretien, dont l’objectif est de maintenir la ferritine au même taux, en espaçant les saignées tous les 2 à 4 mois en fonction des patients.
C Résultats
La déplétion martiale entraîne une amélioration de l’état général, en 3 à 6 mois, avec atténuation de la mélanodermie, régression de l’hépatomégalie en l’absence de cirrhose et amélioration de l’état myocardique, mais elle entraîne peu de changement de l’état articulaire (cf. tableau 7).
En cas de cirrhose évoluée, une transplantation hépatique peut être envisagée, mais le résultat de la transplantation est moins bon dans cette indication, du fait notamment des complications cardiaques.
Le diabète ne disparaît pas avec la déplétion martiale, qui facilite cependant son équilibration.
On observe une mauvaise réponse de l’insuffisance gonadique, qui doit être compensée par un traitement hormonal substitutif en l’absence de contre-indication.
________________________________________________________________________________
Points-clés
- La physiopathologie de l’hémochromatose a été éclaircie par la découverte de l’hepcidine, nouveau régulateur du métabolisme du fer. Néanmoins, de nombreuses inconnues persistent encore.
- La suspicion diagnostique existe dès que le coefficient de saturation de la transferrine (CS-Tf) est > 45 %.
- La forme génétique la plus fréquente est due à la mutation homozygote C282Y du gène HFE.
- La recherche de complications est systématique dès que la ferritine est élevée.
- Le traitement par saignées dès que la ferritine est élevée a pour but d’éviter les complications.
- Les principales complications sont le diabète, la cirrhose et le cancer du foie, l’hypogonadisme, les atteintes articulaires.
- Le dépistage génétique a radicalement modifié la stratégie diagnostique.
________________________________________________________________________________
© CEEDMM – Août 2022.
