Item 38 – Infertilité du couple : conduite de la première consultation
________________________________________________________________________
Situations de départ
- 33 Difficulté à procréer.
- 41 Gynécomastie.
- 63 Troubles sexuels et troubles de l’érection.
- 78 Acné.
- 94 Troubles du cycle menstruel.
- 164 Anomalie de l’examen clinique mammaire.
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé | Descriptif |
| A | Définition | Connaître la définition de la fertilité, fécondité, fécondabilité d’un couple | |
| A | Définition | Connaître la définition d’un couple infertile | |
| B | Épidémiologie, prévalence | Connaître la fertilité et fécondité dans la population générale | Intégrer l’effet de l’âge sur la fertilité |
| B | Diagnostic positif | Connaître les éléments de l’interrogatoire et de l’examen clinique chez la femme | |
| B | Diagnostic positif | Connaître les éléments de l’interrogatoire et de l’examen clinique chez l’homme | |
| B | Étiologie | Connaître l’orientation diagnostique en fonction du contexte et des manifestations associées | Connaître les présentations cliniques orientant vers une origine particulière d’infertilité |
| B | Examens complémentaires | Connaître le bilan de première intention d’une infertilité féminine et/ou masculine | |
| B | Examens complémentaires | Principes d’interprétation d’un spermogramme | Conditions de recueil, respect des conditions pré-analytiques, principales anomalies… |
| B | Étiologie | Connaître les principales causes d’infertilité chez la femme | |
| B | Étiologie | Connaître les principales causes d’infertilité chez l’homme
|
|
________________________________________________________________________________
Infertilité du couple: conduite de la première consultation
- Généralités, définitions, prévalences
- Interrogatoire
- Examen clinique
- Examens complémentaires orientés
- Etiologie de l’infertilité du couple
- Conclusion
I Généralités, définitions, prévalences
On considère un couple comme infertile en l’absence de grossesse après un an de rapports sexuels non protégés.
Dans la population générale, 70 % des grossesses souhaitées sont obtenues après 6 mois et 90 % après un an. En France, un couple sur sept (14 %) consulte pour désir d’enfants.
Le terme de stérilité ne peut être employé que si la situation d’infertilité est définitive (ménopause, castration bilatérale, etc.).
La fertilité d’un couple dépend de la fécondité de l’un et de l’autre partenaire : l’évaluation en parallèle des deux membres du couple est obligatoire (+++).
La fécondabilité de la femme se définit par la probabilité de grossesse en fonction des moments du cycle. Elle est au mieux de 25 % par cycle d’exposition. La fécondité est la capacité à se reproduire.
Dans un couple infertile, l’infécondité est d’origine féminine dans un tiers des cas, masculine dans un tiers des cas ; elle est partagée dans le dernier tiers (+++).
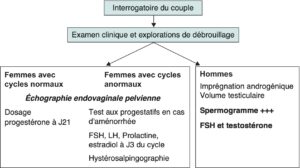
L’exploration d’un couple infertile doit donc être menée parallèlement chez les deux partenaires (fig. 1), même en cas de cause évidente chez l’un des deux partenaires.
________________________________________________________________________________
Fig. 1
Conduite à tenir lors de la première consultation.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
II Interrogatoire
A Pour le couple
L’interrogatoire porte sur :
- la durée de vie commune, avec/sans contraception ;
- La fréquence des rapports sexuels, leur programmation en préovulatoire ou non ;
- la revue des antécédents médicaux et des traitements antérieurs ou en cours ainsi que des explorations préalablement réalisées.
B Chez la femme
1 Âge au moment de la consultation
L’âge est un élément capital du pronostic (+++) : la fécondité se détériore après 35 ans, la fécondité maximale étant observée à 28 ans. Elle est très faible après 40 ans.
On interrogera sur l’âge de la puberté et des premières règles, le caractère régulier des cycles menstruels (25 à 35 jours, 28 ± 2 jours) ou irrégulier en l’absence de tout traitement.
2 Ancienneté de l’infertilité
L’ancienneté de l’infertilité sera recherchée ainsi que son caractère primaire ou secondaire, c’est-à-dire la notion d’une grossesse antérieure ou non, avec le même ou un autre partenaire, y compris la recherche de fausses couches spontanées : interruption de grossesses préalablement documentées par un dosage d’hCG (gonadotrophine chorionique humaine) ou une échographie.
On recherchera également des IVG anciennes (+++).
3 Notions d’infections et/ou de curetages (+++)
On recherche des infections génitales (salpingites) et des curetages utérins (post-partum, post-abortum).
4 Antécédents infectieux
Antécédents infectieux, tels que les infections sexuellement transmissibles.
5 Douleurs pelviennes
La présence de douleurs pelviennes au moment des règles ou lors des rapports est évocatrice d’endométriose ou de séquelles infectieuses.
6 Conditions de vie
Le stress, une alimentation sélective avec éviction des lipides, un régime restrictif et/ou une activité sportive intense (compétition, jogging, plus de 6 à 7 heures par semaine) peuvent induire une infertilité (cf. aussi « Aménorrhée hypothalamique fonctionnelle », Item 42 – Aménorrhée).
La recherche d’addictions est nécessaire (tabac, alcool, cannabis, etc.).
7 Antécédents iatrogènes ovariens et pelviens
- Radiothérapie pelvienne (+++) ou hypothalamo-hypophysaire.
- Chimiothérapies gonadotoxiques (+++).
- Antécédents de chirurgie pelvienne : ovarienne et/ou utérine, en particulier du col utérin.
C Chez l’homme
1 Troubles de la libido et de l’érection
Entraînant des rapports sexuels peu fréquents ou incomplets.
2 Antécédents de pathologie testiculaire
Antécédents de cryptorchidie (+++) (cf. Item 50 – Pathologies génito-scrotales), de traumatisme testiculaire ou d’infection testiculaire bilatérale (orchite ourlienne).
3 Antécédents chirurgicaux pelvien et scrotal
Des antécédents de hernie inguinale bilatérale opérée doivent faire évoquer une lésion chirurgicale des canaux déférents et/ou de la vascularisation testiculaire à l’origine d’une atrophie testiculaire. Des antécédents de chirurgie du col vésical ou, surtout, une paraplégie ou un diabète ancien avec neuropathie végétative peuvent entraîner une éjaculation rétrograde dans la vessie.
4 Antécédents médicaux
Recherche d’antécédents médicaux, tels que les infections sexuellement transmissibles, les sinusites et bronchites à répétition (pouvant faire suspecter une mucoviscidose).
5 Recherche d’exposition aux toxiques et aux causes iatrogènes
Il s’agit de la prise de toxiques ou une éventuelle exposition professionnelle (solvants organiques, pesticides, autres perturbateurs endocriniens), les addictions (alcool, tabac ++, cannabis, héroïne, sport de compétition — dopage à la testostérone et/ou aux anabolisants +++).
Les traitements passés (chimiothérapie, radiothérapie abdominopelvienne ou hypophysaire +++) ou en cours seront détaillés.
III Examen clinique
A Chez la femme
L’examen clinique évalue :
- la taille et le poids, avec le calcul de l’IMC ;
- les signes éventuels d’hyperandrogénie(hirsutisme, acné, séborrhée) ;
- l’aspect de la peau (acanthosis nigricans signant une insulinorésistance, cf. Item 42 – Aménorrhée) ;
- une galactorrhée provoquée (++) évoquant une hyperprolactinémie (cf. Item 42 – Aménorrhée et Item 244 – Adénome hypophysaire) ;
- d’éventuelles bouffées de chaleur(en faveur d’une insuffisance ovarienne prématurée).
Sont également évalués à l’examen gynécologique :
- la trophicité vaginale ;
- l’état apparent du col utérin ;
- la présence de gros fibromyomes utérins.
B Chez l’homme
Les éléments suivants sont recherchés :
- la taille et le poids pour calculer l’IMC ;
- des signes d’hypoandrisme: faible pilosité, faible masse musculaire, adiposité augmentée ;
- des cicatrices de gestes chirurgicaux (plis inguinaux, scrotum, cryptorchidie) ;
- une gynécomastie ;
- un aspect gynoïde, eunuchoïde ;
- autres signes : hypospadias, infection du méat, autres anomalies de la verge.
Un examen général sera aussi effectué avec toucher rectal en cas d’antécédent infectieux récent, pour rechercher une prostatite subaiguë.
Le volume testiculaire (+++) — 80 % du volume des testicules sont constitués par les tubes séminifères — est un élément capital du bilan initial. Il est apprécié au mieux à l’aide d’un orchidomètre de Prader (fig. 2) ou, à défaut, mesuré en centimètres avec un mètre ruban. Chez l’adulte, le volume normal est de 15 à 20 ml.
________________________________________________________________________________
Fig. 2
Orchidomètre de Prader.
Il permet la mesure clinique du volume testiculaire.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
La palpation testiculaire permet de préciser la fermeté, l’asymétrie et la sensibilité. La palpation du cordon spermatique permet de rechercher les déférents (impression de corde tendue) et, en position latérale des testicules, les épididymes, avec parfois perception d’un kyste. Cet examen permet aussi la recherche de varicocèle — dont la responsabilité dans l’infertilité est discutée.
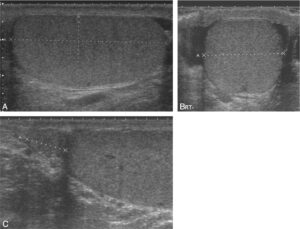
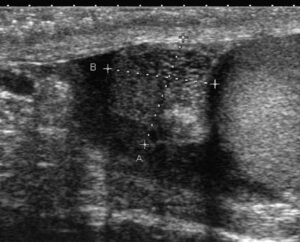
En cas d’azoospermie, l’examen clinique doit être toujours complété par une échographie testiculaire (fig. 3 et 4).
________________________________________________________________________________
Fig. 3
Échographie de testicule normal.
A. et B. Aspect échographique d’un testicule adulte normal (coupes longitudinale et transversale, respectivement). C. Image échographique de la tête d’un épididyme normal.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
________________________________________________________________________________
Fig. 4
Azoospermie obstructive.
Dilatation avec aspect kystique de la tête épididymaire dans le cadre d’une azoospermie obstructive.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
IV Examens complémentaires orientés
A Exploration hormonale et morphologique de première intention chez la femme
1 Exploration hormonale (+++)
En cas d’aménorrhée ou d’irrégularités menstruelles, on cherche d’abord à préciser leur mécanisme (cf. Item 42 – Aménorrhée).
Les dosages indispensables dans un premier temps sont ceux de l’œstradiol (ou estradiol, abrégé « E2 », car il possède deux groupes hydroxyle), de LH, de FSH et de prolactine plasmatiques.
Si les cycles sont réguliers, on cherche à préciser leur caractère ovulatoire par un dosage de progestérone plasmatique, à J22–J23 du cycle (22 ou 23 jours après le début des règles) (+++).
Le dosage de l’AMH n’est pas nécessaire dans le bilan d’infertilité et ne donne pas un bon pronostic de la fertilité naturelle.
2 Échographie pelvienne (+++)
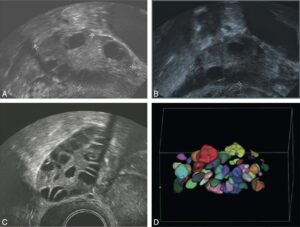
C’est un examen non invasif qui occupe une place prépondérante dans l’évaluation d’une femme infertile. Réalisée par voie endovaginale, l’échographie précise la taille et l’aspect des ovaires et permet d’évaluer le compte des follicules antraux (CFA) — avec les échographies modernes (fig. 5), facteur pronostique :
- CFA < 5/ovaire : pronostic moins bon ;
- 5/ovaire < CFA < 20/ovaire : plutôt bon pronostic ;
- CFA > 20/ovaire : en faveur d’un syndrome des ovaires polymicrokystiques avec un aspect en couronne et parfois une hypertrophie du stroma ovarien (cf. Item 40, Aménorrhée).
________________________________________________________________________________
Fig. 5
Aspects échographiques des ovaires normaux et pathologiques.
A. Ovaire droit normal chez une femme de 25 ans explorée dans le cadre d’une infertilité masculine. Noter la taille normale (5 cm2, volume 6 ml) avec quelques follicules antraux dont le comptage en trois dimensions a montré un chiffre normal de dix follicules par ovaire. B. Aspect échographique d’un ovaire chez une femme de 34 ans atteinte d’insuffisance ovarienne primitive. Noter la petite taille (3 cm2, volume 4 ml) avec un nombre réduit de follicules antraux (moins de quatre follicules par ovaire). C. Aspect en échographie bidimensionnelle de l’ovaire droit chez une femme de 21 ans avec un syndrome des ovaires polykystiques. Noter une surface de 8 cm2 nettement augmentée (normale < 6 cm2) et de nombreux follicules antraux de moins de 10 mm. D. Comptage folliculaire précis réalisé par l’échographie tridimensionnelle montrant un CFA > 20/ovaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
L’échographie permet aussi de mesurer l’épaisseur de la muqueuse utérine et de montrer la présence d’éventuels polypes ou fibromes.
3 Hystérographie
L’hystérographie précise l’intégrité et la perméabilité de l’utérus et des trompes. Elle doit être obligatoirement effectuée en dehors de toute infection génitale évolutive (risque d’endométrite ou de salpingite) et après avoir écarté une grossesse.
Elle est réalisée en phase folliculaire moyenne vers le 8e–10e jour du cycle. Elle permet d’apprécier la cavité utérine, l’état et la perméabilité des trompes ainsi que le passage plus ou moins facile du produit de contraste dans la cavité péritonéale (fig. 6).
________________________________________________________________________________
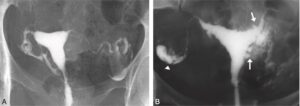
Fig. 6
Hystérographie.
A. Hystérographie normale. B. Hydrosalpynx droit et adénomyose (spicules des bords et du fond utérin : flèches).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
B Exploration de première intention chez l’homme
1 Spermogramme (+++) et spermocytogramme
C’est l’examen fondamental chez l’homme.
Le sperme doit être émis au laboratoire, par masturbation, après un délai d’abstinence de 3 à 5 jours.
Les trois paramètres essentiels sont :
- la concentration (+++) ;
- la mobilité ;
- la morphologie des spermatozoïdes.
Les principales caractéristiques du sperme normal ainsi que les principales anomalies retrouvées chez les hommes infertiles sont indiquées dans le tableau 1 (critères de l’OMS 2010).
________________________________________________________________________________
Tableau 1
Valeurs normales du spermogramme selon l’Organisation mondiale de la santé (OMS) (modifiées en 2010). Normes établies pour une abstinence sexuelle de 2 à 7 jours. (Source : CEEDMM, 2021.)
| Paramètre | Valeur normale | Définition de l’anomalie |
| Volume | 1,5 à 6 ml | < 1,5 ml : hypospermie
> 6 ml : hyperspermie |
| pH | 7,2–8 | |
| Concentration | > 15 millions/ml
> 39 millions/éjaculat |
0 : azoospermie
< 15 millions/ml : oligospermie > 200 millions/ml : polyspermie |
| Mobilité | > 30 % de mobilité progressive (a + b) | < 30 % : asthénospermie |
| Morphologie
|
OMS 1999 : > 30 % de formes typiques (selon la classification David) | Tératospermie
|
| OMS 2010 : > 4 % de formes typiques (selon la classification Kurger) | ||
| Vitalité | > 58 % de formes vivantes | < 58 : nécrospermie |
| Agglutinats | Absence | |
| Leucocytes | < 1 million/ml | > 1 million/ml : leucospermie |
________________________________________________________________________________
Le spermogramme tient la première place dans le bilan d’une infertilité masculine. Mais cet examen doit être interprété de façon critique, surtout si les anomalies sont modérées. En effet, l’extrême variabilité des paramètres, à la fois inter- et intra-individuelle, rend difficile l’établissement de critères précis de normalité. Les conditions de recueil doivent être également soigneusement contrôlées.
Une affection même bénigne et de courte durée, telle qu’un épisode grippal, est susceptible de retentir sur les caractéristiques du sperme émis 2 à 3 mois plus tard, en raison de la durée de 74 jours du cycle de la spermatogenèse.
Lorsqu’il apparaît pathologique, le spermogramme doit être contrôlé 3 mois plus tard.
2 Exploration hormonale (+++)
Elle doit être réalisée systématiquement en cas d’oligospermie inférieure à 10 millions/ml ou d’azoospermie. Chez l’homme, l’exploration hormonale simple permet de diagnostiquer un déficit gonadotrope hypothalamo-hypophysaire ou une insuffisance testiculaire primitive par les dosages de testostérone totale, de LH, de FSH. La prolactine doit être mesurée en cas de troubles de la libido avec dysfonction sexuelle ou bien de gynécomastie (cf. Item 246) non expliquée ou devant toute insuffisance gonadotrope.
C Test post-coïtal (ou test de Hühner)
Bien qu’encore réalisé par certaines équipes en France, son intérêt est très discuté. Il est réalisé près de 2 heures après un rapport sexuel, en période péri-ovulatoire, après une abstinence de 3 à 4 jours. Il explore l’interaction entre mucus cervical et spermatozoïdes, déposés lors du rapport, dans la glaire de qualité optimale en période péri-ovulatoire. Il est fait pour dépister une pathologie de la glaire cervicale, préciser les caractéristiques de mobilité de spermatozoïdes in vivo et rechercher une incompatibilité immunologique entre le sperme et le mucus cervical.
V Étiologie de l’infertilité du couple
A Chez la femme
1 Anovulations (+++) et dysovulations
L’anovulation est une cause très fréquente d’infertilité féminine (près de 20 % des cas d’infécondité du couple). Son diagnostic est le plus souvent évident devant l’existence d’une aménorrhée ou d’irrégularités menstruelles (cf. Item 42 – Aménorrhée), mais des cycles réguliers n’éliminent pas une anovulation.
Les ovulations de mauvaise qualité (dysovulations) peuvent parfois refléter une infertilité ; elles sont caractérisées par une phase lutéale courte et/ou défectueuse, avec une sécrétion insuffisante de progestérone. Par fréquence décroissante, il peut s’agir (cf. Item 42 – Aménorrhée) :
- d’un syndrome des ovaires polymicrokystiques (SOPK) ;
- d’une hyperprolactinémie ;
- d’une baisse de la réserve ovarienne, voire d’une insuffisance ovarienne primitive ;
- d’un déficit gonadotrope d’origine hypophysaire (FSH et LH basses) ;
- d’un déficit gonadotrope de cause hypothalamique, en particulier psycho-nutritionnelle (stress, activité physique intense, restriction alimentaire et pondérale) ou tumorale.
2 Obstacles mécaniques
Anomalies du col utérin et insuffisance de glaire cervicale
Elles sont la conséquence de sténoses cervicales apparues après conisation, curetage ou diathermocoagulation de l’endocol. Ces lésions peuvent être responsables d’une pathologie de la glaire cervicale et constituent l’indication de choix aux inséminations intra-utérines avec sperme du conjoint (IAC).
Obstacle et anomalies utérines
Ce sont les malformations utérines avec cloisonnement ou des synéchies infectieuses ou secondaires à des manœuvres endo-utérines du post-partum ou après une interruption de grossesse. Elles sont visualisées par l’hystérosalpingographie et, de plus en plus, par l’échographie avec produit de contraste. En deuxième intention, la visualisation de la cavité utérine par hystéroscopie permet le diagnostic et parfois le traitement (synéchie de petite taille).
Dans d’autres cas, il peut s’agir de polypes muqueux, de fibromes sous-muqueux ou d’une hyperplasie endométriale.
Le rôle de ces anomalies dans l’infertilité doit être regardé de façon critique car, en dehors d’un volumineux fibrome sous-muqueux, elles ne sont pas toujours en rapport avec l’infertilité.
Obstacle tubaire
Il s’agit d’une cause majeure d’infertilité féminine (+++).
Le plus souvent l’obstacle tubaire est secondaire à une salpingite (parfois passée inaperçue, Chlamydia +++), un traumatisme chirurgical ou une endométriose.
Le diagnostic repose sur l’hystérosalpingographie qui montre l’obstacle, son caractère uni- ou bilatéral, ou l’existence de diverticules évocateurs d’endométriose.
La cœlioscopie, comprenant une épreuve de perméabilité au bleu, permet de faire au mieux l’inventaire des lésions, donc de mieux préciser le pronostic et de réaliser en outre des gestes thérapeutiques. Elle est également réalisée en cas d’infertilité inexpliquée, permettant parfois de mettre en évidence des foyers d’endométriose.
L’obstacle tubaire bilatéral est une indication féminine majeure de fécondation in vitro (FIV).
3 Endométriose
Une endométriose modérée, asymptomatique n’est que rarement la cause de l’infertilité.
Des lésions endométriosiques sont retrouvées chez 50 % des femmes consultant pour « infertilité idiopathique ».
Le diagnostic est parfois évoqué devant l’existence de douleurs pelviennes, soit menstruelles soit coïtales (dyspareunie profonde), ou après réalisation d’une hystérographie qui montre des images plus ou moins typiques — diverticules du segment interstitiel des trompes (images en « boule de gui »), images d’angulation ou de rétention ampullaire — ou sur des lésions visibles à l’échographie pelvienne. L’IRM pelvienne est l’examen de référence pour le bilan des lésions.
L’hystérosalpingographie peut cependant être normale, ce qui justifie la réalisation d’une cœlioscopie chez une femme présentant une infécondité inexpliquée lorsqu’il y a des signes d’appel. Cette dernière montrera des foyers d’endométriose (grains bleutés) plus ou moins nombreux, uni- ou bilatéraux, pouvant être localisés y compris dans le péritoine ou les ovaires (kystes). La cœlioscopie permet de préciser le stade de l’endométriose (en plus de l’IRM pelvienne), d’en découvrir les sites lésionnels et de les traiter.
B Chez l’homme
1 Azoospermies
Trois éléments guident la démarche étiologique : le volume testiculaire, les signes d’hypogonadisme et le taux de FSH.
Il ne faut pas oublier les antécédents de cryptorchidie (+++) (cf. Item 50).
Azoospermies sécrétoires dites aussi non obstructives
Elles sont définies par l’absence de production de spermatozoïdes par les testicules.
Diagnostic
L’azoospermie est presque toujours non obstructive lorsque le volume testiculaire est petit (< 10 ml). Le plus souvent la concentration plasmatique de FSH est élevée en raison d’une atteinte testiculaire mais il peut, plus rarement, s’agir d’un hypogonadisme hypogonadotrophique.
Dans certains cas, des patients porteurs d’authentiques azoospermies sécrétoires peuvent présenter un volume testiculaire et une concentration plasmatique de FSH proches de la normale.
Étiologie
Chez ces patients, le caryotype (+++), obligatoire en première intention, permet souvent le diagnostic de syndrome de Klinefelter (formule caryotypique 47,XXY ou mosaïque 46,XY/47,XXY) qui s’associe quasi constamment avec un volume testiculaire < 2 ml, voire < 1 ml.
L’analyse moléculaire du bras long du chromosome Y permet de mettre en évidence des microdélétions des régions AZF (Azoospermia Factor) chez 18 à 38 % de ces patients.
Une échographie testiculaire (fig. 7) permet d’éliminer un cancer testiculaire, plus fréquent dans ces cas.
________________________________________________________________________________
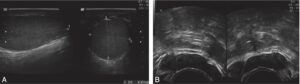
Fig. 7
Échographies testiculaires et des organes génitaux internes.
A. Échographie testiculaire normale. B. Échographie des voies spermatiques : présence de deux vésicules séminales normales.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Une exploration chirurgicale avec biopsie testiculaire et extraction de spermatozoïdes (TESE, TEsticular Sperm Extraction) permet parfois de réaliser une ICSI (IntraCytoplasmic Sperm Injection).
Les déficits gonadotropes congénitaux ou acquis sont aussi une cause d’azoospermie non obstructive mais, chez ces patients, c’est le tableau d’hypogonadisme qui domine le plus souvent et le diagnostic est confirmé par les dosages hormonaux (baisse de la testostérone avec FSH et LH anormalement normaux ou bas). Dans la grande majorité des cas, ces patients consultent pour des troubles de la libido avec dysfonction sexuelle et très rarement pour une infertilité. Il s’agit d’une cause rare (moins de 5 % des cas) mais curable par un traitement médical simple (gonadotrophines exogènes).
Azoospermies excrétoires, obstructives ou par obstacle
Elles sont la conséquence d’une obstruction des voies excrétrices.
Diagnostic
Ce diagnostic est toujours évoqué lorsque le volume gonadique et la concentration plasmatique de FSH sont normaux.
Un examen clinique soigneux de l’appareil excréteur (épididymes, déférents, vésicules séminales et prostate) permet parfois de dépister la cause mais leur recherche fait toujours appel à une échographie scrotale et des organes génitaux internes.
Principales causes
Parmi les causes congénitales, il faut insister sur les agénésies bilatérales des canaux déférents (+++). Le diagnostic repose sur la non-perception de canaux déférents à la palpation, associée à une distension de la tête et une atrophie du corps de l’épididyme, confirmées à l’échographie.
Cette affection est le plus souvent secondaire à une anomalie biallélique du gène CFTR (Cystic Fibrosis Transmembrane conductance Regulator), qui est aussi responsable de la mucoviscidose. Dans sa forme sévère, le diagnostic est évident devant des anomalies de la fonction pancréatique exocrine, des infections bronchopulmonaires sévères et une agénésie congénitale des déférents, responsable d’azoospermie.
Il existe cependant des formes génitales isolées où le diagnostic, fortement suspecté par l’agénésie des déférents à l’échographie, ne pourra être fait que par l’analyse moléculaire du gène CFTR, conduisant à un conseil génétique (+++) et à une exploration de la conjointe en raison de la forte fréquence des mutations hétérozygotes dans la population générale non malade.
Les obstacles épididymaires acquis, dont l’origine infectieuse n’est le plus souvent que présumée (gonocoque, Chlamydia), représentent l’étiologie principale des azoospermies excrétoires. Chez ces patients, le déférent est souvent palpable, parfois gros ou présentant des nodules.
2 Oligo-asthéno-térato-spermies (OAT)
Les oligo-asthéno-térato-spermies représentent une des causes les plus fréquentes d’infécondité masculine.
Diagnostic
Il repose sur la réalisation d’au moins deux spermogrammes montrant une diminution du nombre et de la mobilité des spermatozoïdes, associée à une fréquence élevée de formes anormales.
Les OAT constituent un simple symptôme dont les causes sont le plus souvent inconnues, mais dans certains cas génétiques.
L’enquête étiologique chez ces patients est similaire à celle utilisée chez les sujets atteints d’azoospermie. Chez près de 10 % des patients atteints d’OAT extrême (< 5 · 106 spermatozoïdes/ml), un caryotype doit être demandé et des microdélétions du bras long du chromosome Y recherchées si le caryotype est normal.
Traitement
Le plus souvent, ce sera le recours à une technique d’assistance médicale à la procréation : IAC (insémination de la femme avec le sperme du conjoint réalisée en intra-utérin), FIV (fécondation in vitro), ICSI (injection intracytoplasmique du spermatozoïde), en particulier lors d’un problème immunologique ou d’une mobilité très basse ou absente.
L’âge de la femme joue un rôle essentiel dans le choix thérapeutique.
VI Conclusion
L’infertilité est un motif fréquent de consultation puisqu’il concerne un couple sur sept environ. Les causes sont multiples et touchent autant la femme que l’homme. Elles doivent être recherchées par une exploration minutieuse, en parallèle toujours chez les deux membres du couple. L’exploration est orientée toujours lors de la première consultation dont le rôle est fondamental. Elle doit permettre d’évaluer en première ligne : la sexualité du couple, l’âge de la femme, l’état tubaire et utérin, la présence et la qualité de l’ovulation chez la partenaire féminine, et, chez l’homme, la qualité du sperme et l’absence d’hypogonadisme. La détermination des facteurs étiologiques orientera toujours la prise en charge. Celle-ci peut aller de l’abstention thérapeutique (exploration normale, infertilité récente et femme jeune) aux techniques les plus sophistiquées d’aide médicale à la procréation. En cas d’anomalie du caryotype ou génétique, un conseil génétique est impératif.
________________________________________________________________________________
Points-clés
- On considère un couple comme infertile en l’absence de grossesse après un an de rapports sexuels non protégés.
- La fertilité d’un couple dépend de la fécondité des deux partenaires. L’exploration d’un couple infertile doit donc être menée parallèlement chez les deux partenaires.
- Chez la femme, l’âge est un élément capital du pronostic : la fertilité baisse nettement après 35 ans.
- Chez la femme, on recherchera avant tout une anomalie cervicale, utérine ou des trompes et une anovulation. La prise en charge thérapeutique doit être précédée et orientée par l’enquête étiologique.
- Chez l’homme, après avoir vérifié le volume testiculaire et la sécrétion normale de testostérone, l’examen clé est le spermogramme.
________________________________________________________________________________
© CEEDMM – Août 2022.
