La Lettre Thyroïde de la SFE – Septembre 2015
Les premières représentations anatomiques de la glande thyroïde sont celles de Léonard de Vinci dans son Atlas d’anatomie paru vers 1500.
 |
||||||||
|
||||||||
|
||||||||
|
Thyroïde et non « thyréoïde » = en forme de porte (ou de fenêtre) et non de bouclier Les premières représentations anatomiques de la glande thyroïde sont celles de Léonard de Vinci dans son Atlas d’anatomie paru vers 1500. En raison de sa forme « en bouclier » dit-on, la glande fut baptisée à Londres un siècle et demi plus tard par Thomas Wharton du nom de thyréoïde (de ?u?e??, thyreos : bouclier et ?i??, oida : pareil à). Le grand Emile Littré et d’autres peinèrent en vain à imposer cette dénomination de thyréoïde que pourtant justifiait cette étymologie : « Les livres d’anatomie disent thyroïde, mais c’est une faute » (Littré, Dictionnaire de la Langue Française). Cette orthographe figure encore dans de vieux dictionnaires médicaux (Dictionnaire de Médecine, de Chirurgie, de Pharmacie et des Sciences qui s’y rapportent, par E. Littré, de l’Institut et de l’Académie de Médecine, 21e édition antérieurement refondue par A. Gilbert [1908], Librairie JB Bayer et Fils). On retrouve aussi cette origine dans le terme de « thyréotoxicose », état d’intoxication par les hormones thyroïdiennes, à distinguer de l’hyperthyroïdie qui désigne l’hyperfonctionnement de la glande. De même parle-t-on d’hormone thyréotrope ou de thyréostimuline (TSH). Le très remarquable et récent dictionnaire de la Langue Française qu’a coordonné Alain Rey (Dictionnaire historique de la Langue Française, Le Robert 2011), indique en réalité une étymologie différente. La dénomination de la glande ne tire pas son origine de thyreos, mais de thyros. Ce terme indo-européen a la signification de porte ou fenêtre dont on conçoit bien les deux battants. Il a donné en allemand « die Tür », en anglais « the door ». Cette étymologie est plus séduisante. On comprend mal qu’une forme en deux lobes réunis par un isthme ait pu être comparée à un bouclier de quelque époque qu’il fût. Fendu en deux en sa partie médiane, ce bouclier eut constitué une bien piètre protection pour celui qu’il aurait été censé protéger. L’erreur est venue d’une transcription. Alors thyroïde et non thyréoïde, en forme de porte ou de fenêtre et non de bouclier, la vérité méritait d’être rétablie et connue. Si pour vous persiste un doute, continuez à souligner dans votre enseignement que la forme de la glande est celle d’un élégant papillon, en deux ailes réunies par un isthme. Et considérez vous comme thyroïdologue le jour où vous finirez par penser et déclarer qu’un papillon est un animal en forme de thyroïde. |
||||||||
 |
||||||||
|
Faut-il réhabiliter la microbiopsie thyroïdienne ? Trente six pour cent en moyenne des nodules thyroïdiens faisant l’objet d’une cytoponction ont un résultat cytologique non-diagnostique ou indéterminé (catégories I, III, IV et V du système de Bethesda) [1]. La microbiopsie peut-elle apporter une solution pour diminuer le nombre de chirurgies à visée diagnostique chez ces patients ? Historique Technique actuelle des microbiopsies thyroïdiennes Douleur liée au geste Place dans les nodules non-diagnostiqués (Bethesda I) Place dans les nodules comportant des atypies de signification indéterminée (Bethesda III) Place dans les nodules à type de néoplasme folliculaire (Bethesda IV) Faut-il généraliser la microbiopsie en première intention dans les nodules échographiquement suspects ? Conclusion Références
Épigénomique et pathologies thyroïdiennes À l’heure où la carte de référence de l’épigénome humain vient de paraître (1), il est intéressant de faire le point sur les différents travaux qui ont émaillé l’épigénome des pathologies thyroïdiennes. L’influence épigénétique est exercée par trois mécanismes : modifications des histones (acétylation et méthylation principalement) et méthylation des îlots CpG de l’ADN, permettant la régulation de la compaction de la chromatine et ainsi l’accessibilité des facteurs de transcription sur l’ADN ; action des microARNs qui réalisent une régulation post transcriptionnelle par inhibition de la synthèse protéique. L’expression de près de la moitié des protéines codées pour le génome humain est ainsi régulée de façon tissu-spécifique par des mécanismes épigénétiques. Parmi les mécanismes habituels, une hyperméthylation des îlots CpG et une désacétylation des histones (en particulier du résidu lysine en 27 de l’histone H3) conduisent à l’extinction de l’expression génique. Le consortium international de l’épigénome humain (IHEC, International Human Epigenoma Consortium) a maintenant décrit l’épigénome de 111 types cellulaires et leur réseau de régulation (expression des méthylases, acétylases, etc.) permettant de capter la diversité de l’épigénome et d’identifier la combinaison de marqueurs épigénétiques reflétant au mieux la fonction spécifique de chaque cellule. Les auteurs font état de 15 signatures épigénétiques principales représentant la dynamique de cette régulation et permettant d’envisager l’exploration de l’impact de l’âge et de l’état nutritionnel sur l’expression tissu-spécifique des pathologies. La réversibilité des modifications épigénétiques ouvre le champ aux thérapeutiques de la dynamique épigénétique tels les inhibiteurs de méthyltransférases de l’ADN ou les anti-HDAC (histone déacetylases). Dans le cadre de la pathologie thyroïdienne, l’exploration de l’épigénome a d’abord été associée au développement tumoral. Les aberrations de méthylation des îlots CpG de l’ADN sont liées à une diminution spécifique de l’expression de gènes suppresseurs de tumeurs tels PTEN, RASSF1A, TIMP3, SLC5A8 (NIS), TSHR, DAPK, RAPbeta2 et RAP1GAP ou, au contraire, à la surexpression d’oncogènes (2). Le statut de méthylation de ces gènes sert ainsi à la fois de marqueurs de progression tumorale et de sensibilité aux thérapeutiques (3). C’est particulièrement le cas des cancers anaplasiques pour lesquels des thérapies par anti-HDACl permettent actuellement de stopper la progression tumorale (4). Dans les cancers thyroïdiens différenciés, l’analyse du statut épigénétique lié à l’expression de NIS, montre à la fois une hyperméthylation des îlots CpG du promoteur de ce gène (5) et une déacétylation des différents histones environnant ce promoteur. Il est démontré que la présence de la mutation BRAF V600E est corrélée au maintient des histones dans un état déacétylé conduisant ainsi à la perte d’expression du transporteur NIS (6). L’utilisation combinée de thérapies ciblant la voie BRAF et d’anti-HDAC, chez les patients présentant un cancer papillaire avec mutation BRAF, est alors pertinente pour assurer la restauration de l’expression de NIS. Dans les pathologies thyroïdiennes auto-immunes, l’implication de mécanismes épigénétiques est de découverte plus récente mais semble essentielle au développement de ces pathologies liées initialement à des gènes de susceptibilité tels le récepteur de la TSH et la thyroglobuline. Un mécanisme épigénétique peut ainsi amplifier l’effet d’un variant non pathogène. C’est le cas du gène de la thyroglobuline pour lequel une modification de l’état de méthylation des histones situés au niveau du promoteur de ce gène conduit à la fixation du facteur IRF1 (Interferon regulatory factor 1) sur le promoteur, uniquement en présence du polymorphisme de susceptibilité à la maladie de Basedow (7). La même équipe a depuis identifié un mécanisme de susceptibilité aux pathologies thyroïdiennes auto-immunes, pour le gène du récepteur de la TSH. La présence d’un polymorphisme homozygote dans l’intron 1 du gène TSHR le rend sensible au recrutement d’un répresseur transcriptionnel en présence de modifications épigénétiques du résidu lysine de l’histone H3 (8). L’interféron alpha étant maintenant connu comme un inducteur majeur du remodelage chromatinien (9), les interactions génétiques – épigénétiques semblent cruciales pour le développement des pathologies auto-immunes, dans un contexte d’infection virale. Ces différents travaux ouvrent ainsi le champ thérapeutique des pathologies thyroïdiennes en ciblant maintenant les modificateurs de la dynamique épigénétique que ce soit pour des pathologies tumorales ou auto-immunes. Références
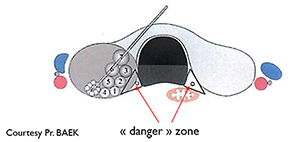
L’interventionnel non chirurgical en pathologie thyroïdienne Classiquement, le traitement des nodules thyroïdiens bénins relève de la médecine nucléaire en cas de formation hyperfonctionnelle, de l’alcoolisation en cas de lésion kystique et dans la majorité des cas de la chirurgie (1). Un siècle après la description de la thyroïdectomie par Théodore Kocher, la technique est parfaitement au point et donne les résultats qu’on en attend. Pourtant, depuis une quinzaine d’années on recherche des alternatives à la chirurgie car : – c’est une pratique imposant une anesthésie, une hospitalisation et un arrêt de travail ; – elle garde des complications, en nombre constant, avec un préjudice esthétique pas toujours pris en compte. Par ailleurs, les patients ont changé, aidés en cela par des réseaux sociaux structurés et influents. Certains sont en particuliers devenus réticents aux substitutions définitives et craignent les cicatrices (ce qui explique le développement de la chirurgie robotique). Enfin, la période de disette ne permet plus la prise en charge annuelle par la collectivité de 40 000 thyroïdectomies dont on estime à 10 000 celles qui ne relèvent pas des indications clairement définies par les conférences de consensus. Les micro-ondes et la cryothérapie étant au stade expérimental, nous disposons de trois techniques de thermoablation qui ont en commun : – le même principe physique : l’élévation focale de la température à 85°C pour obtenir la carbonisation centrale du nodule et à 65°C pour détruire les vaisseaux de sa couronne périphérique, le privant ainsi d’une possibilité de regrossir ensuite ; – la nécessité d’une analgésie par anesthésie de la capsule complétée le plus souvent par une sédation consciente (impliquant un anesthésiste avec une consultation d’anesthésiologie préopératoire), le patient devant pouvoir répondre aux questions ; – un guidage échographique constant afin de vérifier l’avancement de la procédure et l’absence de risque d’atteinte des structures avoisinantes ; – la prise en charge en secteur ambulatoire avec arrêt d’activité le jour de la procédure. Lors de la sortie une ordonnance d’analgésique adaptée est remise avec un numéro d’urgence et un RDV dans les 72 heures suivantes ; – une sélection rigoureuse des nodules éligibles au traitement
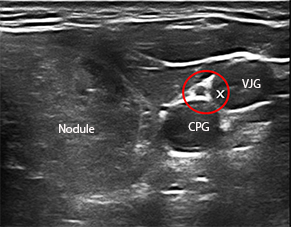
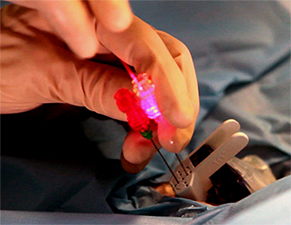
Ces trois techniques sont : LE LASER (2) : la chaleur est véhiculée par des fibres (2 à 4) [figure 2] introduites au travers d’aiguilles dont le trajet est prédéterminé sur l’écran de contrôle [figure 3]. Ces fibres sont reliées à un générateur via une console affichant l’énergie délivrée par chaque fibre modulée à la demande de l’opérateur en fonction du résultat obtenu.
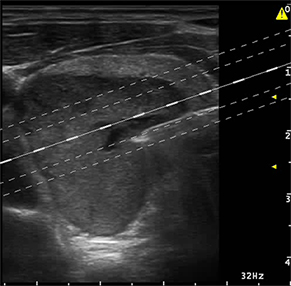
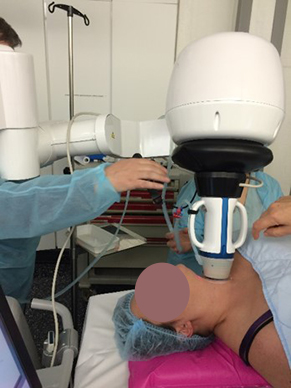
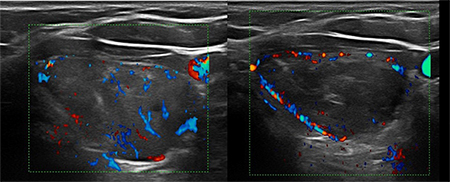
LA RADIOFRÉQUENCE (3) : l’énergie est délivrée par une aiguille bipolaire, qui est mobilisée en fonction des zones traitées et de celles à détruire [figure 4]. Cette aiguille est réfrigérée dans toute sa partie non active par un liquide via une pompe péristaltique. La mobilité de l’aiguille permet une destruction plus complète du nodule. L’ÉCHOTHÉRAPIE OU HIFU (ultrasons focalisés de haute intensité) [4] est une technique non intrusive. Les ultrasons sont focalisés et délivrés en transcutané par un transducteur spécifique hébergeant une sonde d’échographie classique permettant le réglage initial et le suivi de la procédure [figure 5]. C’est une combustion en « grains de riz », la zone à traiter étant informatiquement déterminée au début de l’acte. Dans les 3 cas, un contrôle échographique Mode B et Doppler est réalisé en fin de procédure [figure 6], éventuellement sensibilisé par une injection de produits de contraste ultrasonores. Un pansement réfrigéré est disposé pour éviter les phénomènes douloureux (éventuellement complété par une injection de corticoïdes.) Ces trois techniques ont des avantages respectifs (5), la non intrusion pour la HIFU, la possibilité de traiter de plus grosses tumeurs pour la radiofréquence, un coût un peu moindre pour le laser. C’est l’opérateur qui choisira la plus appropriée lors des consultations préalables. Il doit justifier d’une expertise robuste en échographie et en interventionnel ; il doit avoir appris les différentes techniques dans les centres de référence. Les publications traitant de ces 3 techniques indiquent une réduction de volume nodulaire de 50 à 80 %. Notre équipe dispose des trois systèmes de traitement. Les résultats de la première étude seront exposés lors du Congrès de la SFE (7-10 octobre).
Références bibliographiques
|
||||||||
 |
||||||||
|
L’incidence des cancers thyroïdiens est liée à celle de l’échographie et de la cytoponction D’après Zevallos JP Hartman CM, Kramer JR, Sturgis EM, Chiao EY. Increased thyroid cancer incidence corresponds to increased use of thyroid ultrasound and fine-needle aspiration : a study of the Veterans Affairs Health Care System. Cancer 2015;121(5):741-6. Plusieurs études récentes ont montré une augmentation de l’incidence des cancers thyroïdiens dans les pays développés ces 30 dernières années. Les données du registre américain SEER (Surveillance, Epidemiology and End Results) ont ainsi mis en évidence un triplement de cette incidence entre 1975 et 2009. Retrouvés dans toutes les études, ces résultats suscitent cependant certaines controverses concernant la réalité de cette augmentation, un certain nombre de données allant dans le sens d’une plus grande détection du nombre de cas liée à des modifications des pratiques médicales. Deux études, toujours américaines, ont ainsi montré que le risque de cancer thyroïdien était lié au niveau socio-culturel et au niveau de protection sociale, suggérant que l’augmentation de l’incidence observée était bien liée à une meilleure détection des cas. Mais d’autres études ont montré que l’augmentation de l’incidence concerne tous les stades, ce qui plaide contre un biais de dépistage. L’intérêt de cette nouvelle étude est qu’elle porte sur une population homogène de Vétérans, pris en charge dans un système de santé spécifique. Elle permet donc d’étudier en parallèle l’évolution des pratiques médicales et l’incidence des cancers thyroïdiens. L’étude a porté sur la période 2000-2012 et sur une population totale de plus de 10 millions de personnes dépendant de ce système de santé. Durant cette période, 157 000 patients ont bénéficié d’une échographie thyroïdienne et un peu plus de 15 000 d’une cytoponction (dans les 2 cas, seul le 1er examen était compté pour chaque patient). Sur l’ensemble de la population, 8 877 cas de cancers thyroïdiens ont été diagnostiqués. Entre 2000 et 2012, le nombre de cancers est passé de 331 à 870 (x 2,63), alors que le nombre d’échographies a été multiplié par 4,77 et celui des cytoponctions par 8,12. À noter de plus que 30 % des patients pris en charge pour un cancer thyroïdien n’avaient pas eu l’échographie et la cytoponction dans le système de santé des Vétérans. À n’en pas douter, cette nouvelle étude devrait provoquer les mêmes controverses que celles que l’on a connues notamment pour le cancer de la prostate ou celui du sein. Les termes utilisés par les auteurs, « surdiagnostics » de maladies « infra-cliniques » devraient cependant être employés avec prudence, car la question n’est pas de poser trop de diagnostics de cancers thyroïdiens, dont on sait bien que l’immense majorité est actuellement diagnostiquée à un stade pré-clinique, ce qui contribue sans aucun doute à son excellent pronostic (seuls les papillaires semblent concernés par cette augmentation d’incidence), mais bien celle du bénéfice apporté au patient par un diagnostic précoce par rapport à tous les inconvénients induits par un diagnostic de cancer qui ne se serait pas exprimé au cours de la vie du patient et pour lequel il va subir les effets indésirables physiques (chirurgie, etc.) et psychologiques. Le coût pour la société n’a par ailleurs, à notre connaissance, jamais été évalué. Il ne fait pas de doute que la situation en France est probablement pire compte tenu de la pratique extrêmement large de l’échographie thyroïdienne dans un système de soins où rien ne limite son utilisation… pour le moment. La communauté endocrinologique française serait sans doute bien inspirée de se saisir de ce sujet pour essayer de définir des bonnes pratiques consensuelles et raisonnables avant que le financeur se substitue au médecin. Incidentalomes thyroïdiens dans la néoplasie endocrinienne multiple de type 1 D’après Lodewijk L, Bongers PJ, Kist JW et al. Thyroid incidentalomas in patients with multiple endocrine neoplasia type 1. Eur J Endocrinol 2015;172(4):337-42. Nous disposons de peu de données sur la prévalence des tumeurs thyroïdiennes dans la néoplasie endocrinienne multiple de type 1 (NEM1). D’après les recommandations de l’Endocrine Society publiées en 2012, les tumeurs thyroïdiennes identifiées chez les sujets ayant une NEM1 sont à considérer comme des incidentalomes. Leur fréquence est évaluée à plus de 25 % (1). L’objectif de ce travail néerlandais était d’évaluer la prévalence des incidentalomes thyroïdiens dans une population de sujets ayant une NEM1 (n = 102) comparée à celle d’une population contrôle sans NEM1 ayant bénéficié d’une échographie thyroïdienne (n = 201). Après appariement selon le sexe et l’âge, les données de 95 sujets de chaque groupe étaient comparées. L’expression de la ménine dans le tissu thyroïdien tumoral des sujets NEM1 a été analysée par immunohistochimie. Les incidentalomes thyroïdiens étaient décrits chez 45 % des sujets NEM1 et 51 % des sujets contrôles. La fréquence des lésions décrites en échographie était similaire dans le groupe NEM1 comparé au groupe sans NEM1, avec respectivement : des goitres multinodulaires dans 26 et 31 % des cas, des nodules uniques dans 15 et 17 %, des nodules kystiques dans 4 % pour les 2 groupes. Il n’y avait pas non plus de différence en termes de taille des nodules au sein des 2 groupes (médiane à 6 mm versus à 8 mm). Après analyse histologique (disponible chez 17 sujets NEM1), les adénomes folliculaires et dysplasies nodulaires étaient les lésions les plus fréquentes. L’analyse immunohistochimique a mis en évidence une expression conservée de la ménine dans le tissu thyroïdien tumoral des sujets NEM1. Un microcarcinome médullaire de la thyroïde et un microcarcinome folliculaire étaient décrits. Dans la NEM1, la perte de fonction du 2e allèle du gène MEN1 est responsable de la survenue des tumeurs puisque la ménine, protéine suppresseur de tumeur, n’est plus fonctionnelle. Toutefois, dans les quelques cas rapportés de carcinomes thyroïdiens diagnostiqués dans la NEM1, il n’a pas été mis en évidence de perte d’hétérozygotie du gène, ce qui suggère l’absence de relation causale entre NEM1 et carcinome thyroïdien (2, 3, 4). En définitive, la prévalence des incidentalomes thyroïdiens chez les sujets ayant une NEM1 est similaire à celle des sujets contrôles. Ces nodules thyroïdiens doivent être pris en charge selon les mêmes modalités que chez la population indemne de NEM1. Les résultats de cette étude cas-contrôles sont en accord avec les conclusions des recommandations de l’Endocrine Society de 2012. Références bibliographiques
Sélénium et fonction thyroïdienne D’après Winther HK, Bonnema SJ, Cold F et al. Does selenium supplementation affect thyroid function? Results from a randomized, controlled, double-blinded trial in a Danish population. Eur J Endocrinol 2015;172(6):657-67. Le sélénium (Se) est un oligo-élément retrouvé dans des protéines impliquées dans la synthèse et le métabolisme des hormones thyroïdiennes : les iodothyronines désiodases qui catalysent la conversion de la T4 en T3, la péroxydase d’action antioxydante et la thiorédoxine réductase impliquée dans la différenciation tissulaire. Le statut en Se varie selon la prise alimentaire d’une population à l’autre. L.B. Rasmussen et al. avaient décrit une association inverse entre les concentrations plasmatiques de Se, le volume thyroïdien et la fréquence des goitres en 2011 (1). L’objectif de ce travail danois était d’évaluer les effets de la supplémentation en Se sur la fonction thyroïdienne, dans des conditions d’apport diététique suffisant en Se. Ce travail a été réalisé à partir de l’étude DK-PRECISE (Danish PREvention of Cancer by Intervention with SElenium). Cette étude est prospective, randomisée, contrôlée, en double aveugle. Étaient exclus les sujets ayant une altération de la fonction rénale ou hépatique, un cancer, une infection VIH, un traitement immunosuppresseur ou des compléments alimentaires contenant du Se, administrés dans les 6 mois avant l’étude. Les données de 4 groupes de sujets étaient analysées : 1 groupe placebo (n = 126), 1 groupe recevant 100 ?g de Se (n = 124), 1 groupe recevant 200 ?g de Se (n = 122) et 1 groupe recevant 300 ?g de Se (n = 119). Tous les sujets ont bénéficié d’un dosage plasmatique de Se, TSH, T3 et T4 libres à l’inclusion, à 6 mois et 5 ans. Aucune différence n’était notée entre les 4 groupes en termes de caractéristiques cliniques. Le nombre de sujets décédés lors du suivi n’était pas significativement différent non plus. Une analyse binaire comparait les sujets traités par Se et les sujets traités par placebo. Une analyse par dose comparait les résultats obtenus en fonction des doses croissantes de Se reçues. Vingt-quatre sujets ont présenté des effets indésirables : chute de cheveux, réaction cutanée ou rainures des ongles. Néanmoins, il n’y avait pas de différence de survenue de ces effets en analyse binaire. Ces effets n’étaient pas non plus significativement liés à la dose de Se. De façon attendue, les concentrations plasmatiques étaient augmentées chez les sujets traités par Se et ce, de façon dose dépendante. Cette augmentation des concentrations de Se était surtout observée les 6 premiers mois de traitement puis une phase de plateau était constatée. En analyse binaire, le Se n’avait pas d’impact sur la TSH, la T3 ni la T4 dans le groupe traité comparé au groupe placebo. L’analyse tenant compte des doses, a mis en évidence une diminution de la TSH et de la T4 inversement associée à la dose reçue de Se durant les 5 ans de l’étude. Chaque augmentation de dose du Se de 100 ?g/J de Se diminuait la TSH et la T4 respectivement de 0,066 mU/l et 0,11 pmol/l. Ces résultats sont discordants avec ceux de l’étude anglaise UK-PRECISE (2) qui portait sur moins de sujets (n = 368) avec un suivi plus court (6 mois) et qui n’avait pas mis en évidence d’impact du Se sur la fonction thyroïdienne. Ici, les auteurs rappellent que les mécanismes d’action du Se sur la fonction thyroïdienne ne sont pas identifiés. Ils évoquent le rôle supra-physiologique et potentiellement toxique du Se sur le métabolisme des hormones thyroïdiennes ce qui explique l’effet dose-dépendant. Un impact direct du Se sur l’hypophyse à type de feed-back négatif est évoqué, expliquant la baisse de TSH. Une limite de l’étude est l’absence d’évaluation de l’auto-immunité thyroïdienne dans les 4 groupes. En conclusion, la supplémentation en Se affecte la fonction thyroïdienne de façon dose dépendante et doit conduire à la prudence dans le choix des indications et des posologies administrées. En effet, de nombreux travaux suggèrent son intérêt dans l’orbitopathie basedowienne et les thyroïdites auto-immunes mais il n’y a aucun consensus validant les modalités d’administration du Se dans ce contexte. Références bibliographiques
|
||||||||
 |
||||||||
|
Image commentée
Patiente de 40 ans présentant un hippocratisme digital dans le cadre d’une ostéopathie hypertrophiante (OHA) associée à un carcinome vésiculaire différencié invasif de la thyroïde. L’évolution a été marquée par la survenue d’une récidive locale réfractaire à l’iode, opérée et radiothérapée. Des hémoptysies obligeant à de multiples embolisations témoignent d’une atteinte pulmonaire sans qu’il n’ait été mis en évidence de cancer primitif pulmonaire ni bronchique. Le dosage du VEGF (Vascular endothelial growth factor) était normal. L’OHA est un syndrome paranéoplasique rare associant des douleurs articulaires, osseuses, des appositions périostées des os longs et un hippocratisme digital. Elle s’intègre classiquement dans le cadre de pathologies broncho-pulmonaires et est exceptionnellement associée à un cancer de la thyroïde (1). Références bibliographiques
|
||||||||
|
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d’un droit d’accès, de rectification et d’opposition aux informations vous concernant qui peut s’exercer par courrier à : SFE 88, rue de la Roquette – 75011 – Courriel : webmaster@sfendocrino.org |
||||||||
 |