|
Comment gérer les nodules thyroïdiens à cytologie indéterminée ?
Jean-Louis Wémeau (Lille)
Seuls 5 % des nodules thyroïdiens sont malins. L’examen cytologique par ponction à l’aiguille fine constitue le meilleur procédé pour leur reconnaissance diagnostique (1). L’immense mérite de la conférence qui s’est tenue en octobre 2007 à Bethesda (Washington, États-Unis) a été de proposer, sinon une lecture objectivement identique, au moins une présentation analogue des résultats en six catégories. Toutes sont assorties d’une évaluation pronostique (2). Ainsi, le clinicien sait qu’une cytologie déclarée de classe II a toutes les chances d’être bénigne dans plus de 97 % des cas. En cas de cytologie maligne (classe VI), le cancer est confirmé dans plus de 97 % des cas. La faillite de l’examen tient d’une part aux cytologies ininterprétables (classe I : moins de 5 amas de cellules analysables) qui s’observent dans 3 à 20 % des cas en fonction de l’expérience et de l’habileté du cytoponctionneur ; d’autre part, aux cytologies indéterminées qui concernent environ 25 % des prélèvements. On aura de l’indulgence pour le projet chirurgical retenu dans la classe V (« suspect de malignité ») où le cancer est présent dans 50 à 60 % des cas. Dans les classes III (« lésion vésiculaire de signification indéterminée ») et la classe IV (« tumeur vésiculaire » ou « tumeur oncocytaire »), les nodules sont majoritairement bénins puisque la malignité s’observe alors simplement dans 5 à 15 % et 15 à 30 % des cas respectivement. Malgré tout, et notamment dans la classe IV, l’intervention chirurgicale est souvent décidée.
Cette situation apparaît non satisfaisante. S’il se confirme que le nodule était bénin, l’intervention en définitive n’était pas indispensable. Parfois même, le patient se voit pénalisé par la reconnaissance d’un microcarcinome fortuitement découvert sur la pièce opératoire, même si celle-ci vient gonfler les statistiques des RCP. En cas de malignité du nodule cytologiquement indéterminée, l’intervention apparaît inadaptée si elle a consisté simplement en la malencontreuse lobectomie, ou si la thyroïdectomie n’a pas comporté de curage ganglionnaire.
Comment optimiser la gestion des cytologies indéterminées ?
– D’abord en conservant en mémoire que la reconnaissance des cancers thyroïdiens n’est pas une urgence, qu’un retard raisonnable au diagnostic n’intervient pas dans le pronostic, lequel est fonction de l’âge et seulement au-delà de 45 ans de la classification TNM.
– Considérer aussi les facteurs de risque cliniques et particulièrement l’allure évolutive de la formation : en dépit des habitudes, l’accroissement lent n’est pas à considérer isolément comme un élément péjoratif (3), et seule une augmentation rapide en un an de plus de 20 % de grand axe ou du volume mérite considération.
– Tenir compte des informations précieuses qu’a apportées l’évaluation échographique : le risque échographique de malignité est maintenant quantifiable par le score TI-RAD qui est à l’échographie ce que Bethesda est à la cytologie (4).
– Promouvoir la mesure de la dureté du nodule lorsqu’est disponible l’élastométrie.
– En revenir aussi commodément à l’évaluation scintigraphique dite « de deuxième intention » : même en l’absence de baisse de TSH, 10 % des nodules captent le technétium ou mieux l’iode 123, ce qui constitue un argument solide en faveur globalement de leur bonne différenciation. S’il est possible, coupler l’examen avec la scintigraphie au MIBI ou thallium dont le captage constitue un indice de cellularité du nodule : l’absence de fixation exclut la malignité dans plus de 90 % des cas (5).
Dans les centres spécialisés, les études en immuno-histochimie avaient montré leurs performances : expression de la thyroperoxydase, de la galectine (6,7). Se développent maintenant les approches en biologie moléculaire (8).
– La détection de la mutation V600E du gène BRAF est apparue plus séduisante que l’étude des réarrangements RET/PTC ou des mutations de RAS : elle est en effet spécifique des cancers papillaires, certes les mieux reconnus en cytologie, mais les plus fréquemment observés (80 à 90 % des cas) ; l’examen reconnaît notamment les variants à grandes cellules (70 % des cas), réputés de pronostic moins favorable, et même certains carcinomes anaplasiques. La détection de BRAF était présente dans un tiers des 52 cytologies indéterminées d’une expérience lilloise, authentifiant alors avec certitude la malignité (S. Espiard, E. Leteurtre, P. Pigny, à paraître).
– Aux Etats-Unis, l’équipe d’Alexander a évalué dans 49 centres le test diagnostique VERACYTE® qui apprécie l’expression de 167 gènes : pour 265 nodules dont 85 % étaient malins, le test a révélé une valeur prédictive négative dans 95 % des classes III, 94 % des stades IV, 85 % des classes V. Le cancer a été méconnu dans 7 cas, ordinairement du fait de la pauvreté de la cellularité (9).
– D’autres équipes s’intéressent à l’expression de miRNA, qui sont des fragments d’ARN non codants, régulant l’expression génique et intervenant probablement dans les processus de cancérogenèse (10).
– Une autre approche en cours de développement en France (étude CITHY, promoteur DIAXONHIT, coordonateur principal M. Schlumberger) concernera l’évaluation d’une signature moléculaire transcriptomique (c’est-à-dire portée par les ARN) des nodules cytologiquement indéterminés. Génomique, transcriptomique, protéomique viennent compléter désormais l’exploration des nodules cytologiquement indéterminés.
Il est déraisonnable d’opérer des nodules thyroïdiens. L’ambition est d’opérer des cancers. On a presque les moyens d’y parvenir.
Références bibliographiques
- Wémeau JL, Sadoul JL, d’Herbomez M et al. Recommandations de la Société Française d’Endocrinologie pour la prise en charge des nodules thyroïdiens. Presse Med. 2011;40: 793-826.
- Layfield LJ, Abrams J, Cochand-Priollet B et al. Post-thyroid FNA testing and treatment options: a synopsis of the National Cancer Institute Thyroid Fine Needle Aspiration State of the Science Conference. Diagn Cytopathol. 2008;36:442-8.
- Alexander EK, Hurwitz S, Heering JP et al. Natural history of benign solid and cystic thyroid nodules. Ann Intern Med. 2003;138:315-8.
- Russ G, Bigorgne C, Royer B, Rouxel A, Bienvenu-Perrard M. Thyroid imaging reporting and data system (TIRADS) for ultrasound of the thyroid. J Radiol 2011;92:701-13.
- Hermans J, Schmitz A, Merlo P, Bodart F, Beauduin M. Peut-on différencier les nodules thyroïdiens bénins ou malins par le Thallium 201 (211) ? Ann Endocrinol;1993;54:248-54.
- De Micco C, Kopp F, Vassko V, Grino M. In situ hybridization and immunohistochemestry study in the thyroid peroxidase expression in thyroid tumors. Thyroid 2000;10:109-15.
- Bartolazzi A, Orlandi F, Saggiorato E et al. Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study. Lancet Oncol 2008;9:543-9.
- Nikiforov YE, Ohori NP, Hodak SP et al. Impact of mutational Testing on the Diagnosis and Management of Patients with Histologically indeterminate Thyroid Nodules: A propective Analysis of 1056 FNA Samples. J Clin Endocrinol Metab 2011;96:3390-7.
- Alexander EK, Kennedy GC, Baloch ZW et al. Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. N Engl J Med. 2012;367:705-15.
- Mazeh H. MicroRNA as a diagnostic tool in fine-needle aspiration biopsy of thyroid nodules. The Oncologist, 2012;17:1032-38.
|
|
Inhibiteurs de tyrosine kinase et carcinome médullaire de la thyroïde : résultats encourageants pour le cabozantinib
Léopoldine Bricaire (Paris)
Le carcinome médullaire de la thyroïde (CMT) est rare mais peut être agressif avec une survie globale à 10 ans dans les formes localement avancées ou métastatiques de moins de 40 %. Les chimiothérapies cytotoxiques et la radiothérapie n’ont pas montré d’efficacité durable dans les formes agressives. Les inhibiteurs de tyrosine kinase (ITK), notamment le vandétanib, ciblant des acteurs spécifiques des voies de signalisation impliquées dans la tumorigénèse de ces cancers, ont déjà montré des effets bénéfiques chez ces patients (1).
Le cabozantinib (XL-184) est un ITK ciblant le récepteur à activité tyrosine kinase RET, le récepteur c-MET et le récepteur de type 2 du facteur de croissance endothélial VEGFR2. Une étude publiée récemment dans le Journal of Clinical Oncology rapporte les résultats d’une phase III randomisée en double aveugle menée de septembre 2008 à février 2011, comparant l’efficacité d’un traitement par cabozantinib versus placebo chez 330 patients atteints de CMT non résécables métastatiques ou localement avancés (2). La survie sans progression médiane (évaluation radiologique selon critères RECIST) était significativement meilleure chez les patients traités par cabozantinib par rapport au groupe placebo : 11,2 mois versus 4 mois. À un an, la proportion de patients en vie sans progression était de 47,3 % dans le groupe cabozantinib versus 7,2 % dans le groupe placebo. Le taux de réponse objective a pu être évalué radiologiquement à 28 % dans le groupe cabozantinib versus 0 % dans le groupe placebo. Les effets secondaires les plus fréquents étaient diarrhées, érythro-dysesthésies palmo-plantaires, fatigue, hypertension, hémorragie, fistule, perforation digestive, classiquement décrits sous traitements par anti-VEGF ou les autres ITK. Les effets indésirables de grade 3 et 4 ont été rapportés chez 69 % des patients traités par cabozantinib versus 33 % des patients sous placebo.
La population de cette étude était à l’inclusion à un stade de la maladie plus avancé que dans l’étude de Wells et al (1) qui avait comparé l’effet du vandétanib à un placebo pour des patients atteints de CMT non résécables métastatiques ou localement avancés, mais dont le critère de progression de la maladie selon les critères RECIST n’était pas requis à l’inclusion.
Sous réserve de l’obtention d’une autorisation de mise sur le marché, le cabozantinib pourrait être le second ITK dans l’arsenal thérapeutique des CMT localement avancés ou métastatiques en progression.
Références bibliographiques
- Wells SA Jr, Robinson BG, Gagel RF et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J. Clin. Oncol. 2012;30:134-141.
- Elisei R, Schlumberger MJ, Müller SP et al. Cabozantinib in Progressive Medullary Thyroid Cancer. J. Clin. Oncol. 2013;31:3639-3646.
……………………………………………………………………………………………………………………………………………………………
Risque de cancer en cas de thyroïdite de Hashimoto : étude nationale de cohorte
Fritz-Line Velayoudom (Pointe-à-Pitre)
La thyroïdite de Hashimoto (TH) est l’une des premières étiologies de l’hypothyroïdie auto-immune. Elle est plus fréquente chez la femme que chez l’homme et concerne classiquement la tranche d’âge 45-65 ans. Cette thyroïdite lymphocytaire chronique est caractérisée par un goitre diffus, ferme mais non compressif, pouvant être associé à la présence de nodules de thyroïdite et dans de faibles cas, à la présence de nodules carcinomateux (3 à 4 % des cas).
Le principal risque évolutif, bien que rare (1 %), est la transformation lymphomateuse, si bien que la surveillance clinique des sujets avec TH doit être régulière.
Différentes études rapportent l’association entre TH et carcinome thyroïdien avec une fréquence variable de 1 à 23 % (Cheng, 2009). D’autres études ont mis en évidence une association entre TH et certaines pathologies myélo- ou lymphoproliférative.
Cette étude récente, réalisée en Chine à partir des données d’un programme national d’assurance maladie, a évalué le risque de cancer dans une population de TH nouvellement diagnostiquée. Ces cas étaient comparés à une population témoin, indemne de TH, appariée selon l’âge, le sexe et le mois du diagnostic. Dans les 2 groupes, aucun sujet n’avait d’antécédents de cancers. Le rapport cas-témoin était de 1/4. Les tests statistiques utilisés étaient : le Chi2, l’Odds-ratio avec IC de 95 %, les modèles Cox et Kaplan Meier.
Résultats : les données de 1 521 TH (90 % de femmes, 43 % de sujets âgés entre 35 et 55 ans) et de 6 084 témoins étaient analysées.
Le risque de développer un cancer était respectivement de 5,07 et 3,03 pour 1 000 personnes par an dans les groupes TH et témoins, soit un risque 1,68 fois plus élevé en cas de TH comparé aux témoins (p=0,001). Ce risque augmentait avec l’âge [OR = 5,96 (3,49-10,2) pour les 35-55 ans et 9,66 (5,15-18,1)] pour les plus de 55 ans. Après ajustement pour l’âge, le sexe et les comorbidités, le risque de cancer colorectal et de cancer thyroïdien était plus élevé dans le groupe TH comparé aux témoins [OR = 4,76 (1,36-16,6), p <0,05 et 11,8 (4,24-33,1), p<0,001 respectivement]. De façon significative, le risque de cancer colorectal était plus élevé après les 3 premières années de suivi des sujets alors que le risque de cancer thyroïdien était plus élevé dans les 3 ans suivant le diagnostic de TH.
En conclusion : cette étude menée dans une population de TH d’origine chinoise souligne l’intérêt d’un dépistage du cancer colorectal et la nécessité d’un suivi régulier de la situation thyroïdienne dans cette population. Les sujets âgés de 35 à 55 ans sont les plus à risque de développer un cancer colorectal (après les 3 ans de suivi initial) ou un cancer thyroïdien (dans les 3 ans suivant le diagnostic de TH). Le risque de lymphome dans cette population n’est pas significatif, expliqué par la rareté de cette pathologie. La présence d’une hypothyroïdie ne semble pas affecter le risque de développer un cancer thyroïdien. Le rôle de l’inflammation chronique suite à l’agression auto-immune du tissu thyroïdien a été évoqué dans l’association entre TH et cancer, mais aucun mécanisme physiopathologique n’a encore été confirmé. Une expression forte de la cox-2 (cyclooxygénase 2) a été mise en évidence au niveau des cellules mononucléées des TH, tout comme au niveau des cellules carcinomateuses folliculaires ou papillaires suggérant une up-régulation de la tumorigenèse thyroïdienne par cette enzyme.
En France, il n’existe pour l’instant aucune recommandation quant au dépistage du cancer thyroïdien ou d’autres sites dans cette pathologie. Une surveillance clinique régulière (voire échographique en cas de doute clinique ± cytoponction) est généralement préconisée.
Référence bibliographique
- Y-K Chen, C-L Lin, FT-F Cheng, F-C Sung, C-H Kao. Cancer risk in patients with Hashimoto’s thyroiditis: a nationwide cohort study. Br J Cancer 2013;109:2496-501.
Figures illustrant la probabilité de développer un cancer colorectal ou thyroïdien en fonction de la présence ou non d’une TH.

|
|
Échographie des ganglions cervicaux : une logique ternaire
Gilles Russ (Paris)
On oppose classiquement en imagerie les ganglions normaux et les ganglions suspects. Dans la détection des métastases ganglionnaires des carcinomes thyroïdiens, l’analyse de la littérature et la pratique quotidienne convergent toutefois pour aboutir à une classification ternaire : ganglions normaux, indéterminés ou suspects. Ces aspects sont rapportés dans les nouvelles recommandations européennes sur l’échographie diagnostique et interventionnelle dans le suivi des cancers thyroïdiens.
Oui ou non, noir ou blanc, vrai ou faux ? Notre esprit tend vers la simplicité de la logique binaire. La réalité est moins simple que cela et le gris, le discutable sont notre quotidien dès lors que nous laissons avec modestie une possibilité d’exister au doute. Une logique ternaire devient indispensable.
Les difficultés rencontrées dans la pratique de l’échographie des ganglions cervicaux dans la surveillance post-opératoire des carcinomes thyroïdiens font partie de ces situations. C’est pour cette raison que les nouvelles recommandations européennes sur l’échographie diagnostique et interventionnelle dans le suivi des cancers thyroïdiens (1) consacrent un chapitre à ce sujet. Fondée sur l’analyse de la littérature (2-6), le tableau I résume la valeur diagnostique des signes échographiques pour différencier les ganglions normaux et pathologiques.
La visibilité du hile, signe réputé pour caractériser les ganglions normaux, n’est retrouvée que dans 29 % à 87 % des cas. Une vascularisation périphérique est observée dans 18 % des ganglions normaux et une forme arrondie dans 36 % des cas. Aucun signe n’a à lui seul une sensibilité diagnostique supérieure à 87 % et seuls deux d’entre eux ont une spécificité de 100 % (logettes kystiques et microcalcifications). La valeur des logettes kystiques pourrait même être discutée puisqu’elles peuvent être vues dans les métastases des carcinomes épidermoïdes ORL, des mélanomes, les schwannomes kystiques ainsi que dans la tuberculose ganglionnaire en particulier.
| Signe |
Sensibilité |
Spécificité |
VPN |
VPP |
Exactitude
diagnostique |
% de
ganglions normaux avec le signe |
| Microcalcifications |
5-69 |
93-100 |
33-60 |
88-100 |
56-72 |
0 |
| Logettes kystiques |
10-34 |
91-100 |
30-66 |
77-100 |
48-65 |
0 |
| Vascularisation périphérique |
40-86 |
57-93 |
31-70 |
77-80 |
54-71 |
1-18 |
| Hyperéchogénicité |
30-87 |
43-95 |
38-84 |
66-96 |
56-90 |
4-17 |
| Forme arrondie |
37 |
70 |
45 |
63 |
|
4-36 |
| Hile visible |
0-0,5% |
|
|
|
|
29-48 |
| Vascularisation absente |
0% |
|
|
|
|
33-36 |
Tableau I. : Intervalle de valeur diagnostique des signes échographiques pour la détection des métastases ganglionnaires des carcinomes thyroïdiens relevé dans la littérature. Note : VPN=valeur prédictive négative et VPP=valeur prédictive positive.
Après étude de ces données, le groupe d’étude a décidé de classer les ganglions cervicaux en trois groupes :
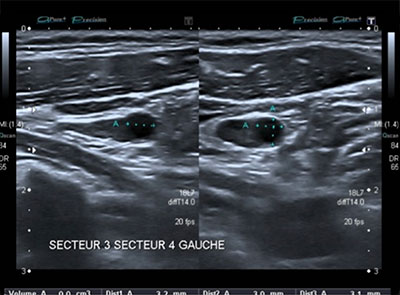
 Figure 1: ganglion normal. La forme est aplatie, le hile est présent et il ne comporte aucun signe suspect. Figure 1: ganglion normal. La forme est aplatie, le hile est présent et il ne comporte aucun signe suspect.
– Hile visible.
– Forme arrondie et taille normale (? 8mm d’épaisseur en secteur II et ? 4mm sur les autres secteurs).
– Vascularisation absente ou hilaire.
– Pas d’autres signes suspects.
 Figure 2 : ganglion intermédiaire. Le hile est mal visible. Son épaisseur est supérieure à 4 mm et il siège en secteur III. Sa vascularisation est augmentée mais d’architecture normale. Figure 2 : ganglion intermédiaire. Le hile est mal visible. Son épaisseur est supérieure à 4 mm et il siège en secteur III. Sa vascularisation est augmentée mais d’architecture normale.
– Hile non visible ET au moins 2 des signes suivants:
– Forme arrondie.
– Taille supérieure à la norme.
– Vascularisation hilaire et radiaire augmentée.

Figure 3 : ganglion suspect. Présence de logettes kystiques.
– Microcalcifications
– Logettes kystiques
– Vascularisation périphérique ou anarchique
– Présence de tissu ressemblant à la thyroïde ou à un nodule
À noter que l’expérience en élastographie est pour l’instant limitée à deux études avec une sensibilité et une spécificité rapportées de 83-85 % et 98-100 % respectivement (7, 8).
L’intérêt de cette classification en trois groupes est de permettre de définir une conduite à tenir adaptée :
- Ganglions nor maux : pas d’investigations supplémentaires.
- Ganglions douteux : cytoponction échoguidée avec analyse cytobiologique (analyse cytologique et dosage in situ de la thyroglobuline ou de la calcitonine) décidée en fonction du contexte (stade TNM, histologie de la lésion initiale, latéralité de celle-ci par rapport au ganglion, thyroglobulinémie).
- Ganglions suspects : cytoponction échoguidée avec analyse cytobiologique si l’épaisseur du ganglion est supérieure à 5-7mm et simple surveillance sinon. En effet, ces petits ganglions peuvent rester stables pendant de longues périodes et ont été décrits comme pouvant être simplement surveillés en échographie (9, 10, 11). De plus, la résection chirurgicale de ces ganglions ne permet une normalisation de la thyroglobulinémie que dans 27 % des cas (12).
En conclusion, une stratification du risque échographique en trois groupes des ganglions cervicaux est possible et permet de définir une conduite à tenir adaptée.
Références bibliographiques
- Leenhardt L, Erdogan MF, Hegedus L et al. European Thyroid Association guidelines for cervical ultrasound scan and ultrasound-guided techniques in the postoperative management of patients with thyroid cancer. Eur Thyroid J 2013;2:147-159.
- Kuna SK, Bracic I, Tesic V et al. Ultrasonographic differentiation of benign from malignant neck lymphadenopathy in thyroid cancer. J Ultrasound Med 2006;25:1531–1540.
- Leboulleux S, Girard E, Rose M et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer. J Clin Endocrinol Metab 2007;92:3590–3594.
- Park JS, Son KR, Na DG et al. Performance of preoperative sonographic staging of papillary thyroid carcinoma based on the sixth edition of the AJCC/UICC TNM classification system. Am J Roentgenol 2009;192:66–72.
- Sohn YM, Kwak JY, Kim EK et al. Diagnostic approach for evaluation of lymph node metastasis from thyroid cancer using ultrasound and fine-needle aspiration biopsy. Am J Roentgenol 2010;194:38–43.
- Steinkamp HJ, Cornehl M, Hosten N et al. Cervical lymphadenopathy: ratio of long- to short-axis diameter as a predictor of malignancy. Br J Radiol 1995;68:266–270.
- Lyshchik A, Moses R, Barnes SL et al. Quantitative analysis of tumor vascularity in benign and malignant solid thyroid nodules. J Ultrasound Med 2007;26:837–846.
- Alam F, Naito K, Horiguchi J et al. Accuracy of sonographic elastography in the differential diagnosis of enlarged cervical lymph nodes: comparison with conventional B-mode sonography. Am J Roentgenol 2008;191:604–610.
- Cooper DS, Doherty GM, Haugen BR et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19:1167–1214.
- Leenhardt L, Borson-Chazot F, Calzada M et al. Good practice guide for cervical ultrasound scan and echo-guided techniques in treating differentiated thyroid cancer of vesicular origin. Ann Endocrinol (Paris) 2011;72:173– 197.
- Robenshtok E, Fish S, Bach A et al. Suspicious cervical lymph nodes detected after thyroidectomy for papillary thyroid cancer usually remain stable over years in properly selected patients. J Clin Endocrinol Metab 2012;97:2706–2713.
- Al-Saif O, Farrar WB, Bloomston M et al. Long-term efficacy of lymph node reoperation for persistent papillary thyroid cancer. J Clin Endocrinol Metab 2010;95:2187–2194.
|
|
Controverses et polémiques autour de la découverte de l’iode
Jean-Louis Schlienger (Strasbourg)
L’iode, n°53 dans la classification périodique des éléments et 47e élément par l’abondance dans l’écorce terrestre, est un halogène qui émet des vapeurs violettes. C’est à Bernard Courtois (1777-1838) que l’on doit sa découverte. Ce pharmacien-chimiste a travaillé dans un laboratoire de la toute jeune Ecole Polytechnique aux côtés d’Antoine-François Fourcroy avant de prendre la direction d’une fabrique de salpêtre utilisé pour produire de la poudre à canon. Il tenta d’améliorer le procédé de fabrication de cet ingrédient meurtrier en utilisant des cendres de varech. En 1811, lors d’une manipulation où il ajouta accidentellement de l’acide chlorhydrique en excès, il obtint un nuage violet qui se condensa en cristaux noirâtres tenus pour responsables de la corrosion qui perçait les récipients. Il dénomma « iode » (âcre en grec) ce composé âcre au goût, d’aspect gris métallique ayant une odeur de chlore et colorant la peau en brun foncé. Trop occupé par sa nitrière, il confia ce nouveau composé à des collègues chimistes dijonnais comme lui, Charles-Bernard Désormes et Nicolas Clément, afin qu’ils en précisent les propriétés. Leurs travaux furent publiés en 1813, juste après Humphrey Davy, célèbre chimiste et philosophe anglais auquel Clément avait confié un échantillon d’iode lors d’un de ses passages en France. Cet empressement à publier à son compte une découverte qui n’était pas de son fait indisposa le célèbre Louis-Joseph Gay-Lussac, connu pour ses travaux sur les gaz. Dans un Grand Mémoire de l’Iode paru en 1814, il rétablit la juste paternité de l’iode, ce qui suscita ce commentaire dans la presse anglaise : « tel est l’état déplorable de ceux qui cultivent les sciences en France qu’on n’en avait rien publié jusqu’à l’arrivée de notre philosophe anglais dans ce pays ». En 1831, le prix de l’Académie des Sciences récompensa Courtois pour la découverte de ce composé qui allait occuper une place éminente sur le plan de la santé (1).
C’est à Jean-François Coindet (1774-1834), Genevois dont la famille était originaire d’Annecy, que l’on doit l’utilisation médicale de l’iode. Il fit ses études de médecine à Edimbourg et se perfectionna 2 ans à Paris avant de s’installer à Genève. En 1819, il eut l’intuition que l’iode était le principe actif des cendres d’éponge calcinée ou de varech utilisées depuis la plus haute antiquité dans le traitement du goitre. Il administre une solution alcoolique d’iode à des goitreux et constate que le goitre régresse ou ramollit dans un grand nombre de cas (2). Il présente ses résultats en juillet 1820 devant la Société Helvétique des Sciences Naturelles, déclarant que « l’iode constitue un des plus puissants remèdes dont la chimie moderne ait enrichi la matière médicale », d’autant qu’il prête à l’iode la faculté de stimuler l’appétit, l’utérus ( ?) et d’être aphrodisiaque… Les goitreux de tout le pays se précipitent chez les pharmaciens qui dispensent de l’iodure de potassium, de l’iodide-iodure (future solution de Lugol) ou de la teinture alcoolique à des doses extravagantes… ce qui permit à Coindet de décrire l’iodisme (hypertrophie du goitre) et l’hyperthyroïdie induite par l’iode. Le triomphe de Coindet eût été total sans la vindicte d’un certain P. Colladon (1769-1842), son meilleur ennemi genevois également diplômé d’Edimbourg, qui s’employa à démontrer les dangers de ce remède qui était à l’origine d’épigastralgies et « d’inconfort » et à discréditer son confrère en montant ce qu’on appela « l’affaire de l’iode » (3). Il fit tant et si bien que les autorités genevoises interdirent l’iode, sauf sur prescription médicale. Coindet riposta en proposant l’usage d’une pommade iodée à appliquer sur le cou des goitreux afin d’éviter les problèmes gastriques. En dépit de nombreux ennemis, Coindet fut distingué par l’Académie des Sciences de Paris en 1831.
En fait, l’usage médical de l’iode avait précédé la pseudo-intuition de Coindet qui gardait le contact avec sa faculté d’origine, ne serait-ce que parce que son épouse était d’Edimbourg ! Dès 1815, Andrew Fyfe rapportait à la Société Royale d’Edimbourg que l’éponge contenait de l’iode. En 1816, le Dr William Prout, lui aussi diplômé d’Edimbourg, suggéra que l’iode pouvait être un traitement du goitre, ce que fit effectivement le Dr Elliotson à l’hôpital St Thomas, bien qu’il ne publia ses résultats qu’en 1834. Enfin, JC Staub, chimiste bernois, rapporta en 1819 que les extraits d’éponge calcinée contenaient de l’iode (4). En fait d’ « intuition » , il y a mieux !
Références bibliographiques
- Swain PA. Bernard Courtois, famed for discovery iodine and his life in paris from 1798. Bull Hist Chim 2005;30:103-111.
- Lindholm J, Laurberg P. Hypothyroidism and thyroid substitution : historical aspects. J Thyroid Res 2011;2011:809341.
- Dreifuss JJ. Genève 1820-1836 : l’affaire de l’iode. Rev Médicale Suisse 2005;1:2357-2358.
- Matinovic J, Ramalingaswi V. Therapy and prophylaxis of endemic goitre. JCEM 1954;11:1412-1422.
|








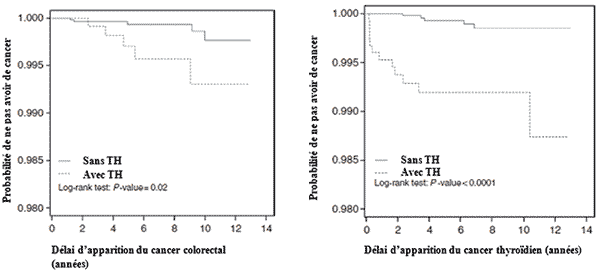
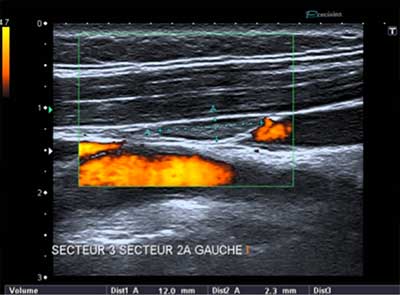
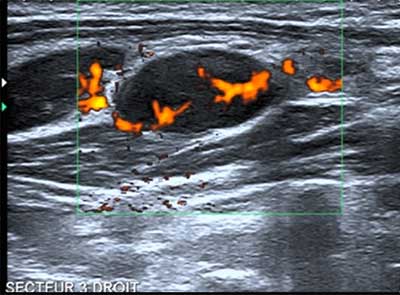 Figure 2 : ganglion intermédiaire. Le hile est mal visible. Son épaisseur est supérieure à 4 mm et il siège en secteur III. Sa vascularisation est augmentée mais d’architecture normale.
Figure 2 : ganglion intermédiaire. Le hile est mal visible. Son épaisseur est supérieure à 4 mm et il siège en secteur III. Sa vascularisation est augmentée mais d’architecture normale.