MUST 2023 – Diabète insipide : un déficit en vasopressine
Dr. Fanny Chasseloup (1) ; Prof. Antoine Tabarin (2) ; Prof. Philippe Chanson (1)
1- Université Paris-Saclay, Inserm, Physiologie et Physiopathologie Endocriniennes, AP-HP, Hôpital Bicêtre, Service d’Endocrinologie et des Maladies de la Reproduction, Centre de Référence des Maladies Rares de l’Hypophyse, Le Kremlin-Bicêtre, France ;
2- Service d’Endocrinologie, Diabète et Nutrition, Hôpital Haut Lévêque, Centre Hospitalier Universitaire de Bordeaux, Pessac, France.
Cet article a bénéficié du soutien institutionnel d’Ipsen Pharma, le 1er auteur ayant été un participant des Must de l’Endocrinologie 2023.
Résumé
Le diabète insipide est une pathologie caractérisée par une polyurie hypo-osmotique secondaire à un trouble de la synthèse, de la régulation ou de l’action rénale de l’hormone antidiurétique. Récemment, un groupe d’experts, soutenu par les associations de patients, a proposé de renommer le diabète insipide afin d’éviter toute confusion avec diabète sucré. La forme la plus fréquente de diabète insipide, secondaire à une atteinte de la neurohypophyse (diabète insipide central) serait donc appelée « déficit en vasopressine ». La forme, plus rare, liée à une résistance rénale à la vasopressine (diabète insipide néphrogénique) deviendrait alors « résistance à la vasopressine ». L’étiologie du diabète insipide est parfois évidente en cas d’atteinte de la post-hypophyse (tumorale ou infiltrative) ou d’atteinte rénale mais dans certains cas, le diabète insipide peut être difficile à différencier de la polydipsie primaire, en rapport avec l’ingestion excessive de grandes quantités d’eau, sans anomalie de la régulation ou de l’action de l’hormone anti-diurétique. Outre les antécédents médicaux, l’examen physique et l’imagerie de la région hypothalamo-hypophysaire, des tests fonctionnels comme le test de restriction hydrique ou la stimulation de la copeptine par une hyperosmolarité induite par une perfusion de serum salé hypertonique peuvent être proposés afin de distinguer ces différentes étiologies. Le traitement du diabète insipide dépend de l’étiologie sous-jacente, et, en cas d’atteinte centrale, se base sur l’administration de desmopressine qui permet d’améliorer la symptomatologie mais ne permet pas toujours de maintenir une qualité de vie optimale. L’origine de cette altération de la qualité de vie pourrait être un déficit en ocytocine, également secrétée par la neurohypophyse mais cela n’a pas été totalement démontré. La perspective d’un nouveau test de stimulation de l’ocytocine pour identifier une altération de la synthèse d’ocytocine est intéressante et permettrait de confirmer l’existence d’un déficit chez les patients présentant un diabète insipide en lien avec une atteinte de la neurohypophyse.
Introduction
Le diabète insipide (DI) est une pathologie caractérisée par une polyurie hypo-osmotique dépassant 50 ml/kg de poids corporel accompagnée d’une polydipsie compensatoire dépassant souvent 3 litres par jour. Le diabète insipide est secondaire à un trouble de la synthèse, de la régulation ou de l’action rénale de l’hormone antidiurétique, ADH (ou Arginine Vasopressine, AVP) [1, 2]. La forme la plus fréquente de diabète insipide est secondaire à une atteinte centrale de la neurohypophyse et des neurones parvocellulaires et magnocellulaires. Le diabète insipide néphrogénique est une forme moins fréquente de diabète insipide, liée à une résistance à l’action rénale de l’hormone antidiurétique. Dans les deux cas, la conséquence est un déséquilibre hydrique lié à un défaut de réabsorption d’eau libre par le tube collecteur rénal (Figure 1).
Le diabète insipide central congénital est rare. Il est lié à une atteinte génétique perturbant la synthèse d’hormone antidiurétique (gènes AVP, WFS1 et PCSK1). Les causes centrales acquises de diabète insipide sont liées à une destruction de la post-hypophyse d’origine tumorale, infiltrative, traumatique ou vasculaire. Le diabète insipide néphrogénique héréditaire est en rapport avec des mutations génétiques des récepteurs cibles de l’hormone antidiurétique (AVPR2 et AQP2) alors que les formes acquises sont souvent iatrogènes (traitement par lithium) ou liées à des maladies infiltratives.
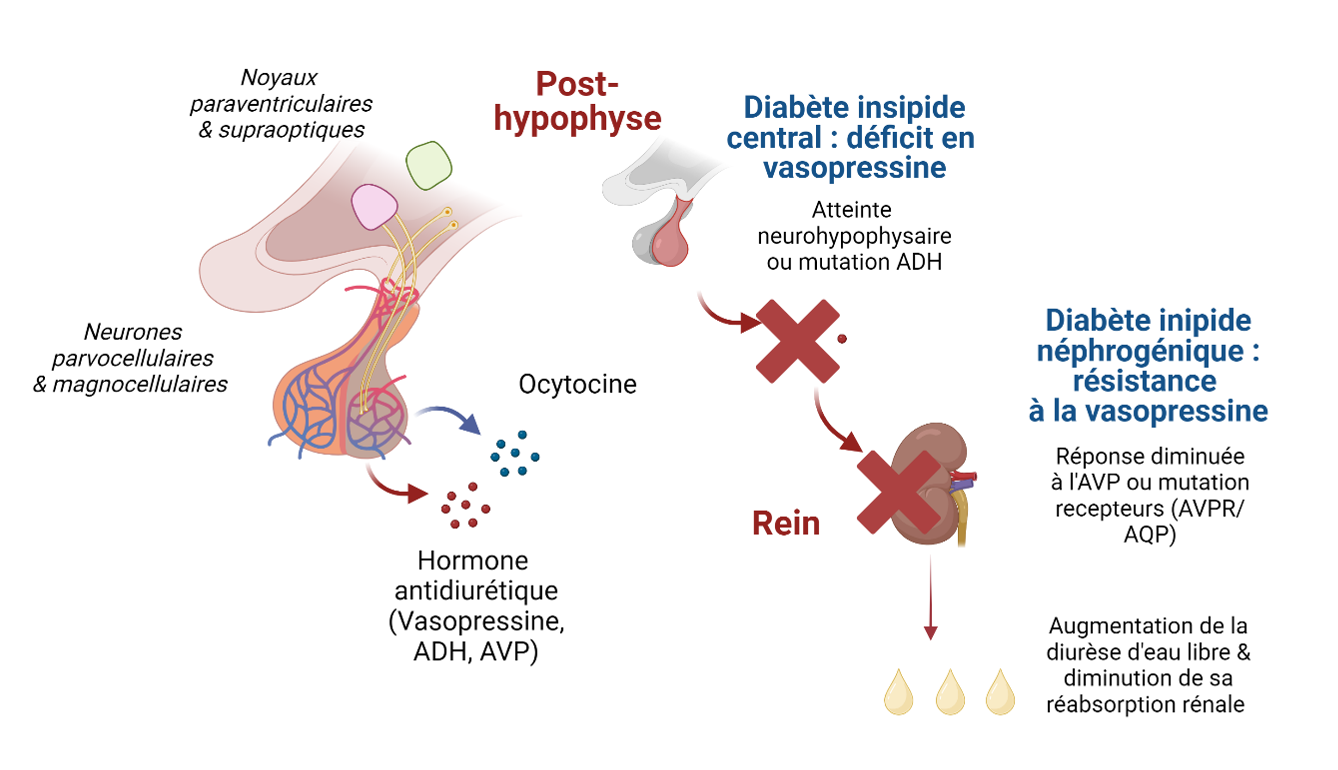
Figure 1 : Représentation schématique de la synthèse de l’hormone anti-diurétique ou vasopressine par la post-hypophyse et de son action rénale sur la réabsorption d’eau libre.
Le diabète insipide central ou déficit en vasopressine est caractérisé par une polyurie hypo-osmotique secondaire à une atteinte de la synthèse, de la régulation de l’hormone antidiurétique (ADH ou Arginine Vasopressine, AVP). Le diabète insipide néphrogénique est secondaire à une résistance rénale du récepteur de l’ADH (AVPR2). Dans les deux cas, la conséquence est un déséquilibre hydrique lié à un défaut de réabsorption d’eau libre par le tube collecteur rénal. Figure crée avec Biorender.com
Changement de nomenclature
Un groupe d’experts a récemment proposé de renommer le diabète insipide en utilisant un terme plus représentatif de la physiopathologie de la maladie, cela afin d’éviter la confusion entre le diabète « sucré » et le diabète insipide [3]. Le terme «diabète » signifiant «passer à travers » en grec remonte à la première description d’un syndrome polyuro-polydipsique par Démétrius d’Apamée (1 ou 2 siècles avant JC) et Arétée de Cappadoce (1er siècle après JC) [3, 4]. C’est le Dr William Cullen qui a, le premier, fait la distinction entre les différentes formes de polyurie et le Dr Johann Peter Frank qui, au 18ème siècle a ajouté l’adjectif « insipide » désignant le caractère hypo-osmotique des urines… mais le terme commun de « diabète » est resté [4]. La nouvelle nomenclature proposée se veut plus proche de la physiopathologie du diabète insipide en utilisant le terme de « déficit en vasopressine » pour représenter le diabète insipide d’origine centrale et le terme de « résistance à la vasopressine » pour le diabète insipide néphrogénique. Outre la meilleure représentation de la physiopathologie, l’utilisation d’un nouveau terme permettrait d’éviter toute confusion entre le diabète insipide et le diabète sucré. En effet, plusieurs cas dramatiques de mauvaise prise en charge du diabète insipide lors d’hospitalisations, en lien avec un retard ou une erreur d’administration du traitement ont été rapportés, et seraient attribués à la confusion du personnel médical et paramédical entre ces deux pathologies [5].
Récemment, une enquête en ligne auprès de patients a permis de quantifier plus largement cette problématique. Il est ainsi rapporté qu’un quart des patients a déjà eu des difficultés d’accès à la desmopressine et à l’eau durant des hospitalisations allant jusqu’à une absence de compensation intra-veineuse chez les patients devant rester à jeun, rapportée dans 40 % des cas [6]. De plus, cette enquête semble confirmer la nécessité d’une nouvelle nomenclature puisque 85 % des patients sont favorables à ce changement et souhaitent le retrait du terme « diabète » de l’appellation.
Bien qu’intéressant, ce changement de nomenclature ne suffira peut-être pas à améliorer la prise en charge des patients atteints de cette pathologie rare par des médecins n’en ayant pas l’habitude.
Les outils diagnostiques
Le diagnostic de diabète insipide doit être évoqué devant une polydipsie associée à une polyurie hypo-osmotique (osmolalité inférieure à 300 Osm/kg) [7]. Une fois identifiée, l’étiologie de la polyurie hypo-osmotique doit être confirmée, afin de proposer une thérapeutique adaptée. La confirmation d’une atteinte de l’hormone antidiurétique d’origine centrale est parfois simple quand cette polyurie hypotonique s’accompagne d’une atteinte évidente de la post-hypophyse par une pathologie tumorale ou une pathologie infiltrative visible en imagerie. En absence de lésion tumorale ou infiltrative évidente, l’absence de l’hypersignal de la post-hypophyse en séquences T1 peut orienter vers le diagnostic de diabète insipide central et écarter une atteinte périphérique ou une polydipsie primaire. Cependant, selon une étude, cet hypersignal, correspondant au stockage de l’hormone antidiurétique dans les neurones de la post-hypophyse, serait absent dans seulement 70% des évaluations IRM de patients présentant un diabète insipide central mais le serait aussi chez près de 40% des patients avec polydipsie primaire [8]. Il est à noter que cette étude n’a pas utilisé une procédure stricte de réalisation de l’IRM (en particulier avec saturation de graisse, pour bien distinguer la posthypophyse de la graisse du dos de la selle turcique) pour bien analyser la post-hypophyse. En fait, peu d’études radiologiques dédiées ont été réalisées pour évaluer la présence ou l’absence de cet hypersignal pouvant ainsi sous-estimer cette évaluation [8, 9]. Enfin la diminution de l’intensité et de la taille de ce signal au-delà de 80 ans peut également fausser son interprétation [10].
Ainsi, si l’imagerie est mise en défaut, le diagnostic de diabète insipide et l’élimination des diagnostics différentiels peuvent être difficiles. Si le diagnostic de diabète insipide néphrogénique est devenu simple grâce à l’apport de nouveaux outils diagnostiques tels que le dosage de la copeptine, discuté plus bas, [8], la distinction entre polydipsie primaire et diabète insipide n’est pas toujours évidente [2].
Parfois, spontanément, le diabète insipide associe, à l’hypo-osmolarité urinaire, une élévation de la natrémie basale au-dessus de 147mmol/L et de l’osmolalité plasmatique au-dessus de 295 mOsm/kg. Ce profil biologique permet alors d’éliminer une polydipsie primaire. En effet, celle-ci est plutôt associée à une natrémie basse, inférieure à 135mmol/L et à une osmolalité plasmatique à moins de 280 mOsm/kg (Figure 2) [11]. Cependant, certains patients n’entrent dans aucune de ces catégories biologiques caractéristiques et justifient alors le recours à des tests de stimulation.
Le « gold-standard » actuel est la réponse à la stimulation indirecte de l’hormone anti-diurétique par un test de restriction hydrique. Ce test permet de mesurer – indirectement – l’activité de l’hormone anti-diurétique en utilisant sa capacité à diminuer l’excrétion rénale d’eau libre et donc à augmenter l’osmolarité urinaire au cours d’une déshydratation provoquée par une restriction d’accès à l’eau pendant au moins 8 heures, l’osmolalité plasmatique étant suivie toutes les 4 heures et l’osmolarité urinaire toutes les 2 heures [12]. Ce test doit être suivi d’une administration de 2 µg de desmopressine (hormone antidiurétique substitutive).
Une osmolarité urinaire au-delà de 800 mOsm/kg pendant la restriction hydrique est en faveur d’une polydipsie primaire sans lien avec une perturbation de la synthèse ou de l’action de l’hormone anti-diurétique. En revanche, la persistance d’une hypo-osmolarité urinaire en dessous de 300 mOsm/kg signe une altération complète de l’action de l’hormone anti-diurétique. Le profil de réponse après administration de desmopressine permettra ensuite de distinguer un forme centrale (réponse de l’osmolarité urinaire supérieure à 50%), d’une forme néphrogénique de diabète insipide (réponse de l’osmolarité urinaire inférieure à 50%) (Figure 2) [12].
Bien que les premiers résultats de l’utilisation de ce test soient intéressants et qu’il soit actuellement le « gold-standard » pour le diagnostic de diabète insipide [7, 12], il est important de noter que ce test est surtout efficace dans les formes de diabètes insipides centraux complets. Dans ces cas, la précision diagnostique est proche de 70 %, avec une sensibilité de 86 % et une spécificité de 70% [7, 8, 13]. En revanche, la performance diagnostique du test semble moindre pour distinguer les formes partielles de diabète insipide des polydipsies primaires, chutant alors à 40%, avec une sensibilité de 54% et une spécificité de 88% [7, 8, 13].
Les raisons de ce mauvais rendement diagnostique sont multiples et incluent la durée du test, et la nécessité d’une supervision médicale visant à lutter contre la soif irrépressible pouvant fausser les résultats du test. Enfin, l’inefficacité de l’administration de desmopressine finale peut être secondaire à un rétrocontrôle négatif de l’expression rénale de son récepteur AVPR2 par la polyurie chronique [14]. Le dosage direct de la vasopressine stimulée par une restriction hydrique aurait pu représenter une alternative intéressante [15], puisque les concentrations de vasopressine sont, avant même le test de restriction hydrique, très élevées chez les patients présentant un diabète insipide néphrogénique (par résistance à l’AVP) et, s’élèvent à moindre degré, sous l’effet de la déshydratation chez les patients ayant une polydipsie primaire, alors qu’ils ne sont pas modifiés chez les patients ayant un diabète insipide central [15-18]. Cependant, les seuils permettant de différencier ces différentes étiologies nécessitent que la sensibilité du dosage de la vasopressine utilisé soit autour de 0.3 pmol/L, ce qui est obtenu par les radio-immuno-dosages « artisanaux » préparés spécifiquement mais pas par la majorité des dosages immunologiques du commerce actuellement disponibles, dont le seuil de détection est de l’ordre de 1 pmol/L. Enfin, la demi-vie courte de la vasopressine et son instabilité pré-analytique rendent difficile son utilisation en pratique courante. Les performances diagnostiques de ce test (restriction hydrique avec dosage d’AVP) en utilisation courante sont donc limitées et sa précision diagnostique ne dépasse pas 40% [13].
Compte tenu des limites inhérentes à ces tests diagnostiques, le dosage de la copeptine a été proposé comme nouveau marqueur de la sécrétion de vasopressine. La copeptine, qui est une glycoprotéine issue de la partie C-Terminale du gène de la pro-hormone AVP pourrait ainsi constituer un reflet stable de la vasopressine endogène. Un dosage basal de copeptine supérieur à 21.4 pmol/L est en faveur d’un diabète insipide néphrogénique [8]. L’utilisation de la copeptine permet de distinguer polydipsie primaire et diabète insipide après stimulation hyperosmolaire. Le dosage de la copeptine offre de meilleurs résultats après une perfusion de soluté hyper-osmotique qu’après une restriction hydrique [8]. La stimulation hyperosmotique repose sur la perfusion intraveineuse d’un bolus de 250ml de soluté salé hypertonique à 3% puis d’un débit continu à la posologie de 0.15ml/kg/min. Une concentration de copeptine restant inférieure au seuil de 4,2 pmol/L en regard d’une natrémie supérieure à 150 mmol/l permettrait d’obtenir une précision diagnostique de 96.5 % dans le diagnostic de diabète insipide central complet (et de 95.2% dans celui de diabète insipide central partiel) (Figure 2) [1, 2, 8]. Pour autant, l’utilisation du dosage de copeptine stimulé par une perfusion hyperosmotique intra-veineuse reste compliquée puisque qu’il nécessite d’atteindre une natrémie supérieure à 150 mmol/l exposant le patient à un risque de complications métaboliques, ce qui impose une surveillance très serrée de la natrémie difficile à organiser en pratique courante. Compte tenu de ces difficultés, d’autres tests de stimulation de la copeptine ont été proposés. La stimulation par l’arginine ou par le glucagon semble représenter des alternatives intéressantes, offrant des efficacités diagnostiques supérieures à 90 % mais nécessite d’être validée de manière prospective [19, 20].
En conclusion, plusieurs tests peuvent être proposés pour éliminer le diagnostic de polydipsie primaire et retenir celui de diabète insipide afin de proposer une thérapeutique adaptée. Cependant, l’association de l’imagerie de la région hypothalamo-hypophysaire et, éventuellement, du test de restriction hydrique reste au premier plan en pratique courante. L’utilisation de la copeptine est une alternative prometteuse dans les cas les plus difficiles.
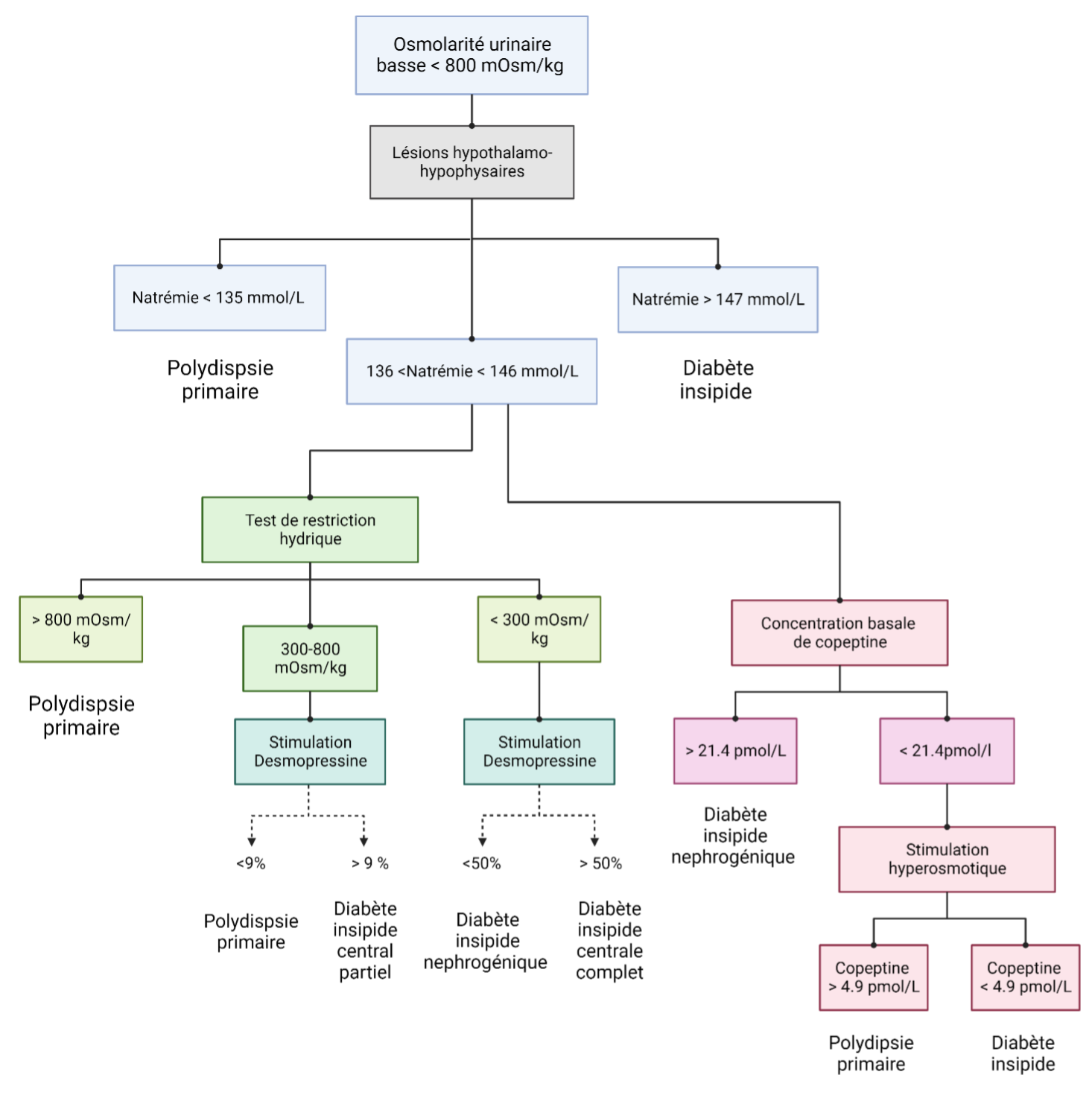
Figure 2 : Algorithme pour le diagnostic étiologique devant un syndrome polyuro-polydipsique
Après confirmation d’une polyurie hypo-osmotique dans le cadre d’un syndrome polyuro-polydipsique, l’utilisation de la natrémie et de l’osmolarité plasmatique peuvent orienter le diagnostic étiologique.
Si ces valeurs restent normales, un test de stimulation par restriction hydrique puis un test de stimulation hyperosmolaire peuvent être utiliser pour diagnostiquer les différentes étiologies de diabète insipide.
Figure adaptée de [1, 2], crée avec Biorender.com
Prise en charge médicale du diabète insipide central
La prise en charge du diabète insipide d’origine centrale repose sur l’administration d’un traitement par hormone antidiurétique substitutive : la desmopressine. Cet analogue a une demi-vie plus longue que la vasopressine endogène et agit directement sur le récepteur AVPR2 au niveau rénal. Son administration peut se faire par voie orale (sublinguale), par voie intranasale ou par voie sous-cutanée et permet de restaurer la réabsorption d’eau libre. La dose administrée est variable d’un patient à l’autre et est dictée par la clinique. L’effet indésirable le plus souvent rapporté est la survenue d’hyponatrémie par surdosage et par réabsorption excessive d’eau libre. Lors d’une analyse rétrospective sur les bilans biologiques réalisés en ambulatoire pendant 10 ans chez 137 patients atteints de diabète insipide, on notait la présence d’hyponatrémies sévères chez 15% des patients et d’hyponatrémies moins sévères chez 27% des patients [21]. La survenue d’hyponatrémie peut être prévenue par l’omission volontaire d’une dose de desmopressine jusqu’à l’apparition d’une polyurie permettant d’éliminer l’excès d’eau libre. Cette stratégie, non évaluée par des études cliniques permettrait une réduction des épisodes d’hyponatrémie. Dans l’enquête réalisée auprès de plus de 1000 patients : les épisodes d’hyponatrémie étaient rapportés dans 17 % des cas chez les patients réalisant spontanément des omissions de prise (67% des patients) et dans 29 % des cas chez les patients ne réalisant pas ces sauts de prises (33 % des patients) (OR = 0,44 [0,31 , 0,64]) [6]. Ces oublis de prise étaient faits plusieurs fois par semaine ou quotidiennement.
Malgré un traitement substitutif adapté, 64% des patients rapportent tout de même une altération de la qualité de vie après l’apparition du diabète insipide, et cela, malgré une prise en charge adaptée et indépendamment de la présence d’un déficit antéhypophysaire [6]. Les patients rapportent une augmentation de l’anxiété, des troubles du sommeil, et des troubles de l’humeur. Ces troubles s’inscrivaient dans le cadre d’une pathologie suivie et traitée dans 11% des cas. De manière intéressante, 52 % des patients rapportaient également des troubles des interactions sociales et une diminution de l’amusement impactant leur bien-être physique et psychique global dans environ 40% des cas. Outre les conséquences liées à une pathologie chronique sur la qualité de vie, une origine somatique peut être évoquée compte-tenu d’une possible diminution de la sécrétion d’ocytocine, également sécrétée par la post-hypophyse [22]. Au-delà de ses effets sur la reproduction et le métabolisme [23, 24], l’ocytocine est impliquée dans d’autres processus dont certains impliquant le système nerveux central. L’action de l’ocytocine sur le système nerveux central implique différentes cibles notamment l’hippocampe et l’amygdale (Figure 3) [25]. L’ocytocine et sa signalisation sont impliquées dans la régulation des comportements sociaux tels que l’attachement, l’interaction sociale, la confiance et l’anxiété, la gestion de la peur et l’empathie [26, 27].
L’ensemble des manifestations neurocognitives retrouvées chez certains patients présentant une atteinte de la post-hypophyse pourraient alors s’inscrire dans un déficit en ocytocine associé au déficit en hormone antidiurétique et secondaire à l’atteinte de la post-hypophyse. Le traitement chirurgical du craniopharyngiome constitue un bon exemple. Il peut conduire à des troubles métaboliques et neurocognitifs, qui ont fait rechercher un déficit en ocytocine dans cette population. Les dosages d’ocytocine de base donnent des résultats contradictoires d’une série de patients à l’autre [28-31]. Comme dans un certain nombre de déficit hormonaux, l’insuffisance n’est parfois diagnostiquée qu’après un test de stimulation mais les études de la variation des concentrations d’ocytocine après des tests de stimulations (exercice physique, macimoreline, arginine ou restriction hydrosodée) montrent également des résultats insuffisants et bien que certaines variations des concentrations d’ocytocine dans ces études soient statistiquement significatives, un chevauchement des valeurs entre les différents groupes limite l’interprétation et l’utilisation de ces tests en pratique usuelle [31-33]. Il semble que les patients ayant une atteinte de la post-hypophyse présentent une altération de la reconnaissance des émotions par rapport à des témoins sains et par rapport à des patients présentant un déficit antéhypophysaire isolé [28]. L’administration d’ocytocine, bien que très peu étudiée dans ce contexte, pourrait également améliorer certaines performances à des tests neurocognitifs [34]. Afin de confirmer l’implication de l’ocytocine dans ces manifestations neurocognitives et l’existence d’un réel déficit dans ces pathologies, un test de stimulation discriminant semble nécessaire.
Récemment, un test de stimulation par la MDMA (2,4-MethyleneDioxyMethAmphetamine), une drogue psychoactive, composante principale de l’ecstasy a été proposé. En effet, la MDMA favorise l’empathie, l’attachement, la sociabilité et le sentiment de bien-être. Ces manifestations neuropsychologiques sont dans une certaine mesure médiées par l’ocytocine et, contrairement à d’autres substances psychoactives (comme les amphétamines ou le LSD), l’administration de MDMA s’accompagne d’une élévation significative des concentrations plasmatiques d’ocytocine [35, 36]. Ainsi dans une étude pilote, la stimulation par l’administration par 100 mg de MDMA conduisait à une augmentation de 82 % des concentrations d’ocytocine chez des sujets sains alors qu’elles ne s’élevaient pas chez des sujets présentant une atteinte neuro-hypophysaire et un diabète insipide d’origine centrale (N=15 sujets / groupe) [37]. Cette absence d’élévation des concentrations d’ocytocine s’accompagnait d’une atténuation des effets positifs classiquement observés après MDMA chez des sujets sains. Ces résultats préliminaires semblent pointer vers un déficit en ocytocine chez les patients présentant une atteinte de la neurohypophyse avérée et ainsi suggérer l’intérêt d’un traitement substitutif.
Le traitement par ocytocine est largement utilisé par voie intra-veineuse dans le cadre de l’induction de l’accouchement et du traitement de l’hémorragie du post-partum et la forme intranasale a déjà été utilisée dans d’autres indications avec une tolérance satisfaisante [22, 38]. Toutefois, chez quelques patients ayant été opérés d’un craniopharyngiome, l’administration d’ocytocine ne semblait pas offrir des résultats évidents, sous réserve du faible nombre de patients étudiés et d’une administration ponctuelle. Cependant l’administration d’ocytocine a tout de même montré une amélioration de certaines caractéristiques sociocognitives lors de son utilisation dans d’autres indications comme le syndrome de Prader-Willi [34, 38]. Deux études, une en Suisse et l’autre aux Etats-Unis, ont débuté visant à étudier l’effet d’un traitement substitutif chez des patients présentant un déficit en vasopressine (Clinical Trials NCT06036004 et NCT04789148).
En conclusion, le déficit en ocytocine chez les patients atteints de diabète insipide est possible et pourrait permettre d’intégrer certaines conséquences socio-cognitives de la pathologie à une composante somatique mais les données de la littérature ne sont pas suffisantes pour conclure. La perspective d’un nouveau test de stimulation de l’ocytocine est intéressante mais devra être validée sur un plus grand nombre de sujet et dans d’autres études.
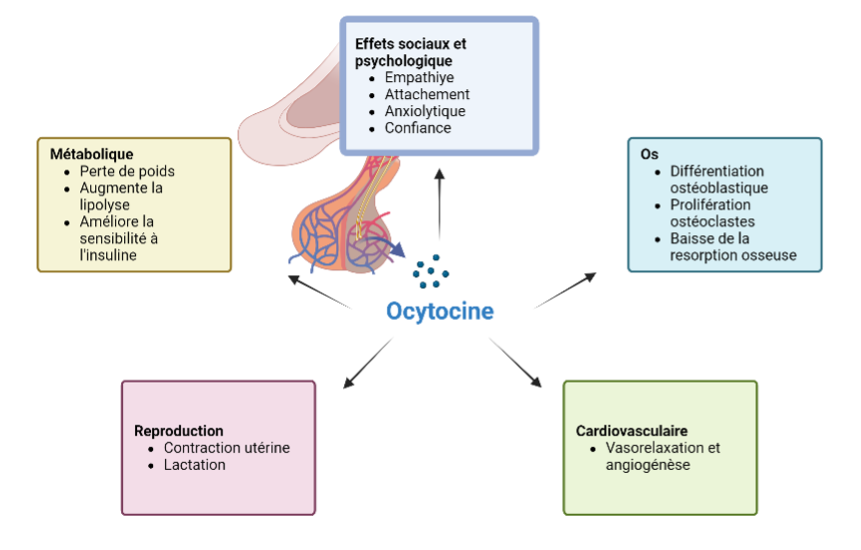
Figure 3 : Différentes actions de l’ocytocine
La libération dendritique de l’ocytocine conduit à un effet sur le système nerveux central par une diffusion locale lui permettant d’atteindre différentes régions du cerveau. De plus, les neurones parvocellulaires se projettent vers certaines régions du cerveau telles que l’amygdale, l’hippocampe, le striatum, le noyau suprachiasmatique, le noyau du lit de la strie terminale et le tronc cérébral, où l’ocytocine pourra agir comme neuromodulateur ou neurotransmetteur.
Figure adaptée de [22, 25], crée avec Biorender.com
Conclusion
Le diabète insipide d’origine centrale (ou déficit en vasopressine) reste une entité clinique rare dont le diagnostic peut être difficile. La confirmation diagnostique peut justifier la réalisation de tests dynamiques afin d’éliminer les diagnostics différentiels, principalement la polydipsie primaire. Pour cela, le test de référence demeure la restriction hydrique. L’utilisation de la copeptine après stimulation par perfusion hypertonique permet d’affiner le diagnostic dans certains cas difficiles mais demeure un test exposant le patient à des risques métaboliques. Des alternatives prometteuses sont en cours de validation et pourraient permettre d’apporter de nouveaux outils pour le diagnostic de diabète insipide.
Le prise en charge médicale du diabète insipide central est simple grâce à la desmopressine mais nécessite une éducation du patient pour assurer son autonomie et éviter la survenue de complications notamment dans le cadre du soin. La place de l’ocytocine dans cette pathologie reste à démontrer mais offre des perspectives intéressantes.
Bibliographie
- Angelousi, A., et al., New developments and concepts in the diagnosis and management of diabetes insipidus (AVP-deficiency and resistance). J Neuroendocrinol, 2023. 35(1): p. e13233.
- Christ-Crain, M., et al., Diabetes insipidus. Nature Reviews Disease Primers, 2019. 5(1).
- Working Group for Renaming Diabetes, I., et al., Changing the name of diabetes insipidus: a position statement of The Working Group for Renaming Diabetes Insipidus. Eur J Endocrinol, 2022. 187(5): p. P1-P3.
- Lindholm, J., Diabetes insipidus: historical aspects. Pituitary, 2004. 7(1): p. 33-8.
- Prentice, M., Time for change: Renaming Diabetes Insipidus to improve patient safety. Clin Endocrinol (Oxf), 2018. 88(5): p. 625-626.
- Atila, C., et al., Central diabetes insipidus from a patient’s perspective: management, psychological co-morbidities, and renaming of the condition: results from an international web-based survey. Lancet Diabetes Endocrinol, 2022. 10(10): p. 700-709.
- Fenske, W. and B. Allolio, Clinical review: Current state and future perspectives in the diagnosis of diabetes insipidus: a clinical review. J Clin Endocrinol Metab, 2012. 97(10): p. 3426-37.
- Fenske, W., et al., A Copeptin-Based Approach in the Diagnosis of Diabetes Insipidus. New England Journal of Medicine, 2018. 379(5): p. 428-439.
- Moses, A.M., B. Clayton, and L. Hochhauser, Use of T1-weighted MR imaging to differentiate between primary polydipsia and central diabetes insipidus. AJNR Am J Neuroradiol, 1992. 13(5): p. 1273-7.
- Cote, M., et al., Normal dimensions of the posterior pituitary bright spot on magnetic resonance imaging. J Neurosurg, 2014. 120(2): p. 357-62.
- De Wardener, H.E. and A. Herxheimer, The effect of a high water intake on the kidney’s ability to concentrate the urine in man. J Physiol, 1957. 139(1): p. 42-52.
- Miller, M., et al., Recognition of partial defects in antidiuretic hormone secretion. Ann Intern Med, 1970. 73(5): p. 721-9.
- Fenske, W., et al., Copeptin in the differential diagnosis of the polydipsia-polyuria syndrome–revisiting the direct and indirect water deprivation tests. J Clin Endocrinol Metab, 2011. 96(5): p. 1506-15.
- Cadnapaphornchai, M.A., et al., Effect of primary polydipsia on aquaporin and sodium transporter abundance. Am J Physiol Renal Physiol, 2003. 285(5): p. F965-71.
- Baylis, P.H. and C.J. Thompson, OSMOREGULATION OF VASOPRESSIN SECRETION AND THIRST IN HEALTH AND DISEASE. Clinical Endocrinology, 1988. 29(5): p. 549-576.
- Thompson, C.J., C.R. Edwards, and P.H. Baylis, Osmotic and non-osmotic regulation of thirst and vasopressin secretion in patients with compulsive water drinking. Clin Endocrinol (Oxf), 1991. 35(3): p. 221-8.
- Thompson, C.J., P. Selby, and P.H. Baylis, Reproducibility of osmotic and nonosmotic tests of vasopressin secretion in men. Am J Physiol, 1991. 260(3 Pt 2): p. R533-9.
- Zerbe, R.L. and G.L. Robertson, A comparison of plasma vasopressin measurements with a standard indirect test in the differential diagnosis of polyuria. N Engl J Med, 1981. 305(26): p. 1539-46.
- Winzeler, B., et al., Arginine-stimulated copeptin measurements in the differential diagnosis of diabetes insipidus: a prospective diagnostic study. Lancet, 2019. 394(10198): p. 587-595.
- Atila, C., et al., Glucagon-stimulated copeptin measurements in the differential diagnosis of diabetes insipidus: a double-blind, randomized, placebo-controlled study. Eur J Endocrinol, 2022. 187(1): p. 65-74.
- Behan, L.A., et al., Abnormal plasma sodium concentrations in patients treated with desmopressin for cranial diabetes insipidus: results of a long-term retrospective study. Eur J Endocrinol, 2015. 172(3): p. 243-50.
- Bhargava, R., K.L. Daughters, and A. Rees, Oxytocin therapy in hypopituitarism: Challenges and opportunities. Clinical Endocrinology, 2019. 90(2): p. 257-264.
- Lawson, E.A., The effects of oxytocin on eating behaviour and metabolism in humans. Nat Rev Endocrinol, 2017. 13(12): p. 700-709.
- Deblon, N., et al., Mechanisms of the anti-obesity effects of oxytocin in diet-induced obese rats. PLoS One, 2011. 6(9): p. e25565.
- Meyer-Lindenberg, A., et al., Oxytocin and vasopressin in the human brain: social neuropeptides for translational medicine. Nat Rev Neurosci, 2011. 12(9): p. 524-38.
- Young, L.J. and Z. Wang, The neurobiology of pair bonding. Nature Neuroscience, 2004. 7(10): p. 1048-1054.
- Winslow, J.T., et al., A role for central vasopressin in pair bonding in monogamous prairie voles. Nature, 1993. 365(6446): p. 545-8.
- Daughters, K., A.S.R. Manstead, and D.A. Rees, Hypopituitarism is associated with lower oxytocin concentrations and reduced empathic ability. Endocrine, 2017. 57(1): p. 166-174.
- Aulinas, A., et al., Low Plasma Oxytocin Levels and Increased Psychopathology in Hypopituitary Men With Diabetes Insipidus. J Clin Endocrinol Metab, 2019. 104(8): p. 3181-3191.
- Daubenbuchel, A.M., et al., Oxytocin in survivors of childhood-onset craniopharyngioma. Endocrine, 2016. 54(2): p. 524-531.
- Gebert, D., et al., De-masking oxytocin-deficiency in craniopharyngioma and assessing its link with affective function. Psychoneuroendocrinology, 2018. 88: p. 61-69.
- Brandi, M.L., et al., Oxytocin release deficit and social cognition in craniopharyngioma patients. J Neuroendocrinol, 2020. 32(5): p. e12842.
- Sailer, C.O., et al., Oxytocin levels in response to pituitary provocation tests in healthy volunteers. Eur J Endocrinol, 2021. 185(3): p. 355-364.
- Hoffmann, A., et al., First experiences with neuropsychological effects of oxytocin administration in childhood-onset craniopharyngioma. Endocrine, 2017. 56(1): p. 175-185.
- Kirkpatrick, M.G., et al., Effects of MDMA and Intranasal oxytocin on social and emotional processing. Neuropsychopharmacology, 2014. 39(7): p. 1654-63.
- Holze, F., et al., Distinct acute effects of LSD, MDMA, and D-amphetamine in healthy subjects. Neuropsychopharmacology, 2020. 45(3): p. 462-471.
- Atila, C., et al., Oxytocin in response to MDMA provocation test in patients with arginine vasopressin deficiency (central diabetes insipidus): a single-centre, case-control study with nested, randomised, double-blind, placebo-controlled crossover trial. Lancet Diabetes Endocrinol, 2023. 11(7): p. 454-464.
- Kuppens, R.J., S.H. Donze, and A.C. Hokken-Koelega, Promising effects of oxytocin on social and food-related behaviour in young children with Prader-Willi syndrome: a randomized, double-blind, controlled crossover trial. Clin Endocrinol (Oxf), 2016. 85(6): p. 979-987.
