MUST 2023 – L’EXCES DE STEROÏDES ANDROGENIQUES CHEZ LA FEMME
Auteurs : Daphné Karila (a, b), Véronique Kerlan (c), Sophie Christin-Maitre (a,b)
a) Service d’endocrinologie, diabétologie et médecine de la reproduction, Hôpital Saint-Antoine, Assistance publique-Hôpitaux de Paris 75012 Paris, France
b) Sorbonne Université, 75006 Paris, France
c) Service d’endocrinologie, Université de Bretagne
Occidentale, Hôpital de Brest, 29200 Brest, France
Résumé
La prise excessive de stéroïdes anabolisants-androgéniques (SAA) dans le milieu sportif concerne les athlètes professionnels mais de plus en plus les amateurs. La prévalence de leur utilisation est en augmentation depuis de nombreuses années. Si cette
pratique concerne surtout les hommes, elle existe chez les femmes avec une prévalence évaluée à 1,6%. Depuis 2014, il existe pour les sportifs en compétition un passeport stéroïdien, basé sur des mesures longitudinales de stéroïdes sanguins et urinaires
par la technique de LC-MS/MS. L’excès de stéroïdes androgéniques induit une stimulation de la croissance musculaire et une amélioration des performances musculaires. Cependant leur prise est potentiellement associée à de nombreux effets secondaires,
comme une hypertrophie myocardique, une altération du métabolisme lipidique et un effet pro-thrombotique. L’excès de SAA induit potentiellement un sur-risque d’athérosclérose et d’événements cardio-vasculaires. Les données chez la femme sont à ce
jour, peu abondantes. Chez les athlètes, les troubles des cycles sont fréquents, avec une spanioménorrhée voire une aménorrhée. Ils peuvent être secondaires à l’insuffisance gonadotrope par balance énergétique négative mais également par l’hyperandrogénie
endogène ou exogène. La prise de SAA est un problème de santé publique probablement sous-estimé, en particulier chez les femmes. Elle représente un enjeu de prévention par les professionnels de santé.
Mots clefs :
Stéroïdes Androgéniques Anabolisants, Hyperandrogénie, Femme, Dopage
Cet article a bénéficié du soutien institutionnel d’Ipsen Pharma, le 1er auteur ayant été un participant des Must de l’Endocrinologie 2023.
Abbréviations :
- SAA : stéroïdes anabolisants-androgéniques
- T : testostérone
- E : épitestostérone
- DHT : 5a dihydrotestostérone
- SOPK : syndrome des ovaires polykystiques
- VDG : variation du développement génital
- PBA : passeport biologique de l’athlète
- AMA : Agence Mondiale Antidopage
INTRODUCTION
La prise excessive de stéroïdes anabolisants-androgènes (SAA) dans le milieu sportif a débuté vers les années 1960. Elle concerne à la fois les athlètes professionnels mais aussi les amateurs, les adolescents comme les adultes, surtout les hommes mais
aussi les femmes (1). Cet article présente les différentes formes de stéroïdes endogènes et exogènes, le dépistage des stéroïdes exogènes ainsi que leurs impacts sur la santé des femmes jeunes, avant la ménopause. Les données sont essentiellement
issues d’études suédoises et/ou d’études réalisées chez les athlètes de haut niveau (2,3). Il existe depuis 50 ans, une augmentation croissante de la proportion de femmes pratiquant du sport en compétition à haut niveau, et donc potentiellement exposées
au risque de dopage par SAA. En effet, en 1972, aux jeux olympiques d’été de Munich, 15 % des participants étaient des femmes, contre 44 % en 2012, à Londres. Les jeux de Londres ont été les premiers Jeux olympiques où les femmes ont concouru dans
toutes les disciplines.
RAPPEL SUR LA PRODUCTION ET LE METABOLISME DES ANDROGENES CHEZ LA FEMME
Production des androgènes : Chez la femme en âge de procréer, la testostérone (T) est le principal androgène. Elle a 3 origines : environ 25% provient de la zone fasciculée des surrénales
après stimulation par l’ACTH, 25% de l’ovaire après stimulation par la LH et 50% par conversion périphérique de l’androstènedione (delta4A) en T. Chez la femme, la delta4A est sécrétée par les surrénales (50%) et les ovaires (50%)(4). La synthèse
des androgènes nécessite de nombreuses enzymes qui, à partir du cholestérol, catalysent, clivent et permettent la conversion de précurseurs nécessaires à la production de T, de delta4A et de DHEA (5). Un autre androgène est l’épitestostérone (17 α
hydroxy-4-androstène-3-one) qui est l’épimère en position 17 de T (6). La production totale de T est d’environ 0,25 mg par jour chez la femme. Elle augmente pendant la puberté et atteint son maximum à l’âge de 20 à 25 ans avant de diminuer progressivement
avec l’âge.
Action, métabolisme et excrétion des androgènes : Pour agir, la T se lie aux récepteurs nucléaires des androgènes (AR) situés dans les tissus cibles. La T peut être convertie en différentes
molécules, notamment en 17β estradiol (E2) par l’aromatase. Elle peut aussi être métabolisée en un androgène plus puissant, la 5 α dihydrotestostérone (DHT), par l’enzyme appelée 5 α-réductase, localisée dans différents tissus, en particulier le foie,
la peau, les reins, le pancréas et le cerveau. La DHT se lie au récepteur AR avec une affinité 5 à 10 fois plus élevée que celle de T (7).
Dans les tissus cibles, les voies de dégradation des androgènes dépendent principalement de deux voies, la 5 α et la 5β-réduction. La 5β-réduction est uniquement localisée dans le foie. La 5α- réduction est réalisée dans le foie, la peau, le tissu adipeux,
les poumons. Ces voies permettent une métabolisation des androgènes en métabolites inactifs, comme l’androstérone et l’étiocholanolone (5,8).
Enfin, les enzymes Uridine Diphospho-Glucuronosyltransférases (UGT) interviennent dans l’excrétion des androgènes. Elles sont exprimées dans la majorité des tissus et permettent de conjuguer l’acide glucuronique aux androgènes permettant leur excrétion
urinaire ou biliaire. Il existe plusieurs isoformes d’UGT dont l’UGT2B7 et l’UGT2B1 et surtout l’UGT2B17 qui est l’enzyme majoritaire (8). Il existe des polymorphismes génétiques de ces enzymes, en particulier une délétion homozygote de UGT2B17
appelée (del/del). Cette délétion est plus fréquente chez les individus d’Asie de l’est que chez les caucasiens ou les africains (9).
Environ 65 à 70 % de T circulante est liée à la SHBG sécrétée par le foie, 30 à 35 % liée à l’albumine et les 0,5 à 3 % restant correspondent à la fraction libre. La somme des fractions libres et liées à l’albumine représente la testostérone biodisponible.
Les mesures basées sur la chromatographie liquide et la spectrométrie de masse (provenant de 9 études) indiquent que l’intervalle de testostéronémie totale circulante normal chez une femme en bonne santé de moins de 40 ans se situe entre 0,2 à
1,7 nmol/L (10).
EXCES ENDOGENE DE STEROÏDES ANDROGENIQUES:
Il est important de bien distinguer les pathologies avec une augmentation endogène des androgènes des prises exogènes de T. La pathologie féminine la plus fréquente responsable d’une augmentation de la concentration endogène d’androgènes est le syndrome
des ovaires polykystiques (SOPK), puisqu’il concerne 10 à 13 % des femmes en âge de procréer (11,12). L’hyperandrogénie (clinique et/ou biologique) est observée dans environ 75 % des cas de SOPK (13). Son origine est une anomalie des cellules de la
thèque du follicule, majorée par une augmentation de la pulsatilité de la GnRH, et de la LH (11).
Les autres causes d’hyperandrogénie endogènes sont des pathologies génétiques rares comme l’hyperplasie congénitale des surrénales, les mutations de la 5 α-réductase et les résistances partielles aux androgènes. Elles peuvent induire une variation du
développement génital (VDG).
L’hyperplasie congénitale des surrénales (HCS) est une maladie autosomique récessive, liée dans 95% des cas à une mutation du gène CYP21A2 avec une incidence entre 1/15 000 et 1/16 000 naissances pour la forme classique et une incidence de 1/200 à 1/1000
naissances pour la forme non classique (14). Dans une cohorte de femmes avec des blocs partiels ou complets en 21 hydroxylase (n=161), le dosage de T total était de 0,86 +/- 0,5 ng/ml (N : 0,40 + /- 0,2 ng/ml) soit 2,9 +/- 1,7 nmol/L (15). Cette
concentration moyenne est similaire à celle retrouvée par Bachelot et al., égale à 0,5 +/- 0,7 ng/ml (n=45). A noter que dans cette étude, la T était supérieure à 1,4 ng/ml chez 20/161 patientes et dans la zone normale chez 56/161 patientes (31,3%).
Le déficit en 5α-réductase est une maladie autosomique récessive exceptionnelle dont la prévalence n’est pas connue. A ce jour, environ 50 familles ont été rapportées dans le monde. Ce déficit est lié à une mutation du gène SRD5A2, qui inhibe
la conversion de T en DHT. Le diagnostic peut être réalisé dans l’enfance ou l’adolescence, en fonction des phénotypes cliniques extrêmement variables, chez des individus ayant un caryotype 46, XY. Dans certains cas le diagnostic se fait à la puberté,
lorsque la sécrétion de testostérone augmente et qu’apparaît une virilisation. Quatre cas ont été décrits chez des athlètes féminines (16). Elles étaient âgées de 18, 20, 21 et 20 ans au moment du diagnostic et avaient présenté une aménorrhée primaire
avec une absence de développement mammaire et une apparition de signes de virilisation à la puberté, en particulier une clitoridomégalie. Cliniquement elles étaient de grande taille (178-171-163-172 cm), minces, avec un squelette osseux de morphotype
masculin. Sur le plan hormonal leurs concentrations de T étaient autour de 20 nmol/L (6,2-ng/ml) avec une DHT basse chez 3 des 4 patientes.
Une troisième étiologie génétique d’hyperandrogénie endogène est le syndrome d’insensibilité aux androgènes. Ce syndrome survient chez des individus 46, XY. Il est secondaire à une perte de fonction du récepteur des androgènes, qui peut être complète
donnant une insensibilité complète aux androgènes (AIS) ou partielle (PAIS) (17). L’incidence de ce syndrome (forme complète et partielle) est estimée à 1/20 000 à 1/99 000 individus (18). Dans les formes partielles, le phénotype est variable, allant
de celui d’une femme virilisée ayant une hyperandrogénie biologique, à celui d’un homme peu virilisé. La concentration de T mesurée chez 14 individus avec PAIS était de 5,4-55,2 nmol/L (médiane 35,8 nmol/L)(19). La figure 1 présente les dosages de
T totale sérique et les intervalles en fonction des pathologies rapportées.
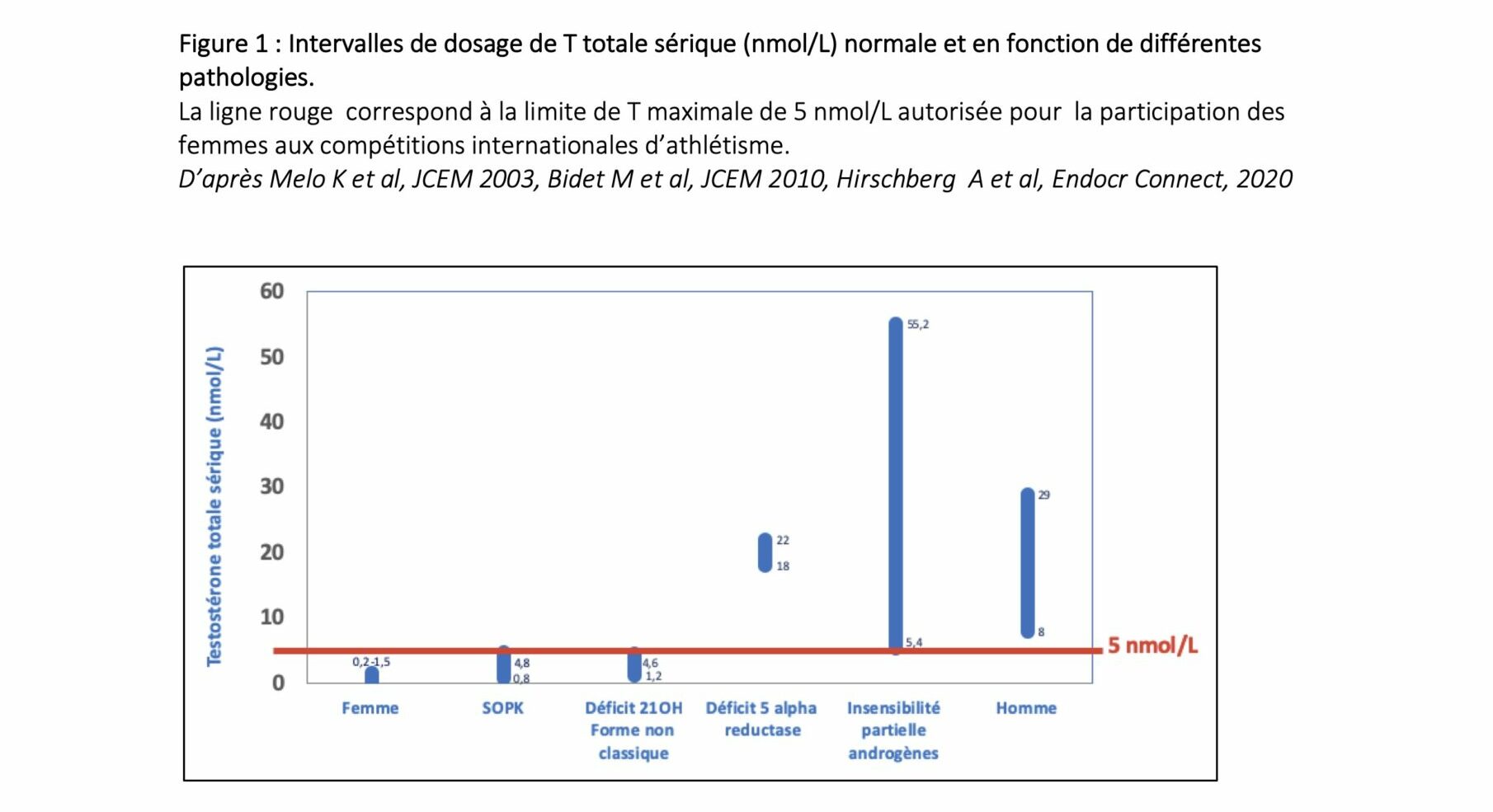
Il est intéressant de noter qu’il existe une prévalence plus importante des pathologies induisant un excès endogène de stéroïdes chez les femmes athlètes. Hagmar et al. ont étudié 90 athlètes olympiques, parmi les 46 ne prenant pas de contraception estroprogestative
(COP), 17/46 (37%) avaient les critères échographiques et cliniques du SOPK (20). De plus, alors que l’incidence dans la population générale d’un VDG 46,XY est estimée à 1/20,000 naissances, la prévalence chez les athlètes femmes participant aux compétitions
sportives mondiales est d’environ 7/1000 soit 140 fois plus élevée que dans la population générale (21).
EXCES EXOGENE DE STEROÏDES ANDROGENIQUES ANABOLISANTS
HISTORIQUE
Historiquement, les athlètes d’Europe de l’Est étaient soupçonnées de débuter une grossesse puis de l’interrompre la veille des grandes compétitions afin de profiter d’une sécrétion élevée de progestérone pendant 90 jours (22).L’effet recherché était
une augmentation du volume sanguin associée à une meilleure oxygénation des cellules et une relaxation des tendons et des muscles. Ces effets n’ont pas été confirmés scientifiquement et ce type de pratique a été condamné. La molécule de T a été isolée
pour la première fois dans les années 1930 (David et al. 1935 ; Wettstein 1935), puis de nombreux dérivés de la T ont été synthétisés dans les années qui ont suivi (SAA) (23). L’utilisation illicite de SAA chez les athlètes a débuté après la mise
au point du premier stéroïde anabolisant, le Dianabol® (Méthandiénone), en 1956 (24). Les SAA représentent la classe de molécules la plus couramment utilisée pour le dopage par les athlètes féminines d’élite (25). Les succès observés chez les athlètes
féminines de la République Démocratique Allemande ont constitué la base des connaissances sur les impacts de l’abus de SAA dans les sports de compétition féminins (26). Aux jeux olympiques de Tokyo en 1964, le recours aux SAA a été dénoncé. La fédération
Internationale d’Athlétisme a interdit l’usage de SAA aux jeux olympiques de Munich en 1972, puis l’usage de T en 1982. C’est à partir de 1980 que la prise de SAA s’est répandue dans la population générale, alimentée par l’importance croissante de
l’image du corps et de la musculature, d’abord aux États-Unis puis en Europe (27). A partir des années 60, a débuté le dépistage de la prise de SAA. La France est le premier pays à avoir interdit en 1965 leur utilisation par la loi « Herzog ». Cette
loi a été remplacée par la loi « Bambuck » en 1989 qui ne sanctionne plus uniquement le sportif mais également l’entourage de l’athlète ayant aidé au dopage. Une baisse significative de la prévalence de la consommation de SAA a été constatée entre
1990 et 1999 par rapport aux années 1980, peut-être en partie suite à la promulgation de ces lois.
Pour évaluer la prévalence de l’utilisation de stéroïdes, D. Sagoe et al. ont réalisé une méta-analyse de 187 articles publiés entre 1974 et 2013 incluant des hommes mais aussi des femmes. La majorité des données sont issues d’Amérique du Nord (n=126),
d’Europe (n=81) et d’Océanie (n =38). La prévalence de l’utilisation de stéroïdes anabolisants au cours de la vie était estimée à 3,3 % de la population. Il est à noter qu’elle était significativement plus faible chez les femmes que chez les hommes
(1.6 % vs 6.4 % (p<0.001)(1). Cependant ces chiffres sont probablement sous-estimés puisque les recueils ont été basés sur des données déclaratives.
LES SAA UTILISES
Les stéroïdes potentiellement utilisés sont des agents anabolisants et androgéniques (stéroïdes AA). L’anabolisme fait référence aux propriétés de construction des muscles squelettiques sous l’effet des stéroïdes tandis que l’androgène se réfère à l’induction
et au maintien des caractères sexuels secondaires masculins, qui inclut l’action anabolisante. Les stéroïdes AA les plus couramment utilisées pour le dopage sont la testostérone, la boldénone, la métandienone et la nortestostérone (28) (Figure 2).
Ces molécules peuvent être 5α réduites en DHT, et aromatisées en œstrogènes. Un des objectifs de l’utilisation des SAA est d’obtenir une élévation de la concentration de DHT, en raison de son activité androgénique supérieure à celle de la T.
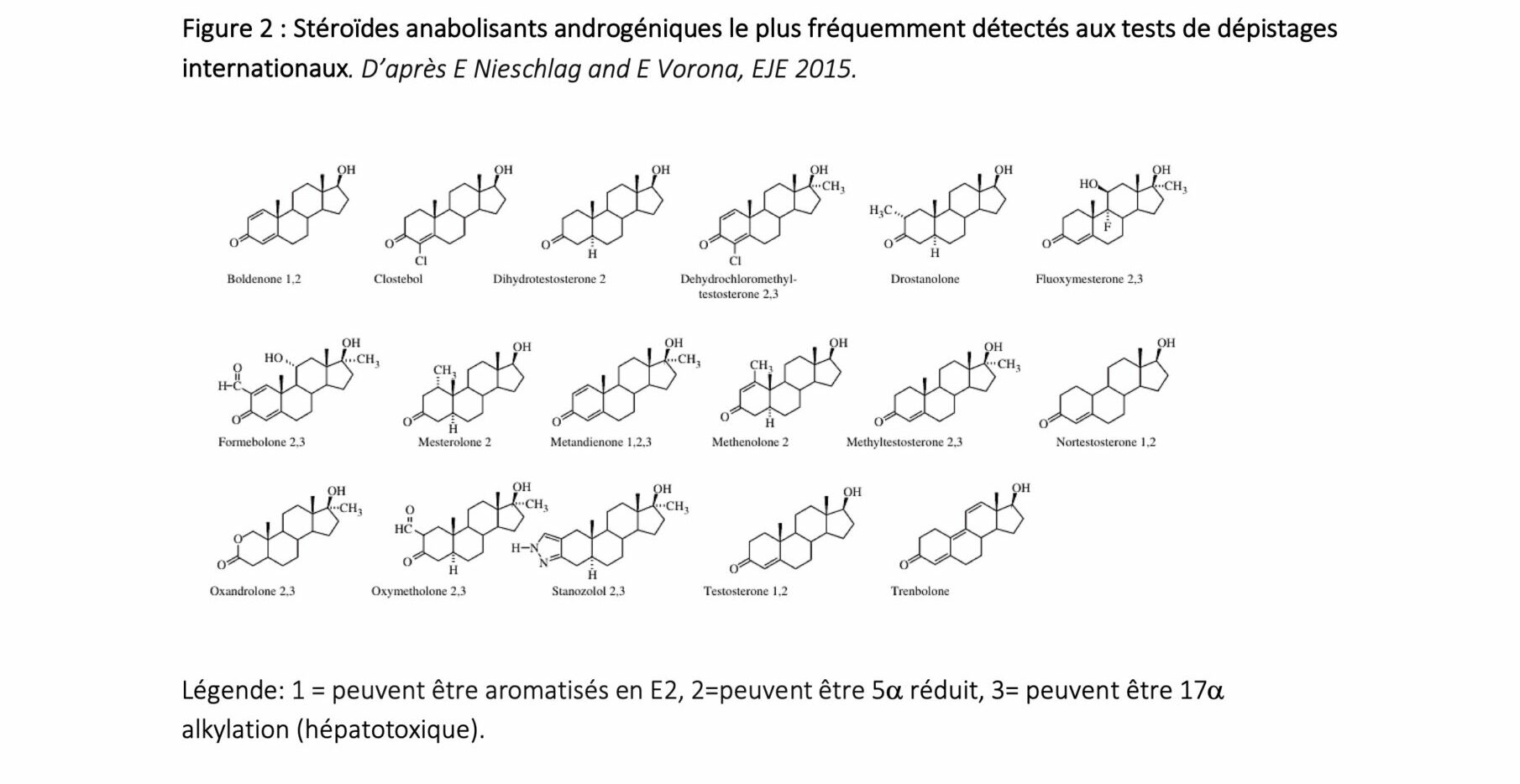
Les utilisateurs de SAA consomment en général des associations de plusieurs molécules, dont les doses administrées cumulées peuvent atteindre un équivalent de 600 à 1000 mg de T (ou dérivés) par semaine (29). L’achat de SAA est de plus en plus accessible,
notamment en vente libre sur internet. L’attrait pour ces consommations de SAA est croissant, comme en témoigne le nombre de résultats correspondant à la recherche internet « steroids for sale » : 328 000 en décembre 2011 (30) alors que cette recherche
a retrouvé 61 100 000 résultats en août 2023. De nombreux stéroïdes illicites ont été mis sur le marché avec des modifications structurelles dans l’optique de les rendre indétectables aux contrôles anti-dopages.
LE DEPISTAGE :
En 1967, le Comité International Olympique (CIO) a créé une structure anti-dopage et initié en 1999 la création de l’Agence Mondiale Antidopage (AMA). En France, la lutte contre le dopage est réglée par l’Agence Française de Lutte anti Dopage (AFLD) et
ses règlements sont en conformité avec l’AMA.
La méthode de référence pour le contrôle antidopage des SAA à l’heure actuelle est la chromatographie liquide associée à la spectrométrie de masse tandem (LC-MS/MS) dans les urines ou le sang. La LC-MS/MS est une technique qui associe : – la LC pour «
Liquid Chromatography » qui est un système de séparation des molécules de l’échantillon en fonction de leur polarité et de leurs interactions avec la colonne de chromatographie liquide. – la MS pour « Mass Spectrometry » qui est un système de détection
et d’analyse. Chaque molécule subit une ionisation tour à tour dans le spectromètre de masse. Ensuite, les ions sont séparés par l’analyseur de masse selon leur ratio masse/charge. – Puis une seconde analyse MS sur les premiers fragments obtenus qui
permet une identification plus précises des composés (analyse en tandem) Cette méthode permet une analyse et une quantification directe des stéroïdes et des métabolites provenant de la prise de SAA exogènes. Elle permet une analyse du profil stéroïdien
urinaire ou sanguin comprenant notamment les concentrations de SAA endogènes : T et son épimère E ainsi que les 4 métabolites de la testostérone : l’androstérone (A), l’étiocholanolone (Etio), le 5α-androstane-3α, le 17β-diol (5αAdiol) et le 5β-androstane-3α,17β-diol
(5βAdiol).
Les modalités de dépistage de la consommation de SAA varient entre les disciplines sportives. La détection sur échantillon urinaire est privilégiée, car il s’agit d’une méthode non invasive et qu’elle permet une détection des stéroïdes sur une période
plus longue dans le temps qu’un prélèvement sanguin. La procédure classique de contrôle du dopage (source : Agence Mondiale Antidopage) se déroule par étapes. Les sportifs peuvent être sélectionnés pour un contrôle en compétition ou hors compétition,
par un Agent Contrôle du Dopage (ACD), à tout moment, n’importe où et sans préavis. Plusieurs échantillons d’urines, de sang, ou les deux sont collectés et analysés anonymement. Les résultats sont ensuite transmis à l’organisation anti dopage ainsi
qu’une copie à l’AMA. En 2008, l’AMA a mis en place le passeport biologique de l’athlète (PBA). Il constitue une aide au dépistage en réalisant un suivi longitudinal des paramètres biologiques de chaque athlète. Il contient un module hématologique
(NFS, hématocrite) et un module stéroïdien qui a été ajouté en 2014 (31). La détection de variations des paramètres hormonaux fait suspecter l’utilisation de SAA exogènes. Le module stéroïdien comprend le dosage des 6 stéroïdes urinaires cités ci-dessus,
et le calcul de 5 ratios : Testostérone/épitestostérone (T/E), Androstérone/Testostérone (A/T), Androstérone/étiocholanone (A/Etio), 5α-androstane-3α,17β-diol/5β-androstane-3α,17β-diol (5αAdiol/5βAdiol), 5α-androstane-3α,17β-diol/épitestostérone (5αAdiol/E).
D’après le règlement de 2019 de la fédération internationale d’athlétisme (World Athletics), la limite de T totale sérique pour la participation aux compétitions féminines d’athlétisme est de 5 nmol/L. La détection d’une variation du ratio T/E dans
le profil stéroïdien permet de suspecter l’utilisation de SAA. En effet, sur la base d’études du profil stéroïdien de populations d’athlètes, Donike et al. ont décrit que le ratio normal T/E est autour de 1. Comme E n’augmente pas après la prise
de T exogène, la limite de ce ratio T/E pour définir l’abus de SAA a été fixée à 6 en 1983 par le CIO. En 2004, ce ratio a été abaissé à 4 par l’AMA (32). Il est à noter que le suivi longitudinal des profils stéroïdiens inclus dans le passeport biologique
de l’athlète peut-être plus difficile chez les femmes que chez les hommes. En effet, le cycle menstruel (33), la grossesse (34), la prise d’une contraception hormonale (35) ainsi que l’activité physique (36) sont susceptibles d’induire des variations
de T/E. Concernant la contraception hormonale, Ekström et al. ont mesuré les concentrations urinaires des métabolites stéroïdiens après trois mois d’une COP contenant du lévonorgestrel et de l’éthinylestradiol (n = 55). Une baisse importante d’E a
été constatée (médiane de 6,78 à 3,04 ng/mL, p=0,0001) (35). Ainsi, la prise de COP peut augmenter le rapport T/E. Enfin, l’excrétion urinaire de stéroïdes exogènes peut différer en fonction du polymorphisme du gène UGT2B17 (9). Il a été démontré
que les femmes homozygotes pour l’allèle de délétion du gène (del/del) ont une excrétion urinaire de T plus basse et donc un rapport T/E plus faible que les femmes ayant un génotype différent (37). Ce polymorphisme peut de plus modifier l’excrétion
urinaire de T exogène. En effet, la prise de T per cutanée à la dose de 10 mg/jour, pendant 10 semaines (n=23), a été testée contre placebo, en fonction du polymorphisme UGT2B17. Les femmes homozygotes pour l’allèle de délétion d’UGT2B17 avaient des
concentrations urinaires de T et de 5βAdiol plus faibles que celles exprimant le gène (p < 0,001) (38).
IMPACTS DE L’EXCES DE STEROÏDES
Lors de l’évaluation de l’impact de l’excès de stéroïdes chez les femmes, il est important de distinguer d’emblée les origines endogènes de l’hyperandrogénie d’une part, des prises exogènes de SAA d’autre part. A ce jour, les données concernant la prise
de SAA chez les femmes sont peu connues (39). Les effets des SAA ont été surtout rapportés chez les hommes (40,41). De plus, l’utilisation de ces molécules est hétérogène, tant sur la quantité que sur la durée, elle peut être associée à la consommation
d’autres produits toxiques, ayant des effets secondaires spécifiques.
COMPOSITION CORPORELLE ET PERFORMANCE MUSCULAIRE
Un des effets les mieux connus des androgènes est l’impact musculaire. La liaison de T et de DHT à leur récepteur active la synthèse dans les muscles squelettiques de plusieurs protéines dont l’actine et la myosine qui induisent ensuite une mobilisation
des cellules satellites musculaires autour des fibres musculaires, une différenciation en nouvelles cellules musculaires et ainsi une augmentation du nombre et de la taille des fibres musculaires. Le principal impact de T est une augmentation de la
croissance musculaire (42). Des expériences chez la souris ont montré que T augmente l’expression de la myostatine dans le muscle squelettique, la biogenèse mitochondriale, l’expression de la myoglobine et la teneur en IGF-1. Tous ces éléments peuvent
induire une augmentation de la production d’énergie et de puissance de l’activité musculaire squelettique (43).
L’effet de l’hyperandrogénie endogène sur les performances sportives a été particulièrement étudié, chez les femmes ayant un SOPK. Rickenlund et al. ont rapporté que les athlètes ayant un SOPK ont une plus grande masse et force musculaire que les autres
athlètes (44). Les athlètes avec un SOPK obtiennent de meilleurs résultats au test de Léger (test de course à pied qui permet d’évaluer l’aptitude physique en aérobie) et d’absorption maximale d’oxygène (VO2 max) que les femmes contrôles (figure 3), indépendamment de la composition corporelle (2,3,44). Leurs niveaux de T étaient positivement corrélés à la Vo2 max (44). Ces données ont été confirmées dans une étude cas-témoins incluant 80 femmes (40 atteintes du SOPK et 40 témoins) mesurant la force musculaire maximale à l’aide d’un test de répétition. Les exercices comprenaient l’extension des jambes pour mesurer la force du bas du corps, le développé couché pour le tronc et la flexion du biceps pour le haut du corps. Les femmes avec un SOPK avaient une plus grande force que les témoins au test de développé couché (30,6 kg (seuil 22-40) vs 27,0 kg (seuil 20-40) (p<0.04) (45). Pour évaluer l’impact exogène de la T sur la force musculaire, 48 femmes en bonne santé et physiquement actives, âgées de 18 à 35 ans ont été traitées pendant 10 semaines par de la T per-cutanée (10 mg/jour) ou par un placebo. Chez les femmes ayant reçu le gel de T, les concentrations sériques de T sont passés d’une moyenne de 0,9 nmol/L ± 0,4 à 4,3 ± 2,8 nmol/L (p<0.001). Les performances aérobies des femmes traitées (temps de course jusqu’à épuisement) se sont améliorées de 21.17 secondes (8,5 %), de manière statistiquement significative par rapport au groupe placebo (p=0,045 ) (46). Wiik et al. ont étudié l’effet d’un an de traitement par injections intramusculaires de T chez les hommes transgenres en début de transition. Les deux premières injections de 1000 mg de T ont été réalisées à 6 semaines d’intervalle puis une toutes les 10 semaines avec des ajustements de dose afin de maintenir les niveaux d’androgènes dans l’intervalle de référence normal de l’homme adulte. Après un an de traitement, ont été rapportées une augmentation de la masse musculaire (volume antérieur, postérieur et totale de la cuisse) de 15 % (p<0,0001), de la force musculaire de 12% pour l’extension genou (p=0,006) et de 25 % pour la flexion genou (p<0.0001) (47).

HEMATOLOGIQUE :
Les SAA induisent une augmentation de l’’hémoglobine et de l’hématocrite dans le sang. Différents mécanismes sont impliqués : une inhibition de la synthèse hépatique d’hepcidine induisant une augmentation de l’assimilation intestinale du fer, une stimulation
de la production rénale d’érythropoïétine (EPO) et la modification du «set point» de l’EPO (figure 4) (48,49). L’élévation de l’hématocrite (supérieur à 52%) et l’augmentation de l’activité plaquettaire secondaires à la prise exogène de SAA induisent
un état pro-thrombotique avec risque de thrombose secondaire.

EFFETS CARDIO-VASCULAIRES :
L’impact cardio-vasculaire de la consommation de SAA est encore peu connu chez la femme. Chez l’homme, l’un des principaux retentissements cardiaques est l’hypertrophie myocardique concentrique du ventricule gauche et du septum inter-ventriculaire, qui
est secondaire à l’hypertrophie des cardiomyocytes. Ces effets induisent une altération de la fonction diastolique et une baisse de la fraction d’éjection cardiaque (50,51). La consommation de SAA induit également un risque d’allongement du QRS, de
trouble du rythme cardiaque et de mort subite (52,53).
La consommation de SAA induit également une augmentation du risque d’athérosclérose. Les mécanismes impliqués sont l’élévation de la pression artérielle suite à une vasoconstriction via l‘augmentation d’expression de la thromboxane A2, et l’action de
l’endothéline-1 ainsi qu’ une activation du système rénine-angiotensine-aldostérone (7). De plus, les SAA induisent un profil lipidique athérogène, avec diminution du HDL et de l’Apo lipoprotéine A1, et augmentation du LDL-cholestérol (51,53). Garevik
et al, ont recruté 56 hommes par le biais d’une ligne téléphonique antidopage. Six mois après l’arrêt d’une prise IM d’un SAA (Nandrolone), les taux de LDL-c étaient significativement plus bas (moyenne 3,34 + /- 0,25 mmol/L vs. 2,63 +/- 0,17 mmol/L
; p=0,0061 ) et d’HDL significativement plus élevés (moyenne 0,90 mmol/L +/- 0,05 mmol/L vs. 1,13+/- 0,05 mmol/L p<0,001 ) qu’avant le sevrage (54). Il est à noter que les perturbations lipidiques étaient plus sévères lors de la consommation de
stéroïdes 17 α alkylés qu’avec les SAA injectables (7).
HEPATOTOXICITE :
La plupart des effets hépatotoxiques des SAA ont été rapportés suite à la prise per os de stéroïdes 17-α-alkylés (7). Plusieurs hypothèses physiopathologiques ont été proposées, en particulier une réponse inflammatoire médiée par les récepteurs aux androgènes,
la stimulation de l’hyperplasie hépatocytaire et la régulation à la hausse de la synthèse des acides biliaires. La péliose hépatique, la cholestase, la cytolyse, et le développement de tumeurs hépatiques bénignes (angiome hépatique) et malignes (carcinome
hépato-cellulaire) ont été associées à la prise de dérivés alkylés de la testostérone. Dans la plupart des cas, la fonction hépatique se normalise avec l’arrêt de la prise de stéroïdes mais la prise sur le long terme peut induire des conséquences
irréversibles (55).
IMPACT SUR L’OS
La T favorise la formation du périoste, la croissance de l’os radial et la densité osseuse globale. Cette action est médiée par la liaison de T à son récepteur, situé sur les cellules cibles osseuses mais aussi suite à l’aromatisation périphérique de
T en œstrogènes. La T bloque l’interaction du RANK-Ligand avec le récepteur RANK, ce qui inhibe la différenciation et l’activation des ostéoclastes et stimule les ostéoblastes (51). Chez les femmes avec un excès de stéroïdes exogènes, le retentissement
osseux dépend de l’âge lors de la prise. Chez les adolescentes, cette prise induit une accélération de la maturation osseuse avec fermeture prématurée des zones de croissance épiphysaires des os longs, et parfois un arrêt de la croissance en dessous
de la taille attendue. Chez les femmes adultes avec excès de SAA, il existe une augmentation de la masse osseuse, dont l’impact sur la prévention du risque fracturaire n’est pas démontré (51).
TROUBLES DES CYCLES
Les troubles des cycles sont très fréquents chez les athlètes féminines et diffèrent selon les disciplines sportives. Une revue de la littérature a regroupé les données issues de 48 études, et rapporté une prévalence d’aménorrhée primaire la plus élevée
en gymnastique (54%), et pour l’aménorrhée secondaire en cyclisme (56%), triathlon (40%) et gymnastique (31%) (56). Friden et al ont étudié 1086 athlètes de haut niveau, réalisant 57 sports différents. Seulement 24% des athlètes considéraient avoir
de bonnes connaissances sur les troubles menstruels et les contraceptions hormonales et plus d’un quart des femmes ont déclaré qu’elles n’avaient personne à qui parler de l’aménorrhée secondaire à l’entraînement sportif (57). Une hypothèse pour expliquer
les troubles du cycle est basée sur la présence d’un hypogonadisme hypogonadotrope fonctionnel secondaire à une balance énergétique négative. Cependant, plusieurs études ont montré que l’hyperandrogénie est une étiologie possible de troubles du cycle
chez les athlètes. Koltun et al. ont étudié 191 femmes pratiquant plus de 2 heures de sport par semaine. Parmi celles en oligo/aménorhée, 17% avaient une hyperandrogénie biologique (58). L’utilisation de SAA induit une inhibition de l’axe gonadotrope,
par inhibition de la pulsatilité de la GnRH suite au rétrocontrôle hypothalamo-hypophysaire.
Enfin, l’impact de l’utilisation de SAA sur la fertilité est peu étudié chez la femme. Chez l’homme, il a été montré que le rétablissement de la spermatogénèse et la fertilité mettent respectivement 1 à 2 ans et 1 à 3 ans après l’arrêt des SAA (59).
LA LOI ACTUELLE
Compte tenu de la prévalence élevée d’athlètes féminines ayant une hyperandrogénie endogène, plusieurs réglementations ont été mises en place afin de garantir une compétition équitable entre les athlètes. Un programme de vérification du « sexe génétique»
a été établi en 1966. Il comprenait un examen clinique, un test de détection du corpuscule de Barr, puis une détection du chromosome Y par PCR afin de dépister les femmes ayant une VDG (60). Cette pratique, considérée comme potentiellement discriminante,
a été abandonné en 1999. Le dosage de T est ensuite devenu systématique chez les femmes athlètes. Les premières réglementations concernant la concentration maximale de T autorisée ont été établies en 2011 et approuvés par le Comité International Olympique
(CIO) avant les Jeux olympiques de Londres 2012. Une athlète femme ayant une VDG était autorisée à concourir dans la catégorie féminine si elle était légalement reconnue comme une femme et si la concentration de testostérone était inférieure à 10
nmol/L (2,8 ng/ml). Il est à noter que ce taux n’était pas considéré chez les femmes ayant une insensibilité complète au récepteur des androgènes ou ayant eu une gonadectomie (39). En mai 2019, World Athletics a mis à jour sa réglementation pour l’autorisation
à concourir dans la catégorie féminine. La concentration de testostérone sérique autorisée a été abaissée de 10 à 5 nmol/L (1,4 ng/ml). Ce seuil est à maintenir les 6 mois précédents la compétition.
Une des justifications de World Athletics pour abaisser ce seuil est basé sur l’avantage en terme de performance musculaire en cas de T supérieure à 5 nmol/L. En effet, une étude a inclus 62 femmes ménopausées avec ovariectomie, ou sans (dans ce cas inclues
si FSH >30 UI/L), d’âge médian de 53 ans. Elles ont été divisées en 5 groupes en fonction du traitement par T : placebo (n=13), 3 mg/semaine (n=12), 6,25 mg/semaine (n=13), 12,5 mg/semaine (n=13) ou 25 mg/semaine (n=11). Les concentrations moyennes
de testostérone totale au nadir en cours de traitement étaient de 19, 78, 102, 128 et 210 ng/dl (0,65-2,70-3,53-4,43-7,28 nmol/L) pour les doses respectivement croissantes. Une différence significative de masse musculaire et de force musculaire ont
été mises en évidence entre les femmes du groupe placebo versus celles du groupe T 25 mg/semaine (p=0,05) (61). Le deuxième justificatif est basé sur le dosage de T sérique par LC-MS chez les femmes avec un SOPK (n=4032). La limite supérieure de
la T sérique mesurée par LC-MS dans ces 16 études était toujours inférieure à 5 nmol/L. Ainsi, un dosage de T supérieur à ce seuil est probablement dû à une tumeur surrénalienne ou ovarienne, à une VDG, à des athlètes transgenres ou à un dopage avec
prise de SAA (10). Concernant les athlètes femmes transgenres ou ayant une VDG avec un caryotype 46,XY souhaitant concourir à haut niveau, le CIO a demandé en novembre 2021 aux différentes fédérations internationales d’établir leurs propres critères
face à l’impossibilité de trancher pour tous les sports. Les disciplines ont ainsi un pouvoir de restriction et/ou d’autorisation de participation. En Mars 2023, la fédération internationale d’athlétisme (World Athletics) a modifié les règles d’admissibilité
à concourir en catégorie féminine pour les athlètes transgenres et/ou ayant une VDG. La testostéronémie, mesurée par LC-MS/MS, doit être maintenue sous le seuil de 2,5 nmol/L pendant au moins 24 mois précédents la compétition en catégorie féminine.
Le règlement s’applique désormais à toutes les disciplines et plus seulement aux courses allant du 400 m au 1.610m, comme c’était le cas depuis 2018. L’athlète VDG doit fournir une déclaration écrite et signée indiquant que son identité de genre est
féminine.
Une autre modification des règles d’admissibilité à concourir en catégorie féminine est l’exclusion des athlètes féminines transgenres ayant connu une puberté masculine des compétitions féminines internationales. L’impact d’une puberté masculine chez
les femmes transgenres ainsi que du traitement hormonal d’affirmation de genre est inconnu sur les performances sportives. Deux études ont mesuré l’impact de 2 et 4 ans de traitement hormonal d’affirmation de genre sur les performances musculaires
de 46 et 228 femmes transgenres respectivement, en comparaison aux femme cis-genre (62,63). Leurs résultats sont cependant discordants (64). World Athletics a convenu de créer un groupe de travail pendant 12 mois pour examiner plus en profondeur la
question de l’inclusion des athlètes transgenres.
CONCLUSION
La prise de SAA est associée à une croissance musculaire, une augmentation de la densité osseuse, et l’amélioration des performances musculaires secondaires. Cependant elle est potentiellement associée à de nombreux effets secondaires, comme des pathologies
hépatiques, un syndrome métabolique, une altération du métabolisme lipidique, une augmentation de la viscosité sanguine. Il existe donc sur-risque théorique d’athérosclérose et d’événements cardio-vasculaires. La prévalence de l’utilisation de stéroïdes
anabolisants-androgènes (SAA) est en augmentation depuis de nombreuses années, notamment par leur facilité d’achat. Compte tenu des impacts de la prise de stéroïdes anabolisants, de l’association à d’autres toxiques, et du développement d’addictions,
la prise de ces substances représente un problème de santé publique. Il existe un enjeu de prévention par les professionnels de santé, et également une nécessité d’accompagnement et d’aide au sevrage.
Bibliographie
- Sagoe D, Molde H, Andreassen CS, Torsheim T, Pallesen S. The global epidemiology of anabolic-androgenic steroid use: a meta-analysis and meta-regression analysis. Annals of Epidemiology. mai 2014;24(5):383‑
- Hirschberg AL. Female hyperandrogenism and elite sport. Endocrine Connections. avr 2020;9(4):R81‑
- Hirschberg AL. Female Hyperandrogenism in Elite Sports and the Athletic Triad. Semin Reprod Med. mars 2022;40(01/02):032‑
- Burger HG. ANDROGEN PRODUCTION AND MECHANISMS.
- Gashaw I, Reif S, Wiesinger H, Kaiser A, Zollmann FS, Scheerans C, et al. Novel aldo-keto reductase 1C3 inhibitor affects androgen metabolism but not ovarian function in healthy women: a phase 1 study. European Journal of Endocrinology. 20 juill 2023;189(1):15‑
- Järvinen E, Kidron H, Finel M. Human efflux transport of testosterone, epitestosterone and other androgen glucuronides. The Journal of Steroid Biochemistry and Molecular Biology. mars 2020;197:105518.
- Bond P, Smit DL, De Ronde W. Anabolic–androgenic steroids: How do they work and what are the risks? Front Endocrinol. 19 déc 2022;13:1059473.
- Chouinard S, Yueh MF, Tukey RH, Giton F, Fiet J, Pelletier G, et al. Inactivation by UDP-glucuronosyltransferase enzymes: The end of androgen signaling. The Journal of Steroid Biochemistry and Molecular Biology. avr 2008;109(3‑5):247‑
- Strahm E, Mullen JE, Gårevik N, Ericsson M, Schulze JJ, Rane A, et al. Dose-dependent testosterone sensitivity of the steroidal passport and GC-C-IRMS analysis in relation to the UGT2B17 deletion polymorphism: Testosterone sensitivity of the steroidal
passport and IRMS. Drug Test Analysis. déc 2015;7(11‑12):1063‑ - Handelsman DJ, Hirschberg AL, Bermon S. Circulating Testosterone as the Hormonal Basis of Sex Differences in Athletic Performance. Endocrine Reviews. 1 oct 2018;39(5):803‑
- Stener-Victorin E, Deng Q. Epigenetic inheritance of polycystic ovary syndrome — challenges and opportunities for treatment. Nat Rev Endocrinol. sept 2021;17(9):521‑
- Teede HJ. Recommendations from the 2023 international evidence-based guideline for the assessment and management of polycystic ovary syndrome. European Journal of Endocrinology. 2023;189(2).
- Alexiou E, Hatziagelaki E, Pergialiotis V, Chrelias C, Kassanos D, Siristatidis C, et al. Hyperandrogenemia in women with polycystic ovary syndrome: prevalence, characteristics and association with body mass index. Hormone Molecular Biology and Clinical
Investigation. 1 janv 2017 - El-Maouche D, Arlt W, Merke DP. Congenital adrenal hyperplasia. The Lancet. nov 2017;390(10108):2194‑
- Bidet M, Bellanné-Chantelot C, Galand-Portier MB, Tardy V, Billaud L, Laborde K, et al. Clinical and Molecular Characterization of a Cohort of 161 Unrelated Women with Nonclassical Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency and
330 Family Members. The Journal of Clinical Endocrinology & Metabolism. mai 2009;94(5):1570‑ - Fénichel P, Paris F, Philibert P, Hiéronimus S, Gaspari L, Kurzenne JY, et al. Molecular Diagnosis of 5α-Reductase Deficiency in 4 Elite Young Female Athletes Through Hormonal Screening for Hyperandrogenism. The Journal of Clinical Endocrinology &
Metabolism. 1 juin 2013;98(6):E1055‑ - Hughes IA, Davies JD, Bunch TI, Pasterski V, Mastroyannopoulou K, MacDougall J. Androgen insensitivity syndrome. The Lancet. oct 2012;380(9851):1419‑
- Gottlieb B, Trifiro MA. Androgen Insensitivity Syndrome.
- Melo KFS, Mendonca BB, Billerbeck AEC, Costa EMF, Inácio M, Silva FAQ, et al. Clinical, Hormonal, Behavioral, and Genetic Characteristics of Androgen Insensitivity Syndrome in a Brazilian Cohort: Five Novel Mutations in the Androgen Receptor Gene.
The Journal of Clinical Endocrinology & Metabolism. juill 2003;88(7):3241‑ - Hagmar M, Berglund B, Brismar K, Hirschberg AL. Hyperandrogenism May Explain Reproductive Dysfunction in Olympic Athletes. Medicine & Science in Sports & Exercise. juin 2009;41(6):1241‑
- Bermon S, Garnier PY, Hirschberg AL, Robinson N, Giraud S, Nicoli R, et al. Serum Androgen Levels in Elite Female Athletes. The Journal of Clinical Endocrinology & Metabolism. 1 nov 2014;99(11):4328‑
- Sorensen EA. Debunking the Myth of Pregnancy Doping. Journal of Intercollegiate Sport. déc 2009;2(2):269‑
- Kanayama G, Hudson JI, Pope HG. Illicit anabolic–androgenic steroid use. Hormones and Behavior. juin 2010;58(1):111‑
- De Mondenard JP. Historique et évolution du dopage. Ann Toxicol Anal. 2000;12(1):5‑
- Bermon S. Androgens and athletic performance of elite female athletes: Current Opinion in Endocrinology & Diabetes and Obesity. juin 2017;24(3):246‑
- Franke WW, Berendonk B. Hormonal doping and androgenization of athletes: a secret program of the German Democratic Republic government. Clinical Chemistry. 1 juill 1997;43(7):1262‑
- Pope HG, Kanayama G, Athey A, Ryan E, Hudson JI, Baggish A. The lifetime prevalence of anabolic-androgenic steroid use and dependence in Americans: Current best estimates: Prevalence of Anabolic-Androgenic Steroid Use. Am J Addict. juill 2014;23(4):371‑
- Nieschlag E, Vorona E. MECHANISMS IN ENDOCRINOLOGY: Medical consequences of doping with anabolic androgenic steroids: effects on reproductive functions. European Journal of Endocrinology. août 2015;173(2):R47‑
- Duclos M. Les effets du dopage sur la fonction de reproduction. Science & Sports. oct 2005;20(5‑6):247‑
- Brennan BP, Kanayama G, Pope HG. Performance-Enhancing Drugs on the Web: A Growing Public-Health Issue: Performance-Enhancing Drugs. Am J Addict. mars 2013;22(2):158‑
- Les défis du passeport biologique: du prélèvement à l’interprétation. SSEM [Internet]. 2016 64(3). Disponible sur: https://ssem-journal.ch/4482
- WADA, Reporting and evaluation Guidance for testosterone, epitestosterone, T/E ratio and other endogenous steroids, Technical document; 2004.
- Schulze J, Suominen T, Bergström H, Ericsson M, Björkhem Bergman L, Ekström L. Urinary steroid profile in relation to the menstrual cycle. Drug Test Anal. mars 2021;13(3):550‑
- Mullen J, Gadot Y, Eklund E, Andersson A, J. Schulze J, Ericsson M, et al. Pregnancy greatly affects the steroidal module of the Athlete Biological Passport. Drug Test Anal. juill 2018;10(7):1070‑
- Ekström L, Knutsson JE, Mullen J, Ericsson M, Hirschberg AL. Impact of hormonal contraceptives on urinary steroid profile in relation to serum hormone changes and CYP17A1 polymorphism. Drug Test Anal. sept 2019;11(9):1284‑
- Mullen J, Bækken LV, Törmäkangas T, Ekström L, Ericsson M, Hullstein IR, et al. Inter‐individual variation of the urinary steroid profiles in Swedish and Norwegian athletes. Drug Test Anal. juin 2020;12(6):720‑
- Elings Knutsson J, Andersson A, Baekken LV, Pohanka A, Ekström L, Hirschberg AL. Disposition of Urinary and Serum Steroid Metabolites in Response to Testosterone Administration in Healthy Women. The Journal of Clinical Endocrinology & Metabolism.
8 mars 2021;106(3):697‑ - Ekström L, Knutsson JE, Stephanou C, Hirschberg AL. Klotho Polymorphism in Association With Serum Testosterone and Knee Strength in Women After Testosterone Administration. Front Physiol. 3 mai 2022;13:844133.
- Huang G, Basaria S. Do anabolic-androgenic steroids have performance-enhancing effects in female athletes? Molecular and Cellular Endocrinology. mars 2018;464:56‑
- Handelsman DJ. Androgen Misuse and Abuse. Endocrine Reviews. 16 juill 2021;42(4):457‑
- Smit DL, Buijs MM, Hon O, Heijer M, Ronde W. Positive and negative side effects of androgen abuse. The HAARLEM study: A one‐year prospective cohort study in 100 men. Scand J Med Sci Sports. févr 2021;31(2):427‑
- Herbst KL, Bhasin S. Testosterone action on skeletal muscle: Current Opinion in Clinical Nutrition and Metabolic Care. mai 2004;7(3):271‑
- Mänttäri S, Anttila K, Järvilehto M. Testosterone stimulates myoglobin expression in different muscles of the mouse. J Comp Physiol B. sept 2008;178(7):899‑
- Rickenlund A, Carlström K, Ekblom B jörn, Brismar TB, von Schoultz B o, Lindén Hirschberg A. Hyperandrogenicity is an alternative mechanism underlying oligomenorrhea or amenorrhea in female athletes and may improve physical performance. Fertility
and Sterility. avr 2003;79(4):947‑ - Kogure GS, Silva RC, Picchi Ramos FK, Miranda-Furtado CL, Lara LA da S, Ferriani RA, et al. Women with polycystic ovary syndrome have greater muscle strength irrespective of body composition. Gynecological Endocrinology. 4 mars 2015;31(3):237‑
- Hirschberg AL, Elings Knutsson J, Helge T, Godhe M, Ekblom M, Bermon S, et al. Effects of moderately increased testosterone concentration on physical performance in young women: a double blind, randomised, placebo controlled study. Br J Sports Med.
mai 2020;54(10):599‑ - Wiik A, Lundberg TR, Rullman E, Andersson DP, Holmberg M, Mandić M, et al. Muscle Strength, Size, and Composition Following 12 Months of Gender-affirming Treatment in Transgender Individuals. The Journal of Clinical Endocrinology & Metabolism.
1 mars 2020;105(3):e805‑ - Kuhn MW, Bilz S, Brndle M. La polyglobulie en cas d’abus de stéroïdes androgènes anabolisants. Swiss Med Forum [Internet]. 25 sept 2019. https://doi.emh.ch/fms.2019.08264
- Bachman E, Travison TG, Basaria S, Davda MN, Guo W, Li M, et al. Testosterone Induces Erythrocytosis via Increased Erythropoietin and Suppressed Hepcidin: Evidence for a New Erythropoietin/Hemoglobin Set Point. The Journals of Gerontology Series A:
Biological Sciences and Medical Sciences. 1 juin 2014;69(6):725‑ - Luijkx T, Velthuis BK, Backx FJG, Buckens CFM, Prakken NHJ, Rienks R, et al. Anabolic androgenic steroid use is associated with ventricular dysfunction on cardiac MRI in strength trained athletes. International Journal of Cardiology. août 2013;167(3):664‑
- Nieschlag E, Vorona E. Doping with anabolic androgenic steroids (AAS): Adverse effects on non-reproductive organs and functions. Rev Endocr Metab Disord. sept 2015;16(3):199‑
- Liu JD, Wu YQ. Anabolic-androgenic steroids and cardiovascular risk. Chinese Medical Journal. 20 sept 2019;132(18):2229‑
- Perry JC, Schuetz TM, Memon MD, Faiz S, Cancarevic I. Anabolic Steroids and Cardiovascular Outcomes: The Controversy. 2020;
- Gårevik N, Strahm E, Garle M, Lundmark J, Ståhle L, Ekström L, et al. Long term perturbation of endocrine parameters and cholesterol metabolism after discontinued abuse of anabolic androgenic steroids. The Journal of Steroid Biochemistry and Molecular
Biology. nov 2011;127(3‑5):295‑ - Petrovic A, Vukadin S, Sikora R, Bojanic K, Smolic R, Plavec D, et al. Anabolic androgenic steroid-induced liver injury: An update. WJG. 14 juill 2022;28(26):3071‑
- Gimunová M, Paulínyová A, Bernaciková M, Paludo AC. The Prevalence of Menstrual Cycle Disorders in Female Athletes from Different Sports Disciplines: A Rapid Review. IJERPH. 31 oct 2022;19(21):14243.
- von Rosen P, Ekenros L, Solli GS, Sandbakk Ø, Holmberg HC, Hirschberg AL, et al. Offered Support and Knowledge about the Menstrual Cycle in the Athletic Community: A Cross-Sectional Study of 1086 Female Athletes. IJERPH. 21 sept 2022;19(19):11932.
- Koltun KJ, Williams NI, Scheid JL, De Souza MJ. Discriminating hypothalamic oligomenorrhea/amenorrhea from hyperandrogenic oligomenorrhea/amenorrhea in exercising women. Appl Physiol Nutr Metab. juill 2020;45(7):707‑
- Anawalt BD. Male Fertility After Androgenic Steroid Use: How Little We Know. The Journal of Clinical Endocrinology & Metabolism. 16 juin 2021;106(7):e2813‑
- Elsas LJ, Ljungqvist A, Ferguson-Smith MA, Simpson JL, Genel M, Carlson AS, et al. Gender verification of female athletes. Genetics in Medicine. juill 2000;2(4):249‑
- Huang G, Basaria S, Travison TG, Ho MH, Davda M, Mazer NA, et al. Testosterone dose-response relationships in hysterectomized women with or without oophorectomy: effects on sexual function, body composition, muscle performance and physical function
in a randomized trial. Menopause. juin 2014;21(6):612‑ - Roberts TA, Smalley J, Ahrendt D. Effect of gender affirming hormones on athletic performance in transwomen and transmen: implications for sporting organisations and legislators. Br J Sports Med. juin 2021;55(11):577‑
- Chiccarelli E, Aden J, Ahrendt D, Smalley J. Fit Transitioning: When Can Transgender Airmen Fitness Test in Their Affirmed Gender? Military Medicine. 22 juill 2023;188(7‑8):e1588‑
- Cheung AS, Zwickl S, Miller K, Nolan BJ, Wong AFQ, Jones P, et al. The Impact of Gender-Affirming Hormone Therapy on Physical Performance. The Journal of Clinical Endocrinology & Metabolism. 13 juill 2023;dgad414.
