MUST 2023 – Synthèse et actualités sur la prise en charge des cancers thyroïdiens différenciés en 2023
Perrine Raymond (1), Marc Klein (1), Françoise Borson-Chazot (2)
(1) Service d’Endocrinologie, CHRU de Brabois, Rue du Morvan, 54500 Vandoeuvre les Nancy (2) Fédération d’Endocrinologie, Hospices Civils de Lyon, Hôpital Louis Pradel, 69500 Bron
Contact : Perrine RAYMOND, Service d’Endocrinologie, CHRU de Brabois, Rue du Morvan, Vandoeuvre Les Nancy, p.raymond@chru-nancy.fr
Cet article a bénéficié du soutien institutionnel d’Ipsen Pharma, le 1er auteur ayant été un participant des Must de L’endocrinologie 2023.
Points forts :
- Surveillance active des microcarcinomes papillaires
- Place de l’isthmo lobectomie dans la prise en charge chirurgicale des cancers de bon pronostic
- Désescalade thérapeutique pour l’iode 131 en fonction du risque de rechute
- Thérapies ciblées pour les cancers avancés/iodoréfractaires
- Place de la biologie moléculaire à la recherche d’une mutation ciblable
Résumé :
L’augmentation de l’incidence des cancers thyroïdiens différenciés, multipliée par 6 en 30 ans dans les pays industrialisés est principalement attribuée à un effet détection. Dans le même temps, il a été rapporté, outre l’excellent pronostic des formes
à bas risque, une probabilité de survie, améliorée dans les formes métastatiques, probablement en raison des progrès accomplis ces dernières années dans le traitement des formes agressives pour lesquelles on dispose maintenant d’un important arsenal
thérapeutique. La prise en charge des cancers thyroïdiens différenciés constitue, aujourd’hui, un paradigme de la précision en oncologie conduisant à une stratégie thérapeutique personnalisée et adaptée au niveau de risque du cancer. Ceci conduit
à une désescalade thérapeutique dans les formes de bon pronostic alors que les traitements ciblés prennent une place de plus en plus importante dans la prise en charge des cancers iodoréfractaires ou avancés. Si les endocrinologues n’auront pas toujours
l’opportunité de les prescrire, ils seront amenés à accompagner et suivre les patients au décours du traitement.
Cette synthèse vise à donner une vision globale des options thérapeutiques envisageables en 2023 face à un cancer thyroïdien différencié de la thyroïde.
Points clés :
Cancer thyroïdien différenciés ; Surveillance des microcarcinome papillaire ; Loboisthmectomie dans les bons pronostics ; Irathérapie en fonction du risque de rechute ; Arsenal thérapeutique varié pour les cancers avancés
Abréviations : AMM: Autorisation de Mise sur le Marché ATA : American Thyroid Association ETA: European Thyroid Association MAPK : Mitogen-activated protein kinases rhTSH : Recombinant human Thyrotropin SFE: Société Française d’Endocrinologie VEGF-R:
Vascular Endothelial Growth Factor Receptors WHO : World Health Organization
I. Introduction :
Les cancers thyroïdiens différenciés sont les tumeurs endocrines les plus fréquentes avec une incidence en très nette augmentation depuis une trentaine d’années (1–3), notamment chez la femme, sans augmentation de la mortalité, attribuée, principalement,
à un effet détection, comme cela a été bien montré lors de la mise en place d’un dépistage systématisé en Corée (4). Si le pronostic des cancers thyroïdiens différenciés est globalement excellent (3,4), celui des formes avancées reste sombre (5) malgré
le vaste arsenal thérapeutique en notre possession à ce jour. Cependant, une étude récente Chinoise (6) a montré que la probabilité de survie, dans les stades métastatiques était meilleure en termes de temps passé avec la maladie. Dans ce contexte,
on assiste d’une part à une désescalade thérapeutique pour les formes de bon pronostic qui sont majoritaires (7,8) et d’autre part au développement d’un arsenal thérapeutique qui ne cesse de s’enrichir pour les stades avancés avec de nombreuses possibilités
: traitement locaux, thérapies ciblant le VEGF-R, traitant ciblant spécifiquement des mutations de la voie des MAPK des réarrangements ou fusions de gènes, voire immunothérapie (9). Ainsi, le cancer thyroïdien aujourd’hui semble être le paradigme
de l’oncologie de précision avec la possibilité de proposer un traitement individualisé, en fonction du stade de la maladie. Cette proposition de traitement individualisé s’appuie notamment sur la notion de stadification du risque de rechute, proposée
par l’ATA en 2015 (10) et reprise dans l’ETA 2022 (11), comportant 3 groupes de risques (Figure 1) et permettant ainsi de prédire le risque de rechute et d’évaluer les possibilités thérapeutiques et l’indication notamment d’un traitement complémentaire
par l’Iode131, après chirurgie. Cette stadification du risque se base essentiellement sur des critères histopathologiques de la classification de la WHO 2022 (12), révisée cette année, prenant en compte le potentiel de malignité et intégrant la biologie
moléculaire.
Le but de cet article est de proposer une courte synthèse des avancées les plus significatives des dernières années concernant la prise en charge des cancers thyroïdiens différenciés et de présenter les thérapeutiques disponibles à ce jour et leurs indications
en fonction des caractéristiques cliniques, anatomo-pathologiques et évolutives.
II. Traitements des formes localisées :
II.1. Vers une surveillance active des microcarcinomes papillaires
Les microcarcinomes papillaires correspondent à des tumeurs dont le diamètre est < 1 cm. Les Japonais ont été les premiers à proposer, depuis une trentaine d’années maintenant, une simple surveillance active en raison de leur très faible potentiel
évolutif, notamment en cas de microcarcinome papillaire sans adénopathie, ni extension extra thyroïdienne ou, bien sûr, métastatique à distance (pT1aN0M0) (13). L’ATA s’est prononcée en 2016 (10) pour une surveillance active des microcarcinomes papillaires,
au cas par cas. Récemment, une étude rétrospective japonaise (14) portant sur 5646 patients présentant un microcarcinome papillaire et suivi pendant 20 ans, n’a pas montré de différence significative entre le groupe surveillance active et le groupe
chirurgie immédiate en terme de majoration en taille du carcinome ou en terme d’apparition de métastase ganglionnaire cervicale notamment, confirmant dans une large cohorte, la possibilité d’une surveillance active (clinique, biologique et morphologique)
du microcarcinome papillaire. Une autre étude japonaise (15) a également montré que la réalisation d’une chirurgie secondaire en cas de progression du microcancer lors de la surveillance active n’entrainait pas d’augmentation de la morbidité par rapport
aux patients ayant bénéficié d’une chirurgie immédiate. Une prise en charge chirurgicale plus tardive n’entraine donc pas de perte de chances chez les patients qui progressent au cours du suivi. En dehors des critères tumoraux, certains critères cliniques
propres au patient doivent également être pris en considération avant de proposer une surveillance active. Notamment, le critère âge du patient au diagnostic a été retenu comme un facteur important à considérer, la croissance des cancers micropapillaires
étant plus souvent observée chez les sujets jeunes. Les seuils proposés diffèrent selon les études (16–19), mais c’est le seuil de 45 ans qui a été retenu par la société française d’Endocrinologie dans leur récent consensus sur la prise en charge
des nodules thyroïdiens (17). Afin d’aider à la décision, une checklist récemment publiée (16) détaille les critères tumoraux et cliniques propres au patient, et les prérequis en termes d’équipe médicale permettant d’envisager une surveillance active
dans des conditions de sécurité optimale.
II.2. Prise en charge chirurgicale : place de la lobo isthmectomie
En dehors de ces formes de microcarcinomes papillaires à faible risque, le traitement radical de première intention du cancer thyroïdien reste la chirurgie quand celle-ci est possible, dans le but de retirer la tumeur, de l’analyser d’un point de vue
histopathologique pour ensuite pouvoir la classifier en fonction du risque de rechute (10) et proposer un traitement complémentaire adéquate si nécessaire. Si la thyroïdectomie totale était de mise il y a quelques années pour tout cancer thyroïdien,
la place de l’isthmo lobectomie est de plus en plus importante. Elle était uniquement recommandée pour les microcarcinome unifocaux, intrathyroïdiens de faible risque par les recommandations de l’ATA en 2009 (20) mais ses indications se sont étendues
dans les recommandations de l’ATA 2015 (10) aux cancers mesurant moins de 4 cm de diamètre sans adénopathie ni signe d’extension extra-thyroïdienne. Un travail rétrospectif récent n’a d’ailleurs pas retrouvé de différence en termes de survie à long
terme de cancers à faible risque suivant l’étendue du geste chirurgical (21). Les recommandations récentes de la SFE sur les nodules thyroïdiens font aussi une large place à la lobectomie en dehors de la présence de nodules controlatéraux, de cancers
thyroïdiens prouvés cytologiquement et mesurant plus de 2cm de diamètre ou lorsqu’il existe des adénopathies et pourra s’accompagner dans certains cas d’un curage ganglionnaire prophylactique ou thérapeutique (17). La nécessité de pouvoir disposer
d’une échographie préopératoire réalisée par un médecin expert est, par ailleurs, soulignée comme essentielle pour préciser l’étendue du geste.
II.3. L’Irathérapie : vers une désescalade thérapeutique pour les formes de bons pronostic
Le traitement par l’iode131 fête cette année son centième anniversaire (22). Il est proposé après la chirurgie des cancers thyroïdiens différenciés pour diminuer le risque de récidive, augmenter la survie sans progression et améliorer la survie spécifique
de la maladie (10). Alors qu’une irathérapie était recommandée pour tous les cancers thyroïdiens (en dehors des microcancers papillaires) dans les années 2000 (20), on assiste depuis une dizaine d’années à une désescalade thérapeutique (10,11), et
l’irathérapie est maintenant réalisé en fonction du risque de rechute, selon les 3 groupes de risque repris par l’ATA 2015 (Figure 1),
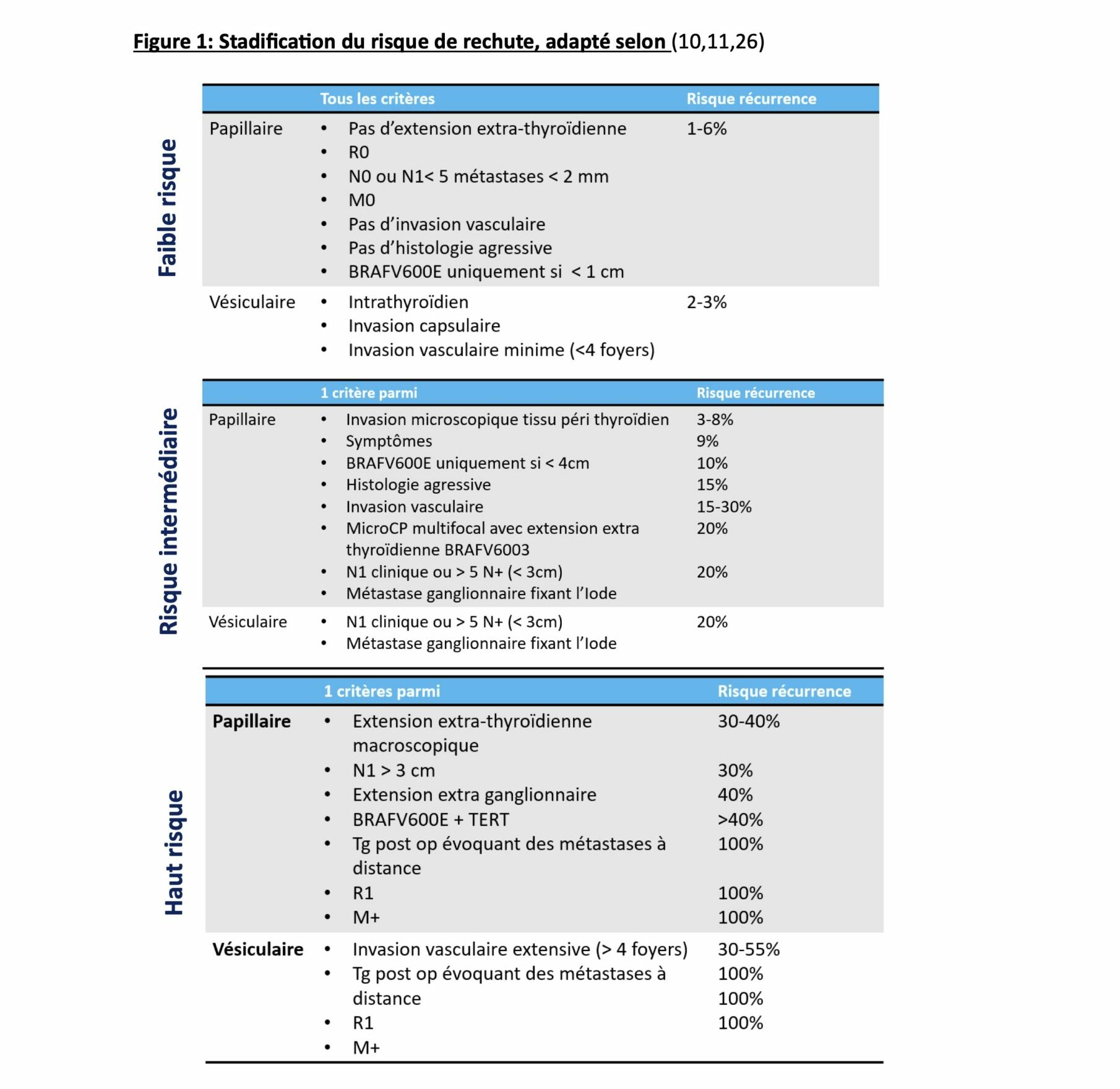
Risque faible : Dans ce groupe, le risque de rechute est faible (23) et les études n’ont pas montré de bénéfice du traitement en termes de récurrence et de mortalité (24). Plus récemment, le résultat des différentes études a été conforté par l’étude ESTIMABL-2
(7) qui n’a pas retrouvé de différence entre le groupe chirurgie seule et le groupe chirurgie complétée par de l’iode 131, en termes de récurrence à 3 ans, chez 729 patients présentant des cancers thyroïdiens de faible risque, mesurant entre 10 et
20 mm (pT1m, N0, M0). Il est prévu de prolonger le suivi de cette étude pour obtenir des résultats à 10 ans afin de vérifier l’absence de récidive tardive dans le groupe sans iode radioactif. De ce fait, dans le groupe à faible risque de rechute,
l’iode 131 n’est plus recommandé de manière systématique. Si une irathérapie doit être réalisée, une faible dose d’iode sera recommandée (25). Risque élevé de rechute : Bien que ce groupe à haut risque ne représente que 5-10% des cancers thyroïdiens
différenciés (11), le risque de rechute reste élevé >20%. Dans cette situation l’iode radioactif a démontré un impact significatif sur le risque de rechute et la survie. Ainsi une irathérapie complémentaire est recommandée, à la dose de 100 mCi
(26,27) sous rhTSH (THYROGEN) ou en sevrage dans les formes métastatiques, la rhTSH n’ayant été évalué dans cette indication que dans des études rétrospectives (11,28). Risque intermédiaire : Dans le groupe à risque intermédiaire, les recommandations
ne sont pas aussi claires, et l’irathérapie en complément de la chirurgie doit être discutée au cas par cas, en fonction des facteurs de risques (11). En effet, il existe notamment un sous-groupe à risque faible dans ce risque intermédiaire, décrit
par l’équipe de S. Bardet en 2015 (29) avec notamment une taille de ganglions pathologiques < 1cm et une absence d’extension extracapsulaire qui montrait une différence significative en terme de récurrence de la maladie par rapport aux formes avec
ganglions pathologiques > 1cm. Dans ce sous-groupe, un traitement complémentaire par l’iode radioactif pourrait ne pas être nécessaire et une étude de phase III est actuellement ouverte (protocole INTERMEDIATE) visant à étudier l’impact d’une irathérapie
systématique versus un traitement guidé par une scintigraphie diagnostique notamment. Par ailleurs, pour certaines formes à risque plus important de récurrence, notamment les sous types histologiques agressifs, ou les métastases ganglionnaires macroscopiques,
plusieurs études suggèrent que l’iode 131 en complément de la chirurgie pourrait avoir un bénéfice en termes de survie (30–32).
III. Traitements des formes avancées/iodorefractaires
Malheureusement, 5-15% des cancers thyroïdiens différenciés vont évoluer sur un mode défavorable et devenir métastatique, le plus fréquemment aux poumons et à l’os. Il a été montré que 2/3 des cancers métastatiques devenaient réfractaires à l’iode131,
en particulier dans les formes moins bien différenciées, en cas de métastases volumineuses, et chez des patients plus âgés (>40 ans)(33,34).
III.1. Définitions des cancers iodorefractaires/ formes avancées
La définition du cancer thyroïdien iodoréfractaire, habituellement retenue même si elle n’est pas totalement consensuelle intègre 4 critères (10) : -Pas de fixation de l’iode 131 des sites métastatiques au diagnostic initial ou en cours de traitement
ou -Présence d’au moins 1 lésion métastatique ne fixant par l’iode ou -Progression tumorale 12-16 mois après l’iode 131 malgré une fixation initiale ou -Dose cumulée de 600 mCi sans signe de rémission
Le cancer dit « avancé » également appelé « agressif » est quant à lui une entité distincte qui va regrouper plusieurs critères (9) : -Critère chirurgical : si la maladie est non résécable d’emblée -Critère histopathologique : si le type histologique
est agressif -Critères biologiques : si la concentration de thyroglobuline fait évoquer une progression métastatique, ou que le cancer est devenu iodorefractaire -Critères morphologiques : si la maladie devient métastatique ou localement avancée -Critère
clinique : si la maladie devient cliniquement parlante avec des risques de complications Chez les patients présentant un cancer iodoréfractaire, l’enjeu thérapeutique est de taille puisque le pronostic de la maladie est nettement moins bon avec une
survie à 10 ans de 30% (34). Ainsi, la prise en charge de la maladie à ce stade va surtout dépendre du tableau clinique et différentes options sont envisageables (Figure 2).

III.2. Possibilité d’une simple surveillance
Un grand nombre de patients iodoréfractaires sont soit asymptomatiques, soit ont un volume tumoral faible, soit une maladie lentement progressive. Dans ce cadre-là, une simple surveillance clinique, biologique et morphologique tous les 3-4 mois peut être
proposée (35).
III.3. Traitements locaux pour les formes symptomatiques ou à risque de complications
En cas d’oligoprogression, de maladie lentement évolutive, de risque de complication (osseuse notamment), un traitement local peut être proposé comme de la chirurgie en cas de récidive locorégionale, associée à de la radiothérapie dans certains cas (36).
Une nouvelle technique par électrochimiothérapie semble prometteuse. Dans une étude menée à Paris (37) chez 40 patients dont 15 présentant des cancers thyroïdiens métastatiques osseux, avec épidurite résistante à la radiothérapie conventionnelle,
la réponse au traitement était très encourageante avec plus de 30% de réponses complètes et 38% de réponses partielles à 3 mois. Des études avec un suivi au plus long terme seront cependant nécessaires pour appuyer ces données.
III.4. L’utilisation des thérapies ciblées dans les formes avancées : place des anti VEGF-R
Les thérapies ciblées vont être proposées en cas de maladie rapidement évolutive, de maladie symptomatique ou avec risque de complications (10), et l’arsenal thérapeutique est à ce jour assez vaste et résumé dans la figure 3.

Les traitements de première et deuxième ligne ayant obtenu l’Autorisation de Mise sur le Marché (AMM) sont des inhibiteurs des tyrosine kinase ciblant le VEGF-R (voie de l’angiogenèse) grâce à 2 études de phase III, DECISION conduite en 2011 pour le sorafenib
(38), SELECT en 2015 pour le Lenvatinib et rapportant une médiane de survie sans progression de 18,3 mois dans le groupe lenvatinib vers 3,6 mois dans le groupe placebo et une réponse objective au traitement de 64,8% sous lenvatinib (39). Le cabozantinib
quant à lui a récemment obtenu une AMM en deuxième ligne grâce aux résultats de l’étude COSMIC 311 (40) avec une réponse objective au traitement de 11% et une médiane de PFS de 11 mois vs 1,9 mois. La réponse à ces deux thérapeutiques est reprise
dans la Figure 4. Il est important de préciser que dans toutes ces études, il n’a pas été démontré d’amélioration de la survie.

Les effets secondaires des anti VEGF-R sont multiples, cardiovasculaires essentiellement avec hypertension artérielle dans 67,8% protéinurie dans 31%, digestifs avec nausées dans 41% et général avec asthénie dans 59%, et sont le plus souvent de grade
3 (41,42) . Les principaux effets secondaires sont résumés dans la Figure 5.

Afin de parvenir à éviter voir à gérer au mieux ces toxicités connues, la notion de préhabilitation a été publié (43) pour les cancers thyroïdiens afin de préparer les patients avant l’instauration d’une thérapie ciblée : préparation physique, nutritionnel
et psychique, qui permettra ainsi une meilleure tolérance et observance du traitement. Un site pour la gestion des toxicités est également à disposition et en accès gratuit sur internet (Société Française de Pharmacie Oncologique) et met à disposition
des fiches patients et praticiens pour la gestion des toxicités.
III.5. L’utilisation de thérapies ciblant des mutations somatiques
Une autre possibilité thérapeutique est l’utilisation de thérapie ciblant des mutations. Plus de 50% des formes avancées/iodorefractaires vont avoir des mutations ciblables identifiables (44), il est donc ainsi primordial de rechercher une altération
moléculaire dès le diagnostic de cancer iodoréfractaire ou avancé, comme le souligne ce travail du réseau TUTHYREF (45). Les publications ayant étudié les anomalies génétiques somatiques des cancers thyroïdiens, ont montré que la mutation BRAF-V600E
était la plus fréquente dans les cancers papillaires, suivi par les mutations des gènes RAS dans les cancers vésiculaires et les mutations du promoteur de TERT (46,47). D’autres altérations moléculaires existent comme les fusions de NTRK, RET, mais
aussi des mutations de PTEN, DICER1 dans les formes syndromiques pédiatriques par exemple. Des profils tumoraux ayant des caractéristiques histopathologiques particulières ont été associés à certaines mutations (46), et reprises dans la cinquième
édition de la WHO 2022 (12). Ainsi, les tumeurs appelées « BRAF like » sont les tumeurs essentiellement papillaires, chez lesquelles la mutation BRAFV600-E, entraine une suractivation de la voie des MAPK entrainant ainsi une diminution expression
des gènes de différenciation thyroïdiens et en particulier du NIS (Symporteur de l’iodure). De ce fait, les tumeurs BRAF mutée vont être moins différenciées et plus agressives que les tumeurs « RAS like » (46). De ce concept est née la notion de redifférenciation.
Le principe est d’utiliser des thérapies ciblant la mutation BRAF V600E pour obtenir une re expression du symporteur de l’iodure (NIS) et permettre une recaptation de l’iode dans les cancers iodorefractaires. Une récente étude du Pr Leboulleux (48)
portant sur des cancers papillaires mutés BRAFV600-E a montré une efficacité d’une association anti-BRAF anti-MEK (dabrafenib et trametinib) donné pendant 42 jours sur la recaptation de l’iode (95% de recaptation) et une stabilisation de la maladie
à 6 mois dans plus de 50% des cas et 38% de réponse partielle avec une survie sans progression à 12 mois de 82%.
III.6. Place de l’immunothérapie
Enfin l’immunothérapie semble être une possibilité thérapeutique dans le traitement des cancers thyroïdiens avancés mais n’a malheureusement pas, pour le moment montré de résultats très probants, que ce soit en association au lenvatinib en première ligne
ou après progression avec ce dernier (49). Les études disponibles à ce jour ont été réalisé sur des petits effectifs, avec des réponses partielles de l’ordre de 60% et des médianes de survie sans progression identiques au lenvatinib de l’ordre de
12,6 mois, avec des effets secondaires de grade 3 et 4 plus importants (50). Nous attendons ainsi les résultats de l’étude REGOMUNE, étude de phase 1-2 visant à évaluer l’association d’une immunothérapie (avélumab) à un anti VEGF-R (regorafenib) chez
des patients présentant des tumeurs solides (dont les cancers thyroïdiens).
IV. Conclusions et perspectives
La prise en charge du cancer thyroïdien différencié a bien évolué depuis une vingtaine d’année faisant place à un arsenal thérapeutique vaste et une prise en charge individualisée. La stadification du risque de rechute permet ainsi de proposer un traitement
adéquat à chacun, et de laisser place à une désescalade thérapeutique. Il est aujourd’hui possible de réaliser une simple surveillance active des microcarcinomes papillaires de faible risque, de réaliser une simple lobo isthmectomie pour des lésions
de moins de 4 cm (en l’absence d’adénopathie cervicale pathologique et de nodule controlatéral), et de proposer de l’irathérapie au cas par cas. Pour les cancers avancés, regroupant les cancers iodorefractaires, la prise en charge thérapeutique va
dépendre du tableau clinique de la maladie. On pourra proposer différentes options thérapeutiques comme une simple surveillance clinique, biologique et morphologique dans les formes peu agressives et non symptomatiques, un traitement local en cas
de maladie symptomatique avec risque de complication notamment osseuse, et l’utilisation de thérapies ciblées en cas de progression rapide ou de pathologie cliniquement parlante. La recherche d’altérations moléculaires est à ce jour primordiale et
doit être réalisée en routine dès lors du diagnostic de cancer avancé/métastatique/iodoréfractaire afin de proposer une thérapie spécifique qui pourra donner lieu à une redifferenciation notamment dans les cancers papillaires mutés BRAFV600-E.
L’arsenal thérapeutique va probablement s’agrandir au fil du temps de par notamment l’échappement de certaines tumeurs aux thérapies ciblées usuelles, en lien avec l’apparition de mécanismes de résistances en partie expliqués par de nouvelles altérations
moléculaires arrivant au cours de la progression de la maladie (51), et qui nécessitera la réalisation d’une nouvelle biopsie tumorale ou liquidienne, afin de mettre en évidence de nouvelles mutations ciblables. L’étude du microenvironnement et notamment
des cellules immunitaires pourrait également être une piste en vue d’une meilleure réponse à l’immunothérapie avec notamment plusieurs études sur modèles murins mais également chez l’homme montrant un rôle probable protecteur d’une thyroïdite auto
immune existante sur l’apparition d’un cancer thyroïdien papillaire (52,53). Enfin de nouvelles possibilités de redifferenciation via l’apport notamment de symporteur d’iode de manière exogène en utilisant par exemple des ARN messager pourront être
une nouvelle forme de traitement pour les formes avancées (54,55).
Remerciements au Pr Françoise Borson-Chazot pour son aide dans la rédaction et la relecture de ce travail.
Références :
- Vaccarella S, Franceschi S, Bray F, Wild CP, Plummer M, Dal Maso L. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis. N Engl J Med. 18 août 2016;375(7):614‑
- Li M, Delafosse P, Meheus F, Borson-Chazot F, Lifante JC, Simon R, et al. Temporal and geographical variations of thyroid cancer incidence and mortality in France during 1986–2015: The impact of overdiagnosis. Cancer Epidemiol. 1 déc 2021;75:102051.
- Colonna M, Borson-Chazot F, Delafosse P, Schvartz C, Guizard AV. Progression of incidence and estimate of net survival from papillary thyroid cancers diagnosed between 2008 and 2016 in France. Ann Endocrinol. 1 déc 2020;81(6):530‑
- Ahn HS, Kim HJ, Welch HG. Korea’s Thyroid-Cancer “Epidemic” — Screening and Overdiagnosis. N Engl J Med. 6 nov 2014;371(19):1765‑
- Janakiram N, Udyavar R, Endo M. Disease–Specific Survival of Patients with Metastatic Differentiated Thyroid Cancer Has Not Improved Over the Past Three Decades. Clin Thyroid. 14 mars 2023;35(3):110‑
- Qu H, Zhang Z, Zhang D, Okamoto T, Zhang P, Zhang H, et al. Stage-Dependent Death Hazard and Conditional Survival of Patients with Papillary Thyroid Cancer. Thyroid® [Internet]. 27 mars 2023 [cité 29 sept 2023]; Disponible sur: https://www.liebertpub.com/doi/10.1089/thy.2022.0700
- Leboulleux S, Bournaud C, Chougnet CN, Zerdoud S, Catargi BN, Cao CD, et al. Estimabl2: Is There a Need for Radioiodine Ablation in Low Risk Differentiated Thyroid Cancer (DTC) Patients?: Results From the French Randomized Phase III Prospective Trial on 776 Patients (NCT 01837745). J Endocr Soc. 3 mai 2021;5(Suppl 1):A875.
- Walter LB, Scheffel RS, Zanella AB, Farenzena M, Faccin CS, Graudenz MS, et al. Active Surveillance of Differentiated Thyroid Cancer Metastatic Cervical Lymph Nodes: A Retrospective Single-Center Cohort Study. Thyroid®. mars 2023;33(3):312‑
- Agosto Salgado S, Kaye ER, Sargi Z, Chung CH, Papaleontiou M. Management of Advanced Thyroid Cancer: Overview, Advances, and Opportunities. Am Soc Clin Oncol Educ Book. juin 2023;(43):e389708.
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid Off J Am Thyroid Assoc. janv 2016;26(1):1‑
- Pacini F, Fuhrer D, Elisei R, Handkiewicz-Junak D, Leboulleux S, Luster M, et al. 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J [Internet]. 1 févr 2022 [cité 29 sept 2023];11(1). Disponible sur: https://etj.bioscientifica.com/view/journals/etj/11/1/ETJ-21-0046.xml
- Baloch ZW, Asa SL, Barletta JA, Ghossein RA, Juhlin CC, Jung CK, et al. Overview of the 2022 WHO Classification of Thyroid Neoplasms. Endocr Pathol. mars 2022;33(1):27‑
- Miyauchi A. Clinical Trials of Active Surveillance of Papillary Microcarcinoma of the Thyroid. World J Surg. mars 2016;40(3):516‑
- Miyauchi A, Ito Y, Fujishima M, Miya A, Onoda N, Kihara M, et al. Long-Term Outcomes of Active Surveillance and Immediate Surgery for Adult Patients with Low-Risk Papillary Thyroid Microcarcinoma: 30-Year Experience. Thyroid Off J Am Thyroid Assoc. juill 2023;33(7):817‑
- Sasaki T, Miyauchi A, Fujishima M, Ito Y, Kudo T, Noda T, et al. Comparison of Postoperative Unfavorable Events in Patients with Low-Risk Papillary Thyroid Carcinoma: Immediate Surgery Versus Conversion Surgery Following Active Surveillance. Thyroid Off J Am Thyroid Assoc. févr 2023;33(2):186‑
- Brito JP, Ito Y, Miyauchi A, Tuttle RM. A Clinical Framework to Facilitate Risk Stratification When Considering an Active Surveillance Alternative to Immediate Biopsy and Surgery in Papillary Microcarcinoma. Thyroid Off J Am Thyroid Assoc. janv 2016;26(1):144‑
- Borson-Chazot F, Buffet C, Decaussin-Petrucci M, Cao CD, Drui D, Leboulleux S, et al. SFE-AFCE-SFMN 2022 consensus on the management of thyroid nodules: Synthesis and algorithms. Ann Endocrinol. déc 2022;83(6):440‑
- Sugitani I. Active surveillance of low-risk papillary thyroid microcarcinoma. Best Pract Res Clin Endocrinol Metab. janv 2023;37(1):101630.
- Zhu P, Zhang Q, Wu Q, Shi G, Wang W, Xu H, et al. Barriers and Facilitators to the Choice of Active Surveillance for Low-Risk Papillary Thyroid Cancer in China: A Qualitative Study Examining Patient Perspectives. Thyroid Off J Am Thyroid Assoc. juill 2023;33(7):826‑
- American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid Off J Am Thyroid Assoc. nov 2009;19(11):1167‑
- Bosset M, Bonjour M, Castellnou S, Hafdi-Nejjari Z, Bournaud-Salinas C, Decaussin-Petrucci M, et al. Long-Term Outcome of Lobectomy for Thyroid Cancer. Eur Thyroid J. nov 2021;10(6):486‑
- Daniels GH, Ross DS. Radioactive Iodine: A Living History. Thyroid Off J Am Thyroid Assoc. juin 2023;33(6):666‑
- Schvartz C, Bonnetain F, Dabakuyo S, Gauthier M, Cueff A, Fieffé S, et al. Impact on overall survival of radioactive iodine in low-risk differentiated thyroid cancer patients. J Clin Endocrinol Metab. mai 2012;97(5):1526‑
- Lamartina L, Durante C, Filetti S, Cooper DS. Low-risk differentiated thyroid cancer and radioiodine remnant ablation: a systematic review of the literature. J Clin Endocrinol Metab. mai 2015;100(5):1748‑
- Schlumberger M, Leboulleux S, Catargi B, Deandreis D, Zerdoud S, Bardet S, et al. Outcome after ablation in patients with low-risk thyroid cancer (ESTIMABL1): 5-year follow-up results of a randomised, phase 3, equivalence trial. Lancet Diabetes Endocrinol. août 2018;6(8):618‑
- Filetti S, Durante C, Hartl D, Leboulleux S, Locati LD, Newbold K, et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 1 déc 2019;30(12):1856‑
- Fugazzola L, Elisei R, Fuhrer D, Jarzab B, Leboulleux S, Newbold K, et al. 2019 European Thyroid Association Guidelines for the Treatment and Follow-Up of Advanced Radioiodine-Refractory Thyroid Cancer. Eur Thyroid J. oct 2019;8(5):227‑
- Gomes-Lima CJ, Chittimoju S, Wehbeh L, Dia S, Pagadala P, Al-Jundi M, et al. Metastatic Differentiated Thyroid Cancer Survival Is Unaffected by Mode of Preparation for 131I Administration. J Endocr Soc. 1 mai 2022;6(5):bvac032.
- Bardet S, Ciappuccini R, Quak E, Rame JP, Blanchard D, de Raucourt D, et al. Prognostic value of microscopic lymph node involvement in patients with papillary thyroid cancer. J Clin Endocrinol Metab. janv 2015;100(1):132‑
- Rosario PW, Mourão GF, Calsolari MR. Recombinant human TSH versus thyroid hormone withdrawal in adjuvant therapy with radioactive iodine of patients with papillary thyroid carcinoma and clinically apparent lymph node metastases not limited to the central compartment (cN1b). Arch Endocrinol Metab. 2017;61(2):167‑
- Matrone A, Gambale C, Piaggi P, Viola D, Giani C, Agate L, et al. Postoperative Thyroglobulin and Neck Ultrasound in the Risk Restratification and Decision to Perform 131I Ablation. J Clin Endocrinol Metab. 1 mars 2017;102(3):893‑
- Leenhardt L, Leboulleux S, Bournaud C, Zerdoud S, Schvartz C, Ciappuccini R, et al. Recombinant Thyrotropin vs Levothyroxine Withdrawal in 131I Therapy of N1 Thyroid Cancer: A Large Matched Cohort Study (ThyrNod). J Clin Endocrinol Metab. 1 avr 2019;104(4):1020‑
- Worden F. Treatment strategies for radioactive iodine-refractory differentiated thyroid cancer. Ther Adv Med Oncol. nov 2014;6(6):267‑
- Durante C, Haddy N, Baudin E, Leboulleux S, Hartl D, Travagli JP, et al. Long-Term Outcome of 444 Patients with Distant Metastases from Papillary and Follicular Thyroid Carcinoma: Benefits and Limits of Radioiodine Therapy. J Clin Endocrinol Metab. 1 août 2006;91(8):2892‑
- Pacini F. Which patient with thyroid cancer deserves systemic therapy and when? Best Pract Res Clin Endocrinol Metab. juin 2017;31(3):291‑
- Vaisman F, Carvalho DP, Vaisman M. A new appraisal of iodine refractory thyroid cancer. Endocr Relat Cancer. déc 2015;22(6):R301-310.
- Deschamps F, Tselikas L, Yevich S, Bonnet B, Roux C, Kobe A, et al. Electrochemotherapy in radiotherapy-resistant epidural spinal cord compression in metastatic cancer patients. Eur J Cancer Oxf Engl 1990. juin 2023;186:62‑
- Brose MS, Nutting CM, Jarzab B, Elisei R, Siena S, Bastholt L, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. The Lancet. 26 juill 2014;384(9940):319‑
- Schlumberger M, Tahara M, Wirth LJ, Robinson B, Brose MS, Elisei R, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med. 12 févr 2015;372(7):621‑
- Brose MS, Robinson B, Sherman SI, Krajewska J, Lin CC, Vaisman F, et al. Cabozantinib for radioiodine-refractory differentiated thyroid cancer (COSMIC-311): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 1 août 2021;22(8):1126‑
- Krajewska J, Paliczka-Cieslik E, Jarzab B. Managing tyrosine kinase inhibitors side effects in thyroid cancer. Expert Rev Endocrinol Metab. mars 2017;12(2):117‑
- Shyam Sunder S, Sharma UC, Pokharel S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 7 juill 2023;8(1):1‑
- Molenaar CJL, Minnella EM, Coca-Martinez M, ten Cate DWG, Regis M, Awasthi R, et al. Effect of Multimodal Prehabilitation on Reducing Postoperative Complications and Enhancing Functional Capacity Following Colorectal Cancer Surgery: The PREHAB Randomized Clinical Trial. JAMA Surg. 1 juin 2023;158(6):572‑
- Agrawal N, Akbani R, Aksoy B, Ally A, Arachchi H, Asa S, et al. Integrated Genomic Characterization of Papillary Thyroid Carcinoma. Cell. 23 oct 2014;159:676‑
- de la Fouchardière C, Wassermann J, Calcagno F, Bardet S, Al Ghuzlan A, Borget I, et al. Génotypage moléculaire dans les cancers réfractaires de la thyroïde en 2021 : quand, comment, et pourquoi ? Un travail du réseau TUTHYREF. Bull Cancer (Paris). 1 nov 2021;108(11):1044‑
- Fagin JA, Wells SA. Biologic and Clinical Perspectives on Thyroid Cancer. N Engl J Med. 15 sept 2016;375(11):1054‑
- Yang J, Gong Y, Yan S, Chen H, Qin S, Gong R. Association between TERT promoter mutations and clinical behaviors in differentiated thyroid carcinoma: a systematic review and meta-analysis. Endocrine. 2020;67(1):44‑
- Leboulleux S, Do Cao C, Zerdoud S, Attard M, Bournaud C, Lacroix L, et al. A Phase II Redifferentiation Trial with Dabrafenib-Trametinib and 131I in Metastatic Radioactive Iodine Refractory BRAF p.V600E-Mutated Differentiated Thyroid Cancer. Clin Cancer Res Off J Am Assoc Cancer Res. 5 juill 2023;29(13):2401‑
- French JD. Immunotherapy for advanced thyroid cancers — rationale, current advances and future strategies. Nat Rev Endocrinol. nov 2020;16(11):629‑
- Mehnert JM, Varga A, Brose MS, Aggarwal RR, Lin CC, Prawira A, et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with advanced, PD-L1-positive papillary or follicular thyroid cancer. BMC Cancer. 4 mars 2019;19(1):196.
- Gild ML, Bullock M, Tsang V, Clifton-Bligh RJ, Robinson BG, Wirth LJ. Challenges and Strategies to Combat Resistance Mechanisms in Thyroid Cancer Therapeutics. Thyroid Off J Am Thyroid Assoc. juin 2023;33(6):682‑
- Pani F, Caria P, Yasuda Y, Makoto M, Mariotti S, Leenhardt L, et al. The Immune Landscape of Papillary Thyroid Cancer in the Context of Autoimmune Thyroiditis. Cancers. 1 sept 2022;14(17):4287.
- Graceffa G, Patrone R, Vieni S, Campanella S, Calamia S, Laise I, et al. Association between Hashimoto’s thyroiditis and papillary thyroid carcinoma: a retrospective analysis of 305 patients. BMC Endocr Disord. 29 mai 2019;19(1):26.
- Spitzweg C, Bible KC, Hofbauer LC, Morris JC. Advanced radioiodine-refractory differentiated thyroid cancer: the sodium iodide symporter and other emerging therapeutic targets. Lancet Diabetes Endocrinol. oct 2014;2(10):830‑
- Spitzweg C, Nelson PJ, Wagner E, Bartenstein P, Weber WA, Schwaiger M, et al. The sodium iodide symporter (NIS): novel applications for radionuclide imaging and treatment. Endocr Relat Cancer. 3 sept 2021;28(10):T193‑
