| Éditorial : La thyroïde sous tous les angles… | |||||||||||||||||||||||||||||||||||||||||||||
Chers collègues, Enfin une nouvelle newsletter Thyroïde, pleine de nouveautés et de diversités. Bonne lecture et joyeuses fêtes de fin d’années ! L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| Aspects échographiques des tumeurs trabéculaires hyalinisantes | |||||||||||||||||||||||||||||||||||||||||||||
|
Gilles Russ, Bénédicte Royer, Claude Bigorgne, Agnès Rouxel, Marie Bienvenu-Perrard Les tumeurs trabéculaires hyalinisantes sont des lésions rares de la thyroïde, décrites pour la première fois par Carney en 1987 (1). Ce sont des tumeurs de souche folliculaire, atteignant surtout les femmes d’âge moyen. La description en 2019 par Nikiforova d’une anomalie moléculaire spécifique de cette tumeur, un réarrangement GLIS, éclaire d’une lueur nouvelle cette lésion (2). Le diagnostic est histologique et immunohistochimique, mais les caractéristiques cytologiques peuvent induire des confusions fréquentes avec un carcinome papillaire ou même avec un carcinome médullaire de la thyroïde. La comparaison des résultats cytologiques avec l’aspect échographique pourrait permettre de limiter ces erreurs. Quels sont donc les signes échographiques des tumeurs trabéculaires hyalinisantes (TTH) ?
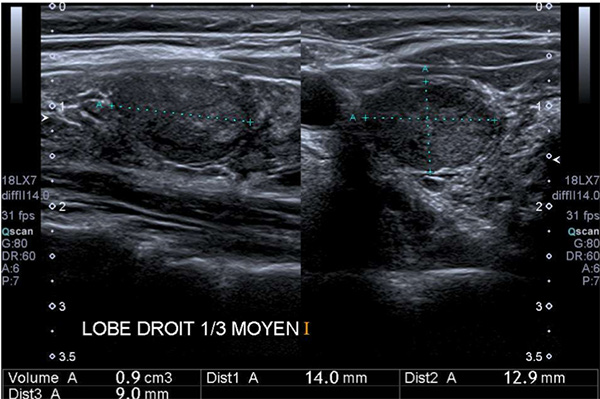
Figure 1. Coupes longitudinale et transversale d’un nodule ovale, exclusivement solide, modérément hypoéchogène, mais dont l’échogénicité est celle des muscles superficiels, sans ponctuations hyperéchogènes.
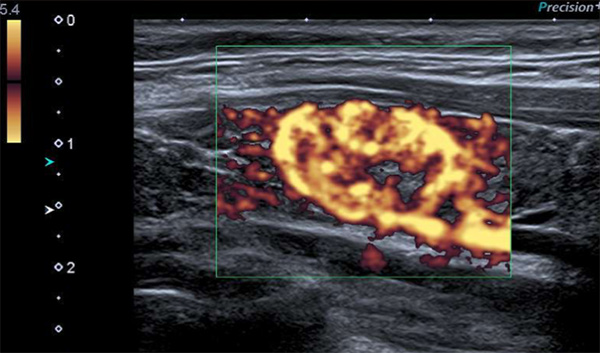
Figure 2. Étude au doppler puissance : hypervascularisation centrale diffuse.
L’étude la littérature permet d’identifier 3 séries principales sur les aspects échographiques des TTH, toutes provenant de Corée du Sud. Dans l’étude de Jang et al. (3), sur 12 TTH, les nodules étaient de forme ovale et vascularisés (100 %), hypoéchogènes (83 %) et sans calcifications (92 %). Dans 55 % des cas, la cytologie était suspecte de carcinome papillaire. Dans la série de Choi et al. (4), sur 24 cas, les nodules étaient de forme ovale, présentaient une vascularisation centrale dans 100 % des cas, avec des contours réguliers (88 %) et hypoéchogènes (75 %). La cytologie était classée dans la catégorie maligne (63 %) ou avec des atypies de signification indéterminée (37 %). De manière intéressante, la microbiopsie permettait en revanche constamment le diagnostic. Enfin, dans l’étude de Lee et al. (5), sur 10 cas, les nodules étaient ovales, solides, bien limités et sans microcalcifications (100 %), hypoéchogènes avec un halo (80 %). Le résultat cytologique était malin ou suspect de carcinome papillaire dans 80 % des cas. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Carney JA et al. Hyalinizing trabecular adenoma of the thyroid gland. Am J Surg Pathol 1987;11: 583-91. 2. Nikiforova MN et al. GLIS Rearrangement is a Genomic Hallmark of Hyalinizing Trabecular Tumor of the Thyroid Gland. Thyroid 2019;29(2):161-73. 3. Jang H et al. Hyalinizing trabecular tumor of the thyroid: diagnosis of a rare tumor using ultrasonography, cytology, and intraoperative frozen sections. Ultrasonography 2016;35(2):131-9. 4. Choi WJ et al. The ultrasonography features of hyalinizing trabecular tumor of the thyroid gland and the role of fine needle aspiration cytology and core needle biopsy in its diagnosis. Acta Radiol 2015;56(9):1113-8. 5. Lee S et al. The ultrasonography features of hyalinizing trabecular tumor of the thyroid are more consistent with its benign behavior than cytology or frozen section readings. Thyroid 2011;21(3):253-9. 6. Carney JA et al. Hyalinizing trabecular tumors of the thyroid gland are almost all benign. Am J Surg Pathol 2008;32(12):1877-89. Les auteurs déclarent ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| Le cancer thyroïdien différencié des jeunes : pensez à DICER1 ! Et si le cancer thyroïdien était comme le goitre multinodulaire : une porte d’entrée diagnostique pour le syndrome de prédisposition tumorale DICER1 ? |
|||||||||||||||||||||||||||||||||||||||||||||
|
Isabelle Oliver-Petit Le syndrome DICER1 se présente comme un spectre de tumeurs rares, bénignes et/ou malignes de l’enfant ou du sujet jeune qui s’est précisé et élargi ces dernières années.
Ces données ont servi de base aux recommandations internationales d’indication d’analyse constitutionnelle du gène DICER1 publiées en 2018 (3). Celles-ci modifient dorénavant la prise en charge du GMN et du CDT de l’enfant, incitant à proposer systématiquement la recherche d’un variant pathogène de DICER1, si possible par l’étude d’un panel de gènes de prédisposition aux cancers incluant DICER1 en séquençage haut débit (NGS) devant tout GMN ou tout CDT apparu précocement, même isolé, particulièrement s’il existe bien sûr une histoire familiale.
Ces résultats confirment que le CDT de l’enfant se distingue de celui de l’adulte sur les plans clinique et évolutif, mais aussi au niveau moléculaire. Les recommandations d’indication d’analyse d’anomalie constitutionnelle de DICER1 doivent être largement diffusées auprès des cliniciens et appliquées afin de pouvoir identifier précocement les patients porteurs d’un syndrome DICER1. Cela doit permettre le conseil génétique précoce des fratries et apparentés, et de mettre en œuvre le dépistage des autres pathologies tumorales du syndrome dont le pronostic peut être péjoratif quand le diagnostic est tardif.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Oliver-Petit I et al. Multinodular goitre is a gateway for molecular testing of DICER1 syndrome. Clin Endocrinol (Oxf) 2019;91(5):669-75. L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
|
|||||||||||||||||||||||||||||||||||||||||||||
| Les anti-RET : l’avenir des cancers thyroïdiens au-delà des carcinomes médullaires thyroïdiens ? D’après la communication orale de Cabanillas M, ESMO 2019, abstr. LBA93 (1) |
|||||||||||||||||||||||||||||||||||||||||||||
|
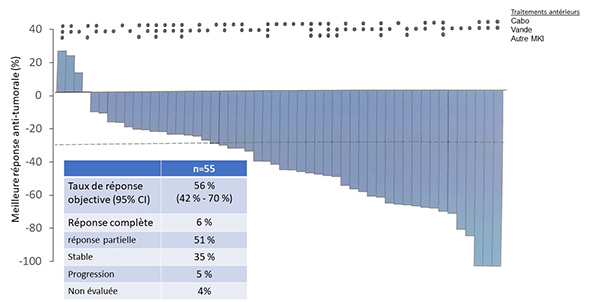
Magali Haissaguerre Le gène RET code pour un récepteur transmembranaire à activité tyrosine kinase qui est fréquemment altéré dans les carcinomes médullaires thyroïdiens (CMT), lié à des mutations dites activatrices responsables d’une prolifération cellulaire non contrôlée. Les mutations germinales de RET, présentes dans toutes les cellules de l’organisme, caractérisent les patients porteurs de NEM2A ou B. Plus de 60 % des CMT sporadiques, sans mutation germinale de RET, expriment une mutation activatrice de RET au niveau somatique tumoral. Figure 1. Efficacité antitumorale du selpercatinib chez 55 patients ayant un carcinome médullaire thyroïdien muté RET.
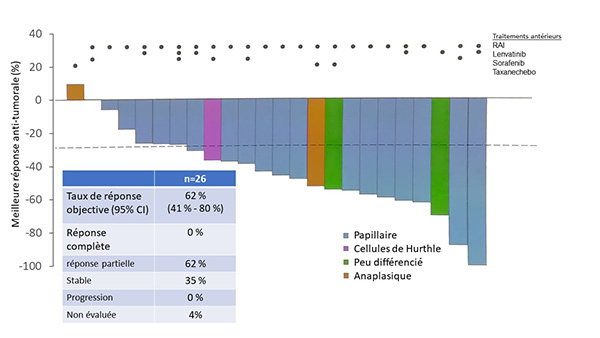
Figure 2. Efficacité antitumorale du selpercatinib chez 26 patients ayant un cancer thyroïdien différencié réfractaire à l’iode et muté RET (fusion RET).
Tableau. Synthèse des résultats antitumoraux des principales thérapies ciblées testées dans les cancers thyroïdiens différenciés et médullaires.
Des biais de comparaison liés à des essais de type cross-trials existent.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Wirth L et al., Registrational Results of LOXO-292 in Patients with RET-Altered Thyroid Cancers, ESMO 2019, abstr. LBA93. L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
|
|||||||||||||||||||||||||||||||||||||||||||||
| Anticorps anti-TPO et désir de grossesse : L-thyroxine ou surveillance ? | |||||||||||||||||||||||||||||||||||||||||||||
|
Clotilde Saïe, Camille Buffet Des études montrent une augmentation des fausses couches et des naissances prématurées chez les femmes présentant des anticorps antithyroperoxydase positifs (anti-TPO+) (1). Cependant, les 3 essais randomisés concernant l’utilisation de la lévothyroxine chez ces femmes montraient des résultats discordants : 2 en faveur d’un bénéfice (2, 3) et 1 sans bénéfice retrouvé (4). Une nouvelle étude randomisée anglaise apporte de nouveaux éléments (5).
Résultats
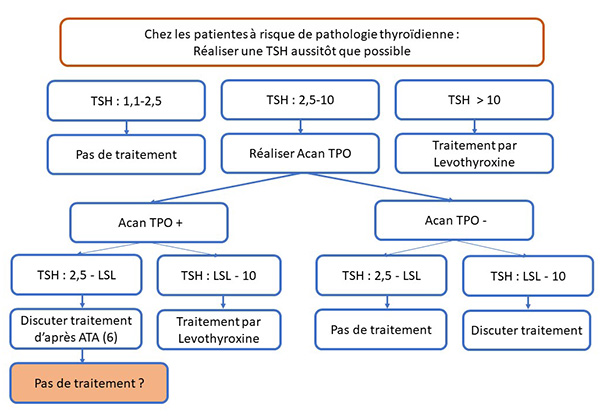
Perspectives Figure. Indication de L-thyroxine pendant la grossesse d’après les recommandations 2017 de l’American Thyroid Association (6).
LSL : limite supérieure du laboratoire. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Thangaratinam S et al. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence. BMJ 2011;342:d2616. Les auteurs n’ont pas précisé leurs éventuels liens d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||
| Les anticorps antihormones thyroïdiennes : un marqueur prédictif de la thyroïdite du post-partum ? |
|||||||||||||||||||||||||||||||||||||||||||||
|
Fritz-Line Velayoudom La thyroïdite du post-partum (TPP) survient classiquement chez les femmes sans dysfonctionnement thyroïdien antérieur à la grossesse. C’est une pathologie auto-immune de novo qui apparaît dans l’année qui suit l’accouchement. Sa prévalence est de l’ordre de 5,1 %. Elle est augmentée chez les femmes qui ont d’autres pathologies auto-immunes comme le diabète de type 1 (1). Histologiquement, la TPP se caractérise par un infiltrat thyroïdien lymphocytaire. Biologiquement, elle se développe chez environ 30 à 50 % des femmes qui ont des anticorps antiperoxydase (Ac ATPO) et/ou antithyroglobuline (Ac ATG) pendant le premier trimestre de la grossesse. Le risque évolutif est celui de l’hypothyroïdie définitive qui est difficile à prédire et peut survenir dès la fin de la première année du post-partum (2). Résultats Discussion
Les limites de l’étude sont l’absence de dosage répété des AcHT à différentes périodes de la grossesse et du post-partum, le budget ne permettant qu’un nombre limité de prélèvements biologiques. En conclusion, la positivité des AcHT pendant la grossesse augmente considérablement le risque de TPP observé en présence d’ATPO ou d’ATG. Cependant, la faible fréquence de détection des AcHT pendant la grossesse (5,1 %) et leur faible sensibilité (17,5 %) ne permettent pas leur utilisation comme marqueurs prédictifs de TPP. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Stagnaro-Green A. Approach to the patient with postpartum thyroiditis. J Clin Endocrinol Metab 2012;97:334-42. L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| Dosage de la T3L chez les patients substitués par L-thyroxine après thyroïdectomie ou irathérapie : les patients sont-ils euthyroïdiens ? | |||||||||||||||||||||||||||||||||||||||||||||
|
Stéphanie Espiard Chez un sujet normal, la majorité de la T4 est sécrétée directement par la thyroïde, tandis que 20 % de la T3 est sécrété directement par la glande et 80 % provient de la conversion périphérique de la T4 en T3 par les désiodases. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Ito M et al. TSH-suppressive doses of levothyroxine are required to achieve preoperative native serum triiodothyronine levels in patients who have undergone total thyroidectomy. Eur J Endocrinol 2012;167(3):373-8. L’auteur n’a pas précisé ses éventuels liens d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||
| Éditorial fertilité : Le monde des possibles… ! | |||||||||||||||||||||||||||||||||||||||||||||
Chers collègues, Nous avons le plaisir de vous présenter cette nouvelle newsletter Reproduction qui prend donc le chemin d’un rendez-vous annuel, ce dont nous nous félicitons. |
|||||||||||||||||||||||||||||||||||||||||||||
|
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| À quand la première naissance d’un enfant après une greffe de tissu testiculaire cryopréservé ? | |||||||||||||||||||||||||||||||||||||||||||||
|
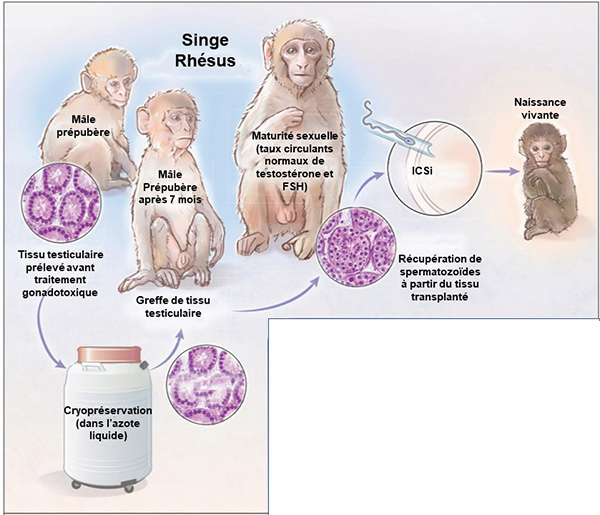
Virginie Grouthier Le pronostic des cancers de l’enfant s’est nettement amélioré ces dernières années, affichant plus de 80 % de taux de survie chez ces patients. 30 % d’entre eux seront infertiles à l’âge adulte, conséquence des traitements anticancéreux. La préservation de la fertilité est devenue une bonne pratique médicale à proposer avant l’instauration de ces traitements. Or chez les jeunes garçons, la congélation de sperme n’est pas une option possible. Avant la puberté, il est donc proposé une congélation du tissu testiculaire. Cependant, à l’heure actuelle, aucune utilisation de tissu testiculaire humain congelé n’a encore été rapportée. En revanche, des résultats prometteurs de transplantation et maturation in vitro de cellules spermatogoniales souches ont été obtenus chez les animaux. En effet, des greffes de tissu testiculaire immature, contenant ces cellules souches de différentes espèces animales (souris, porcs, chèvres, lapins, hamsters, chiens, chats, chevaux, bovins, singes), sous la peau de souris immunodéficientes ont permis d’obtenir une spermatogenèse, voire une progéniture vivante (chez les souris, les porcs et les singes). Cependant, d’un point de vue éthique, cette technique de xénogreffe n’est pas possible chez l’homme. Seules 3 études de greffe autologue de tissu testiculaire immature chez des primates non humains sont rapportées dans la littérature, mais les résultats sont mitigés (récupération faible des greffons cryopréservés (5 %), spermatogenèse complète dans 13 à 17 % des cas uniquement). De plus, la capacité de fertilité de ces spermatozoïdes n’a pas été testée.
Ce travail complet sur les greffes autologues de tissu testiculaire immature est la preuve qu’une récupération fonctionnelle du tissu testiculaire cryopréservé est possible à la fois sur le plan endocrine, mais également exocrine. Évidemment, cette approche reste expérimentale, mais elle ouvre théoriquement le champ à une utilisation future possible de sperme à partir de tissus testiculaires prépubères humains cryoconservés (par exemple, pour les survivants de cancer infantile). Un des points forts de l’étude, en plus de la taille importante des greffons par rapport aux études précédentes (respectivement 9 à 20 mm3 versus 0,5 à 1 mm3) est l’utilisation de concentration de DMSO (diméthylsulfoxyde) identique à celle utilisée pour la FIV chez l’humain. En effet, les conditions de milieu de culture de cette étude sont proches de celles utilisées dans la pratique humaine. Cependant, il est important de rester prudent car, dans le cas de l’homme, les tissus testiculaires prélevés avant le traitement d’un cancer pourraient héberger des cellules malignes, en particulier dans le cadre d’une leucémie, d’un lymphome ou d’un cancer du testicule chez l’enfant. En revanche, la greffe de tissu testiculaire autologue pourrait être intéressante pour les jeunes patients bénéficiant d’une greffe de moelle osseuse pour des affections non malignes (par exemple, ?-thalassémie, drépanocytose) ou atteints de tumeurs solides ne métastasant pas dans les testicules. Ces résultats encourageants doivent être modérés car les auteurs ont reconnu que les animaux utilisés étaient initialement prévus pour une autre étude utilisant une chimiothérapie (busulfan). Les auteurs se justifient néanmoins en précisant que la chimiothérapie n’a probablement pas affecté leurs résultats puisque les greffons des animaux greffés ont quand même produit des spermatozoïdes et un bébé macaque. Figure. Stratégie pour la préservation de la fertilité masculine : autogreffe de tissu testiculaire immature cryopréservé chez le macaque rhésus permettant la récupération d’une fonction endocrine et exocrine testiculaire (d’après Ogawa T (2)).
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Fayomi AP et al. Autologous grafting of cryopreserved prepubertal rhesus testis produces sperm and offspring. Science 2019;363(6433):1314-19. L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| La transplantation de microbiote… intravaginale aussi ? | |||||||||||||||||||||||||||||||||||||||||||||
|
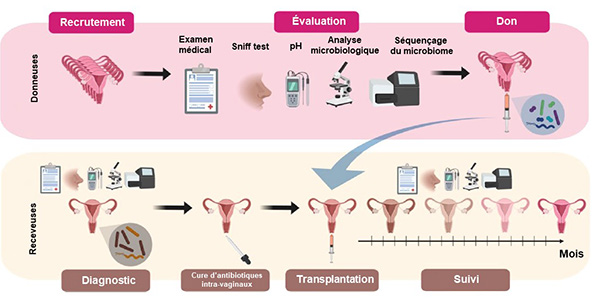
Nicolas Chevalier Le microbiote a déjà été mis à toutes les “sauces”, ou presque. Il en manquait une : le vagin…
Figure. Modèle de transplantation intravaginale de microbiote (d’après Lev-Sagie A et al. (1)).
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Référence bibliographique 1. Lev-Sagie A et al. Vaginal microbiome transplantation in women with intractable bacterial vaginosis. Nat Med 2019. doi: 10.1038/s41591-019-0600-6. [Epub ahead of print] L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
| Faut-il traiter par progestérone les femmes ayant des saignements en début de grossesse ? | |||||||||||||||||||||||||||||||||||||||||||||
|
Tiphaine Le Poulennec Une grossesse sur 5 se termine par une fausse couche. Les fausses couches ont un fort impact psychologique et peuvent provoquer des saignements excessifs nécessitant des gestes chirurgicaux. Quel traitement pourrait améliorer cette issue ? La progestérone, produite par le corps jaune, sert à préparer l’endomètre à l’implantation. Elle supprime les contractions utérines et pourrait avoir un rôle dans la prévention du rejet de l’embryon. Il est suggéré que la sécrétion inadéquate de progestérone par le corps jaune pourrait être une cause de fausse couche. Le traitement par progestérone pourrait alors prévenir la perte de grossesse spontanée. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Références bibliographiques 1. Coomarasamy A et al. A randomized trial of progesterone in women with recurrent miscarriages. N Engl J Med 2015;373(22):2141-8. L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article. |
|||||||||||||||||||||||||||||||||||||||||||||
|
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d’un droit d’accès, de rectification et d’opposition aux informations vous concernant qui peut s’exercer par courrier à : SFE 88, rue de la Roquette – 75011 Paris– Courriel : webmaster@sfendocrino.org |
|||||||||||||||||||||||||||||||||||||||||||||
La lettre Thyroïde et Fertilité de Novembre 2019