Item 268 – Hypercalcémie
_____________________________________________________________________________
Situations de départ
- 2 Diarrhée.
- 4 Douleur abdominale.
- 17 Amaigrissement
- 21 Asthénie.
- 24 Bouffées de chaleur.
- 25 Hypersudation.
- 26 Anomalies de la croissance staturo-pondérale.
- 42 Hypertension artérielle.
- 50 Malaise/perte de connaissance.
- 61 Syndrome polyuro-polydypsique.
- 113 Puberté précoce ou retardée.
- 148 Goitre ou nodule thyroïdien.
- 165 Palpitations.
- 194 Analyse du bilan thyroïdien.
- 200 Dyscalcémie.
- 225 Découverte d’une anomalie cervico-faciale à l’examen d’imagerie médicale.
- 266 Consultation de suivi d’un patient polymédiqué.
- 279 Consultation de suivi d’une pathologie chronique.
- 282 Prescription médicamenteuse, consultation de suivi et éducation d’un patient hypertendu.
- 285 Consultation de suivi et éducation thérapeutique d’un patient avec un antécédent cardiovasculaire.
- 306 Dépistage et prévention ostéoporose.
- 328 Annonce d’une maladie chronique.
- 352 Expliquer un traitement au patient (adulte, enfant, adolescent).
- 354 Évaluation de l’observance thérapeutique.
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé | Descriptif |
| A | Définitions | Connaître les normes de calcémie totale et de la calcémie ionisée | Connaître les seuils de calcémie et savoir qu’une hypoalbuminémie impacte le dosage de la calcémie totale |
| A | Diagnostic positif | Savoir identifier une hypercalcémie | Connaître les principaux symptômes associés à une hypercalcémie : déshydratation, altération de l’état général, troubles digestifs, syndrome confusionnel, fractures pathologiques |
| B | Éléments physiopathologiques | Connaître les principaux mécanismes des hypercalcémies | Connaître le rôle de la parathormone et de la vitamine D, connaître les mécanismes de régulation de la calcémie aux niveaux osseux, digestif et rénal |
| A | Diagnostic positif | Connaître les principaux signes cliniques associés à l’hypercalcémie | Connaître les principaux signes cliniques associés à une hypercalcémie : troubles digestifs et neurologiques, déshydratation, altération de l’état général |
| B | Examens complémentaires | Connaître les principales anomalies ECG associées à l’hypercalcémie | Savoir identifier un raccourcissement du QTc |
| A | Examens complémentaires | Connaître les examens complémentaires de première intention à réaliser en fonction du contexte devant une hypercalcémie | Savoir demander calcémie ionisée, créatininémie, ionogramme sanguin, phosphatémie, électrophorèse de protides, parathormone, ECG |
| B | Examens complémentaires | Connaître les principaux examens complémentaires utiles au diagnostic étiologique des hypercalcémies en fonction du bilan initial | Savoir quand et comment rechercher une hyperparathyroïdie primaire (PTH, échographie cervicale, scintigraphie au MIBI), un myélome (EPS/immunofixation, myélogramme, imagerie osseuse), une néoplasie associée à des métastases osseuses (scintigraphie osseuse), une intoxication à la vitamine D (25-(OH)-vitamine D), une endocrinopathie (TSH, cortisol), une sarcoïdose (1,25-(OH)2-vitamine D)… |
| A | Étiologie | Connaître les principales étiologies des hypercalcémies (arbre diagnostique) | Connaître les principales causes d’hypercalcémie en fonction du résultat de la PTH : hyperparathyroïdie primaire, myélome, métastases osseuses, intoxication à la vitamine D |
| B | Prise en charge | Connaître les principes du traitement des hypercalcémies sévères | Savoir évaluer le degré d’urgence et mettre en place les premières mesures en fonction de l’étiologie (hydratation, bisphosphonates, corticoïdes, épuration extra-rénale) et orienter vers un service spécialisé en fonction de la cause |
________________________________________________________________________________
Hypercalcémie
- Rappels physiologiques
- Définition biologique
- Clinique
- Diagnostic étiologique
- Traitement
I Rappels physiologiques
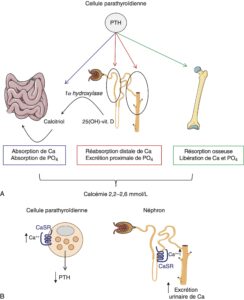
La calcémie est étroitement régulée par deux hormones calciotropes : la parathormone (PTH) et la forme active de la vitamine D, le calcitriol (1,25-(OH)2-vitamine D).
La PTH joue plusieurs rôles (fig. 1) :
- elle stimule la 1α-hydroxylasedans le tubule proximal du rein et augmente par conséquent la production du calcitriol, qui à son tour augmente l’absorption intestinale du calcium et du phosphore ;
- elle augmente la résorption osseuseet donc mobilise le calcium et le phosphore de l’os ;
- elle inhibe la réabsorption rénale du phosphore au niveau du tubule proximal et stimule la réabsorption rénale du calcium au niveau du tubule distal. Cet effet dissocié au niveau du rein permet d’augmenter la calcémie et de diminuer la phosphatémie, sans modifier le produit phosphocalcique.
________________________________________________________________________________
Fig. 1.
Effets biologiques et régulation de la PTH.
A. Régulation du métabolisme phosphocalciquepar la PTH et le calcitriol. B. Régulation de la sécrétion de la PTHet de la calciurie par le récepteur sensible au calcium (CaSR).
(Source : CEEDMM, 2021.)
________________________________________________________________________________
La sécrétion de la parathormone par la cellule parathyroïdienne est finement régulée par le récepteur sensible au calcium (Calcium Sensing Receptor, CaSR) : l’augmentation de la concentration plasmatique du calcium ionisé inhibe, par l’intermédiaire de ce récepteur membranaire, la sécrétion de la PTH. Le CaSR, présent aussi au niveau du tubule rénal, est également impliqué dans la régulation de la calciurie : l’augmentation du calcium ionisé plasmatique inhibe la réabsorption rénale du calcium et augmente ainsi la calciurie (cf. fig. 1).
L’hypercalcémie est le résultat d’une dérégulation entre les flux entrants et sortants du calcium dans le compartiment sanguin. Elle est due :
- soit à l’augmentation de l’absorption calcique digestive ;
- soit à une résorption osseuse accrue ;
- soit à une diminution de l’excrétion rénale du calcium.
Ces mécanismes sont souvent associés.
II Définition biologique
Le diagnostic de l’hypercalcémie est biologique et repose sur le dosage de la calcémie totale. La limite supérieure de la calcémie au-delà de laquelle on définit l’hypercalcémie doit se référer aux normes de chaque laboratoire. Des calcémies au-delà de 2,63 mmol/l [105 mg/l] sont pathologiques.
La calcémie totale mesurée représente la somme du calcium lié (53 % du calcium total) et du calcium libre ou ionisé (47 %) (fig. 2). Le calcium lié comprend le calcium lié aux protéines (40 % du calcium total), en particulier à l’albumine, et le calcium complexé à des anions (13 %) sous forme de bicarbonate, phosphate, sulfate ou citrate.
________________________________________________________________________________
Fig. 2.
Distribution du calcium plasmatique.
Seuls le calcium ionisé et le calcium complexé sont diffusibles et donc biologiquement actifs. Dans certaines situations, le dosage du calcium ionisé permet préciser le diagnostic d’hypercalcémie. En pratique courante, la détermination du calcium total est suffisante dans la grande majorité des cas pour le diagnostic d’une hypercalcémie.
(Source : CEEDMM, 2021.)


________________________________________________________________________________
Le calcium ionisé est estimé à 50 % de la valeur du calcium total, trois conditions particulières rendent cette approximation illicite :
- l’acidose augmente la proportion de calcium ionisé et l’alcalose la diminue ;
- l’hyperprotidémie augmente la calcémie totale mais diminue la part respective de calcium ionisé, et inversement en cas d’hypoprotidémie ;
- l’augmentation du phosphore ou du sulfate sériques diminue le calcium ionisé et augmente la proportion de calcium complexé.
Les valeurs physiologiques du calcium ionisé à jeun sont comprises entre 1,15 et 1,32 mmol/l [43 à 52 mg/l] ; il y a donc hypercalcémie lorsque le calcium ionisé dépasse 1,32 mmol/l. Cependant, la détermination du calcium ionisé est complexe car très dépendante des conditions de prélèvement et de la rapidité du dosage. Ce dosage est privilégié comme la meilleure interprétation de la calcémie dans des conditions rares, au cours du myélome, chez les sujets dénutris et hypoprotidémiques, etc.
III Clinique
La symptomatologie clinique classique de l’hypercalcémie est résumée dans le tableau 1. Ces signes sont peu spécifiques et le diagnostic n’est évoqué que lorsque plusieurs de ces signes sont associés, ce qui est le cas lorsque la calcémie est supérieure à 3 mmol/l [120 mg/l]. La majorité des hypercalcémies modérées, comprises entre 2,63 et 3 mmol/l [105 à 120 mg/l], sont peu ou totalement asymptomatiques. Dans une majorité de cas — jusqu’à 80 % des cas ! —, le diagnostic d’hypercalcémie se fait de façon fortuite à l’occasion d’un dosage systématique de la calcémie.
________________________________________________________________________________
Hypercalcémie maligne
Il s’agit d’une situation d’urgence. La calcémie est en général > 3,7 mmol/l [> 150 mg/l]. La déshydratation, toujours présente, entretient l’élévation de la calcémie. Elle est induite par la polyurie et/ou par les vomissements et est responsable d’une insuffisance rénale fonctionnelle qui aggrave l’hypercalcémie en réduisant la clairance calcique. Le tableau clinique est compliqué par l’altération de la conscience (syndrome confusionnel voire coma).
________________________________________________________________________________
________________________________________________________________________________
Tableau 1.
Signes cliniques communs aux hypercalcémies. (Source : CEEDMM, 2021.)
| Signes généraux | Asthénie générale et musculaire |
| Signes rénaux | Polyuro-polydipsie
Lithiases rénales (récidivantes, bilatérales) |
| Signes digestifs | Anorexie
Constipation Nausées, vomissements |
| Signes neuropsychiques | Apathie
Somnolence Altération de la conscience (confusion, psychose, coma) |
| Signes cardiovasculaires | Hypertension
Raccourcissement du segment QT et anomalies de repolarisation non spécifiques à l’ECG (fig. 3) |
________________________________________________________________________________
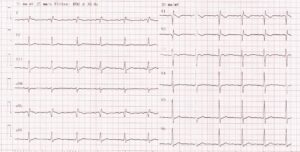
Les signes ECG d’hypercalcémie sont souvent discrets (anomalies de repolarisation non spécifiques), voire absents. Dans certains cas, le raccourcissement du segment QT peut être observé (fig. 3), avec un risque de survenue de troubles du rythme cardiaque, notamment de tachycardie ventriculaire et/ou de bradycardie avec asystolie. Les digitaliques favorisent ces complications et sont formellement contre-indiqués en cas d’hypercalcémie.
________________________________________________________________________________
Fig. 3.
ECG d’une femme de 54 ans avec une hyperparathyroïdie primaire, avec une hypercalcémie à 4,19 mmol/l (albuminémie 48 g/l).
On observe un segment QT un peu raccourci : QT mesuré à 344 ms, QTc à 366 ms (limite inférieure de la normale 350 ms) et les ondes T aplaties voire négatives en antérieur.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
IV Diagnostic étiologique
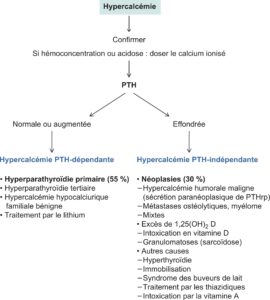
Les principales causes d’hypercalcémie sont présentées dans la figure 4.
________________________________________________________________________________
Fig. 4.
Étiologie des hypercalcémies.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
Schématiquement, les causes d’hypercalcémie peuvent être divisées en deux grands groupes :
- hypercalcémies secondaires à une augmentation par les cellules parathyroïdiennesde la sécrétion de la PTH dont les concentrations plasmatiques sont normales ou hautes ;
- hypercalcémies malgré une suppression parathyroïdienne, donc avec des concentrations de PTH effondrées.
La démarche diagnostique initiale d’une hypercalcémie repose donc en premier lieu sur la mesure de la PTH. Les dosages de la phosphatémie, de la calciurie des 24 heures, du 25-OH-cholécalciférol et très exceptionnellement du calcitriol permettront ensuite de mieux préciser le diagnostic.
Deux étiologies sont largement majoritaires puisqu’elles représentent à elles seules près de 90 % des hypercalcémies : en premier lieu, l’hyperparathyroïdie (HPT) primaire, puis les hypercalcémies liées aux cancers.
A Hypercalcémies PTH-dépendantes
1 Hyperparathyroïdie primaire
Dans l’hyperparathyroïdie primaire, une pathologie primitive d’une ou plusieurs parathyroïdes est responsable d’une sécrétion excessive autonome de la PTH. Elle a pour conséquences des altérations du métabolisme phosphocalcique et des retentissements tissulaires de sévérité très variables. L’hyperparathyroïdie primaire est une maladie fréquente, atteignant classiquement un individu sur 1 000. L’HPT primaire constitue ainsi plus de la moitié des causes d’hypercalcémie. Les formes asymptomatiques et modérées de l’HPT primaire sont encore plus fréquentes chez la femme au-delà de l’âge de la ménopause. Cette augmentation de la prévalence d’hyperparathyroïdie primaire, notamment de ses formes asymptomatiques, est surtout le fait de l’exploration systématique en routine du métabolisme phosphocalcique.
Cette situation est à distinguer :
- de l’HPT secondaire : dans ces circonstances, l’hyperfonctionnement des parathyroïdes est réactionnel à une cause de calcipénie chronique : déplétion en vitamine D, insuffisance rénale ;
- de l’HPT tertiaire : succédant à la situation précédente, l’hyperplasie d’une ou plusieurs glandes fait place à un adénome autonomisé ; celui-ci est désormais responsable d’une production hormonale excessive, même si la cause initiale de carence calcique a disparu.
Signes cliniques
Présentation clinique « classique »
Les signes cliniques de l’HPT primaire sont d’abord ceux de l’hypercalcémie en général (cf. tableau 1). Les patients avec HPT primaire peuvent se plaindre d’asthénie, d’un manque d’entrain, d’une fatigue musculaire à laquelle contribue aussi l’hypophosphorémie.
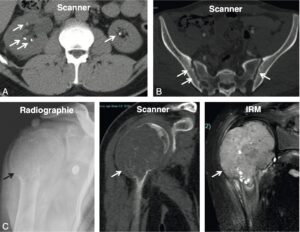
S’y ajoutent des signes osseux, rénaux et articulaires parfois révélateurs, qui constituent déjà des complications de la maladie (fig. 5).
________________________________________________________________________________
Fig. 5.
Retentissements de l’hyperparathyroïdie primaire.
A. Lithiase rénale. B. Résorptions sous-périostales en « coup d’ongle » de l’os iliaque. C. Tumeur brune (qui est un ostéoclastome) de l’humérus (osteitis fibrosa cystica) — aujourd’hui exceptionnelle.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
Les signes osseux sont le reflet d’un déséquilibre du remodelage osseux au profit de la résorption ostéoclastique. L’expression clinique la plus traditionnelle constitue la classique « ostéite fibrokystique », en réalité maintenant exceptionnelle (fig. 5).
Elle détermine des douleurs osseuses très vives, des fractures pathologiques. Des tuméfactions osseuses sont désignées sous le nom de « tumeurs brunes », correspondant histologiquement à une prolifération d’ostéoclastes (ostéoclastomes). Les signes radiologiques classiques de cette résorption accentuée s’observent typiquement au niveau des phalanges des mains. Un amincissement et un aspect fibrillaire des corticales, une disparition des houppes phalangiennes et, surtout, des érosions sous-périostées « en coup d’ongle » très spécifiques sont observés.
Même si ces aspects n’ont pas complètement disparu, beaucoup plus banalement l’hyperparathyroïdie primaire constitue maintenant plutôt une cause d’ostéopénie ou d’ostéoporose. La raréfaction osseuse prédomine sur l’os cortical, dont le meilleur reflet à l’ostéodensitométrie est la densité du tiers distal du radius. Elle respecte relativement l’os trabéculaire et apparaît de ce fait moins évidente au niveau rachidien. Cependant, dans 20 % des cas, l’atteinte rachidienne prédomine. L’étude de la densité osseuse fait donc partie des éléments décisionnels pour l’orientation thérapeutique des hyperparathyroïdies primaires.
L’HPT primaire est une cause de lithiases rénales. Ce sont typiquement des lithiases bilatérales, récidivantes, radio-opaques et parlantes : responsables de colique néphrétique, d’hématurie, d’infection urinaire (en raison de l’alcalinité des urines). Les calculs sont ordinairement constitués d’oxalate de calcium très reconnaissable par leur caractère spiculé, hérissé. La néphrocalcinose est aussi possible. L’exploration rénale doit comporter une mesure de la créatinine plasmatique et un scanner rénal non injecté à basse irradiation — plus précis pour rechercher une lithiase ou une néphrocalcinose que l’échographie rénale. Un syndrome polyuro-polydipsique modéré (de l’ordre de 3 à 4 litres par jour) fait partie du tableau clinique. Il s’explique par une réduction de la sensibilité du tubule rénal à l’action de la vasopressine en raison de l’hypercalcémie. Il s’accompagne d’un défaut d’acidification des urines qui contribue au risque d’infection urinaire et de lithiases.
Des crises « pseudo-goutteuses » sont possibles, liées à la chondrocalcinose. Elles surviennent volontiers au niveau des poignets, des coudes, des genoux.
Formes asymptomatiques
Elles sont de loin les plus fréquentes et constituent 80 à 90 % des HPT primaires actuellement diagnostiquées. Elles sont cliniquement non expressives, n’ont déterminé aucune évidence d’atteinte rénale, articulaire, digestive. Un élément très important de l’évaluation de ces situations est l’appréciation de la masse osseuse en ostéodensitométrie.
Biologie
Le diagnostic biologique de l’hyperparathyroïdie primaire est défini par l’association hypercalcémie et PTH plasmatique élevée ou « normale », donc inadaptée à l’hypercalcémie.
La première étape consiste donc à répéter les dosages de la calcémie pour confirmer l’existence de l’hypercalcémie. Une hypovitaminose D, une hypoalbuminémie ou une acidose peuvent masquer l’hypercalcémie d’une hyperparathyroïdie.
Le déficit en vitamine D doit être substitué pour évaluer l’importance d’une l’hypercalcémie. En cas d’hypoalbuminémie ou d’acidose, la mesure du calcium ionisé plasmatique peut être effectuée. Lorsque cette mesure n’est pas possible, on peut calculer une calcémie corrigée (cf. fig. 2).
La PTH est sécrétée sous la forme d’un peptide de 84 acides aminés. Les dosages actuels immunométriques permettent de mesurer la PTH1-84 ou ses fragments biologiquement actifs. Toute coexistence d’une hypercalcémie même mineure et d’une valeur élevée ou inappropriée (ou « anormalement normale ») de la PTH induit le diagnostic biologique d’hyperparathyroïdie primaire, à l’exception du diagnostic différentiel avec le syndrome d’hypercalcémie-hypocalciurie familiale et l’hyperparathormonémie associée au traitement par le lithium (cf. fig. 4).
Il faut impérativement interpréter les chiffres de la PTH en fonction de la calcémie et ne pas oublier qu’une hyperparathormonémie est d’abord un mécanisme physiologique d’adaptation à une baisse de la calcémie, caractérisant l’hyperparathyroïdie secondaire (cf. supra).
L’hyperparathyroïdie augmente la clairance du phosphate en diminuant sa réabsorption tubulaire. Cependant, la phosphorémie varie de façon importante en fonction de l’apport nutritionnel et de la fonction rénale. L’hypophosphorémie n’est en fait observée que dans 50 % des cas.
La calciurie est accrue dans l’hyperparathyroïdie primaire du fait de l’augmentation de la charge filtrée du calcium (élévation de la calcémie) et l’effet inhibiteur de l’hypercalcémie sur la réabsorption tubulaire rénale du calcium via le CaSR au niveau de l’anse de Henlé. Cependant, les variations physiologiques de la calciurie sont importantes et la calciurie peut être aussi dans les limites de la normale. Ce paramètre est surtout utile pour faire un diagnostic différentiel entre une forme fruste d’hyperparathyroïdie primaire et le syndrome hypercalcémie-hypocalciurie familiale (avec une calciurie typiquement effondrée).
Diagnostic étiologique des hyperparathyroïdies primaires
L’hyperparathyroïdie primaire est dans la grande majorité des cas sporadique et isolée, mais elle peut aussi survenir dans le contexte de maladies héréditaires en rapport avec des mutations germinales.
L’hyperparathyroïdie primaire sporadique est la plupart du temps due à un adénome parathyroïdien unique, parfois à des adénomes multiples (deux adénomes et exceptionnellement trois ou quatre), à une hyperplasie des quatre glandes parathyroïdiennes ou à de très rares cancers parathyroïdiens.
Formes génétiques d’hyperparathyroïdie primaire :
- dans 1 % des cas, les hyperparathyroïdies primaires font partie d’une NEM1, où l’hyperparathyroïdie primaire est présente dans plus de 95 % des cas et dont elle est d’habitude la première manifestation. La maladie concerne toutes les quatre parathyroïdes et se manifeste typiquement par une hyperplasie parathyroïdienne. Les autres atteintes de la NEM1 sont principalement les tumeurs endocrines pancréatiques (surtout les insulinomes, responsables d’hypoglycémies) et du duodénum (les gastrinomes,responsables du syndrome de Zollinger-Ellison) et les adénomes hypophysaires (notamment des prolactinomes), qui doivent alors être systématiquement recherchés (cf. Item 244 – Adénome hypophysaire et Item 240 – Hypoglycémie). Les NEM1 sont dues à des mutations du gène MEN1 codant la protéine ménine ;
- encore plus rarement, les hyperparathyroïdies primaires font partie d’une NEM2A, où l’hyperparathyroïdie primaire est présente dans 20 % des cas. Les NEM2A sont caractérisées par le développement successif d’un cancer médullaire de la thyroïde (première atteinte dans l’histoire naturelle de la maladie, diagnostiquée par le dosage de la calcitonine), d’un phéochromocytome bilatéral (50 % de cas) et d’une hyperparathyroïdie primaire avec atteinte multiglandulaire. Les NEM2A sont dues à des mutations activatrices du proto-oncogène RET ;
- finalement, le syndrome hyperparathyroïdie primaire associé aux tumeurs de la mâchoire est dû aux mutations du gène HRPT2 codant la parafibromine.
Contrairement aux hyperparathyroïdies primaires sporadiques (qui surviennent préférentiellement chez les sujets de plus de 50 ans), les hyperparathyroïdies primaires génétiquement déterminées surviennent dans une population jeune. Toute hyperparathyroïdie primaire chez le sujet de moins de 45 ans (environ 10 % de formes génétiques), ainsi que l’hyperparathyroïdie primaire avec une présentation syndromique (associée à des lésions typiques de la NEM1, NEM2 ou des tumeurs de la mâchoire) ou avec une présentation familiale est donc suspecte d’appartenir à une hyperparathyroïdie primaire génétiquement transmissible et requiert des analyses génétiques des gènes de prédisposition.
2 Hypercalcémie-hypocalciurie familiale
Ce syndrome constitue un piège diagnostique classique avec l’hyperparathyroïdie primaire. Il associe une hypercalcémie en règle générale bien tolérée, une hypophosphorémie, une discrète hypermagnésémie, une calciurie (très) basse (mais pas de façon constante) et des valeurs plasmatiques de PTH normales ou supérieures à la normale mais inadaptées à l’hypercalcémie. C’est donc un tableau biologique d’hyperparathyroïdie primaire, hormis l’hypocalciurie.
Dans ses formes typiques, le rapport des clairances du calcium et de la créatinine est < 0,01, c’est-à-dire que l’excrétion fractionnelle du calcium est < 1 %.
L’hypercalcémie-hypocalciurie familiale est généralement asymptomatique. Très rarement, l’hypersécrétion discrète de la PTH a pu avoir pour conséquence une tendance à l’ostéopénie voire l’ostéoporose.
Il s’agit d’une affection héréditaire transmise sur le mode autosomique dominant. L’hypercalcémie-hypocalciurie familiale est due aux mutations inactivatrices du gène du récepteur sensible au calcium (CaSR) ou des mutations inactivatrices des gènes GNA11 et AP2S1.
3 Lithium
Le lithium entraîne une hypercalcémie chez 10 % des patients traités ; elle régresse à l’arrêt du traitement. L’hypercalcémie induite par le lithium est due à une action directe de celui-ci sur la cellule parathyroïdienne qui, sous l’effet du lithium, est stimulée par des concentrations plus élevées de calcium circulant. De plus, le lithium augmente la réabsorption tubulaire du calcium. Le tableau biologique des hypercalcémies induites par le lithium est donc superposable à celui des hyperparathyroïdies primaires.
B Hypercalcémies PTH-indépendantes
1 Hypercalcémie des affections malignes
L’hypercalcémie des affections malignes est responsable de 30 % des hypercalcémies. Elle constitue donc, après l’HPT primaire, la deuxième cause d’hypercalcémie. Elle se différencie commodément des hyperparathyroïdies primaires par les valeurs effondrées de la PTH plasmatique (cf. fig. 4). Une hypercalcémie est constatée dans 10 à 30 % des cancers et représente généralement un facteur de mauvais pronostic. L’hypercalcémie est souvent sévère, cliniquement parlante et d’apparition rapide.
L’hypercalcémie survient au cours des affections malignes par deux principaux mécanismes :
- l’hypercalcémie humorale maligne est liée à la production paranéoplasique par la tumeur d’un peptide mimant presque tous les effets biologiques de la PTH, le PTHrp (PTH-related peptide) ; le PTHrp, comme la PTH, augmente la résorption osseuse ostéoclastique, qui est reflétée par l’hypercalcémie et l’augmentation de la calciurie. Les dosages immunométriques spécifiques de certains fragments du PTHrp permettent de détecter des valeurs élevées de PTHrp. Le PTHrp est surtout secrété par des cancers épidermoïdes du poumon, de l’œsophage, de la peau, du col utérin, mais aussi le cancer du rein, de l’endomètre, le lymphome à cellules T de l’adulte dû au rétrovirus HTLV-I et le cancer du sein. L’absence de métastases osseuses et l’hypophosphatémie chez un patient cancéreux avec l’hypercalcémie doivent faire évoquer une sécrétion paranéoplasique du PTHrp ;
- l’hypercalcémie liée aux métastases osseuses est probablement plus fréquente que l’hypercalcémie humorale maligne. Les métastases ostéolytiques compliquent particulièrement l’évolution des cancers du sein, des bronches, du rein et de la thyroïde. Les localisations osseuses du myélome, des lymphomes et autres hémopathies malignes sont également responsables de ce type d’hypercalcémie. Les processus d’ostéolyse résultent de l’activité de facteurs stimulant l’activité ostéoclastique produits par les cellules tumorales, tels que le TGF-β, les interleukines 1 et 6. L’hypercalcémie est typiquement associée à une hyperphosphatémie et à la présence de lésions ostéolytiques sur les radiographies du squelette.
2 Autres hypercalcémies avec PTH effondrée
Granulomatoses
L’hypercalcémie se rencontre dans 10 à 20 % des sarcoïdoses évolutives.
La pathogénie de cette hypercalcémie est la production non régulée de la 1,25-(OH)2-vitamine D par le tissu granulomateux. Outre le fait que l’hypercalcémie survient dans un contexte pathologique souvent évident, le diagnostic différentiel avec l’hyperparathyroïdie primaire repose sur l’hyperphosphorémie et sur les valeurs basses de PTH.
Hypercalcémies iatrogènes
Vitamine D et dérivés
L’apport de vitamine D ou de ses dérivés métaboliques actifs (1-(OH)-vitamine D ou 1,25-(OH)2-vitamine D) est responsable d’hypercalcémie en cas de surdosage.
Le tableau biologique associe hypercalcémie, hyperphosphorémie, PTH basse et 1,25-(OH)2-vitamine D augmentée.
Autres causes
Les autres causes sont l’intoxication par la vitamine A, le traitement par diurétiques thiazidiques et la consommation excessive de lait/alcalins.
Vitamine A
L’intoxication par la vitamine A, par une action directe sur l’os, s’accompagne d’une asthénie sévère, de douleurs musculaires et osseuses, d’alopécie des sourcils, de chéilite fissuraire. C’est l’interrogatoire qui conduit au diagnostic, en n’omettant pas de s’enquérir d’un traitement de l’acné ou de psoriasis par isotrétinoïde. Il s’agit toujours d’une prise à trop forte dose et pendant trop longtemps. En cas de doute, l’intoxication peut être confirmée par le dosage de la vitamine A.
Diurétiques thiazidiques
Les diurétiques thiazidiques augmentent la calcémie par diminution de l’excrétion urinaire du calcium associée à l’hémoconcentration. L’hypercalcémie est associée à une hypocalciurie. En pratique, le diagnostic repose sur l’analyse de la composition des traitements antihypertenseurs. Après l’arrêt du thiazidique, si l’hypercalcémie persiste, il est nécessaire de rechercher une autre étiologie.
Buveurs de lait
Les hypercalcémies des buveurs de lait et d’alcalins sont devenues rares depuis les traitements modernes des ulcères gastroduodénaux. Ce syndrome, dont la physiopathologie reste à déterminer, peut encore être observé dans de rares circonstances : automédication par de fortes doses d’antiacides, traitements par de fortes doses de carbonate de calcium.
Immobilisation
Quelle que soit sa cause, mais surtout s’il s’agit de pathologies neurologiques ou orthopédiques chez l’enfant, chez l’adolescent ou l’adulte jeune, l’immobilisation entraîne une diminution de l’ostéosynthèse qui se traduit habituellement par une augmentation de la calciurie et, plus rarement, d’une hypercalcémie. L’ensemble des anomalies biologiques régressent 6 mois environ après la reprise de l’activité.
Hypercalcémie des endocrinopathies (hors hyperparathyroïdie)
Les trois grandes causes sont l’hyperthyroïdie, l’insuffisance surrénale aiguë et le phéochromocytome.
Hyperthyroïdie
L’hyperthyroïdie induit une accélération du renouvellement osseux. L’hypercalcémie est le fait des thyrotoxicoses sévères du sujet âgé pouvant s’accompagner d’ostéoporose. L’hypercalcémie au cours d’une thyrotoxicoses s’associe à une hyperphosphorémie, une hypercalciurie, des valeurs de PTH et de calcitriol effondrées et les marqueurs du remodelage osseux élevés.
Insuffisance surrénale aiguë
L’insuffisance surrénale aiguë peut s’accompagner d’une hypercalcémie modérée due à l’hémoconcentration et à l’insuffisance rénale fonctionnelle. L’hormonothérapie substitutive normalise rapidement la calcémie.
Phéochromocytome
Le phéochromocytome — en dehors de son association dans le cadre d’une NEM2A avec hyperparathyroïdie primaire — peut être associé à une hypercalcémie réversible après l’ablation chirurgicale. On en ignore le mécanisme. L’hémoconcentration peut y contribuer.
V Traitement
La nécessité de traiter une hypercalcémie dépend de l’étiologie et du niveau de l’hypercalcémie. Dans tous les cas où une cause curable a été identifiée, et en dehors d’une hypercalcémie maligne, le traitement se résume au traitement de la maladie responsable de l’hypercalcémie. C’est tout particulièrement le cas pour l’hyperparathyroïdie primaire, qui peut être guérie par la chirurgie. Dans les cas où le traitement de la maladie responsable ne peut pas être envisagé à moyen ou long terme, la mise en route d’un traitement médical est à visée symptomatique.
A Traitement de l’hyperparathyroïdie primaire
Seule l’ablation de la ou des lésions parathyroïdiennes responsables de l’hyperparathyroïdie primaire peut guérir la maladie.
Une opération est clairement indiquée en cas d’HPT primaire symptomatique (signes cliniques, atteintes osseuses, atteinte rénale), une calcémie > 2,75 mmol/l, une calciurie > 10 mmol par 24 heures, une clairance rénale de la créatinine < 60 ml/min, une baisse de la densité osseuse avec un T-score < – 2,5 DS (rachis, hanche ou poignet) et chez les sujets de moins de 50 ans.
L’indication chirurgicale est discutable chez les sujets de plus de 50 ans chez lesquels une HPT primaire a été découverte fortuitement, sans aucun retentissement fonctionnel ou organique, et avec des calcémies inférieures à 2,75 mmol/l. Pour cette population, qui représente aujourd’hui la majorité des patients avec une HPT primaire, l’alternative au traitement chirurgical est soit l’abstention thérapeutique, avec pour corollaire une surveillance clinique et biologique et une évaluation de l’évolution de la masse et de la densité osseuse au long cours, soit l’utilisation d’un traitement capable de freiner au long cours la sécrétion de PTH.
Les imageries parathyroïdiennes sont à envisager seulement si est retenue une indication opératoire. Elles ont pour intérêt de repérer la (ou les) parathyroïde(s) hyperfonctionnelle(s) responsable(s) de l’HPT primaire pour permettre d’envisager une intervention localisée à l’occasion d’une courte cervicotomie. La négativité de l’enquête morphologique ne remet pas en cause l’opportunité de l’intervention chirurgicale si l’intervention opératoire est fondée. À l’inverse, une imagerie positive ne doit pas influencer un diagnostic litigieux sur le plan biologique.
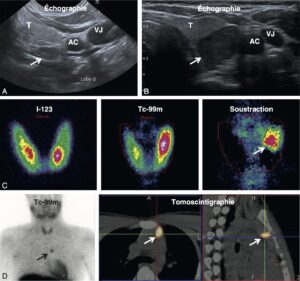
Les plus couramment utilisées et les plus performantes sont l’échographie et la scintigraphie au Sestamibi. Des exemples d’échographie et de scintigraphie parathyroïdienne sont illustrés par la figure 22.6. La scintigraphie parathyroïdienne permet aussi d’identifier les adénomes parathyroïdiens ectopiques dans le médiastin (dans le thymus, par exemple, fig. 6).
________________________________________________________________________________
Fig. 6.
Imagerie parathyroïdienne.
A. et B. Deux exemples d’adénome parathyroïdien (flèche) : il s’agit typiquement de lésion allongée, très hypoéchogène et postérieure à la thyroïde. C. Scintigraphie parathyroïdienne, méthode de soustraction. L’image correspond à l’image échographique illustrée en B. D. Image scintigraphique d’un adénome parathyroïdien ectopique, dans le médiastin (thymus).
T, thyroïde ; AC, artère carotide ; VJ, veine jugulaire.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
L’intervention s’effectue chez un patient correctement hydraté. Elle consiste en l’exérèse sélective de l’adénome qu’il ait été repéré en préopératoire (chirurgie mini-invasive) ou simplement lors de la cervicotomie large si l’enquête morphologique bien conduite s’était avérée négative (chirurgie conventionnelle).
Des complications rares de la chirurgie parathyroïdienne sont l’hypoparathyroïdie postopératoire et la lésion des nerfs récurrents.
B Traitement médical de l’hypercalcémie
1 Bisphosphonates
Les bisphosphonates sont hypocalcémiants parce qu’ils sont de puissants inhibiteurs de la résorption osseuse. Ils ont considérablement simplifié l’approche thérapeutique de l’hypercalcémie non accessible à un traitement étiologique (essentiellement les hypercalcémies paranéoplasiques).
2 Calcimimétiques
Ces molécules agissent comme modulateurs allostériques du récepteur sensible au calcium CaSR (présent aussi au niveau des cellules parathyroïdiennes adénomateuses ou néoplasiques, cf. fig. 22.1) et freinent la sécrétion de la parathormone. Ce traitement (cinacalcet, Mimpara®) est actuellement utilisé pour les hypercalcémies des rares carcinomes parathyroïdiens et des hyperparathyroïdies primaires non accessibles à un traitement chirurgical, et dans les hyperparathyroïdies secondaires de l’insuffisance rénale. Mais il doit encore être évalué sur de grandes séries d’hyperparathyroïdie primaire par adénomes parathyroïdiens avant de constituer une alternative à la chirurgie, chez le sujet âgé et asymptomatique, s’il démontre son efficacité à long terme.
3 Traitement d’une hypercalcémie maligne
________________________________________________________________________________
Une hypercalcémie supérieure à 3,7 mmol/l [150 mg/l] constitue une urgence médicale du fait du risque de coma, de collapsus ou d’arrêt cardiaque.
________________________________________________________________________________
Le traitement repose sur une réhydratation idéalement par voie orale si l’état du patient l’autorise (5 à 6 litres de boissons) ou par voie intraveineuse : 200 à 500 ml/h de sérum physiologique, en fonction de l’état cardiovasculaire. La diurèse forcée par du furosémide n’est plus recommandée. L’administration en perfusion lente de bisphosphonate (4 mg de zolendronate si la fonction rénale est normale ou 60 ou 90 mg de pamidronate en cas d’insuffisance rénale) permet de corriger la calcémie dans 80 % des cas, mais la durée de son effet varie de quelques jours à quelques semaines. Une corticothérapie par voie IV est efficace dans les hypercalcémies des myélomes, des hémopathies et dans la sarcoïdose. Enfin, une dialyse permet en urgence d’abaisser rapidement une hypercalcémie maligne et d’attendre le relais par les autres traitements.
________________________________________________________________________________
Points-clés
- Affirmer une hypercalcémie est facile en répétant le simple dosage de la calcémie totale.
- L’interprétation de la calcémie doit tenir compte de la fonction rénale, de la protidémie et de l’acidose.
- Les étiologies des hypercalcémies sont multiples, mais la plus fréquente est l’hyperparathyroïdie primaire.
- Le diagnostic étiologique peut être orienté par le contexte clinique (tumeurs malignes).
- L’analyse des résultats de la calcémie et de la PTH1-84 doit permettre de faire le diagnostic de l’hyperparathyroïdie primaire ou d’orienter vers d’autres causes.
- L’hyperparathyroïdie primaire chez le sujet jeune ou avec une présentation syndromique ou dans un contexte familial doit déclencher une enquête génétique.
- Une hypercalcémie supérieure à 3,7 mmol/l [150 mg/l] constitue une urgence médicale ; son traitement repose dans un premier temps sur une réhydratation.
________________________________________________________________________________
© CEEDMM – Août 2022.
